Презентація на тему:
Презкнтація Біологія
Завантажити презентацію
Презкнтація Біологія
Завантажити презентаціюПрезентація по слайдам:
Алкани, алкени, алкіни Презентацію підготувала учениця 11-А класу Трачук Олеся ProPowerPoint.Ru
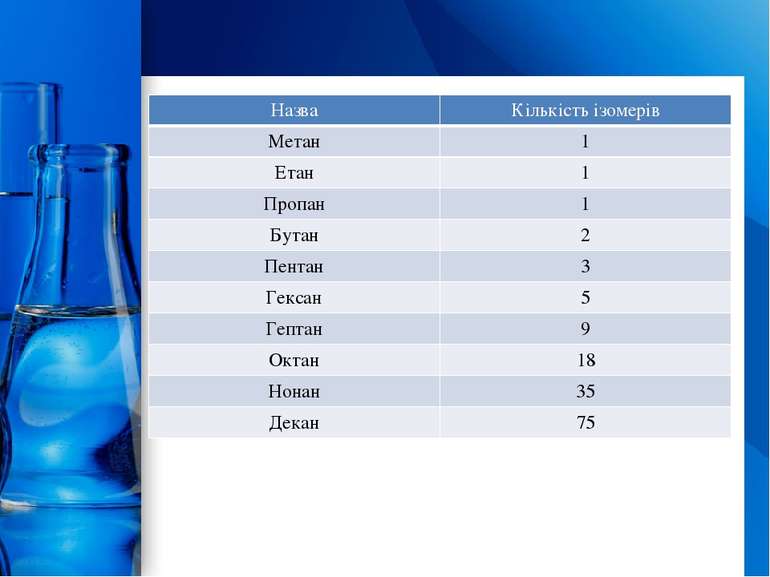
Для алканів здебільшого характерні структурні ізомери. Перші три члени гомологічного ряду алканів мають тільки по одному ізомеру. Тим часом бутан має вже два ізомери: Пентан має вже три ізомери: Ізомери алканів ProPowerPoint.Ru
Назва Кількістьізомерів Метан 1 Етан 1 Пропан 1 Бутан 2 Пентан 3 Гексан 5 Гептан 9 Октан 18 Нонан 35 Декан 75 ProPowerPoint.Ru
У лабораторних умовах метан добувають взаємодією алюміній карбіду з водою (а) або нагріванням суміші натрій ацетату з натрій гідроксидом (б): Al4C3 + 12H2O 4Al(OH)3 + 3CH4 (а) CH3COONa + NaOH Na2CO3 + CH4 (б) Інші алкани можна отримати взаємодією металічного натрію з моногалогенпохідними алканів (реакція Вюрца): 2H3C–CH2–Br +2Na H3C–CH2–CH2–CH3 + 2NaBr t t ProPowerPoint.Ru
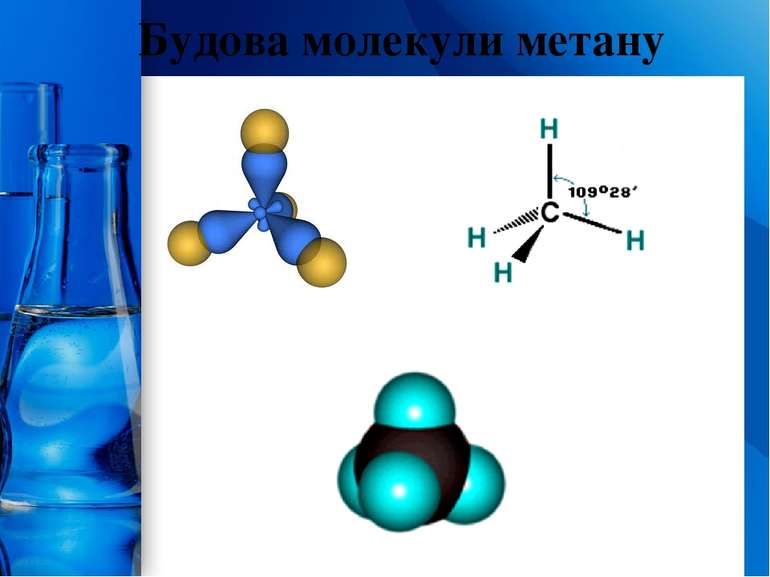
У молекулах алканів є лише неполярні й доволі міцні σ-зв’язки C – C і C – H. Тому сполуки малоактивні в хімічних реакціях. Однак за жорстких умов (висока температура, підвищений тиск, ультрафіолетове опромінення тощо) ці сполуки можуть вступати в деякі реакції: повне окиснення (горіння): 2H3C–CH3 + 7O2 4CO2 + 6H2O 2. часткове окиснення (каталітичне окиснення): H3C–(CH2)n–CH3 суміш оксигеновмісних сполук 3. розкладання: H3C – CH3 2C + 3H2 Хімічні властивості алканів t ProPowerPoint.Ru
4. заміщення: CH4 + Cl2 CH3 – Cl + HCl CH4 + HONO2 CH3–NO2 + H2O 5. ізомеризація: H3C – CH2 – CH2 – CH3 H3C – CH – CH3 I CH3 t/AlCl3 t hv ProPowerPoint.Ru
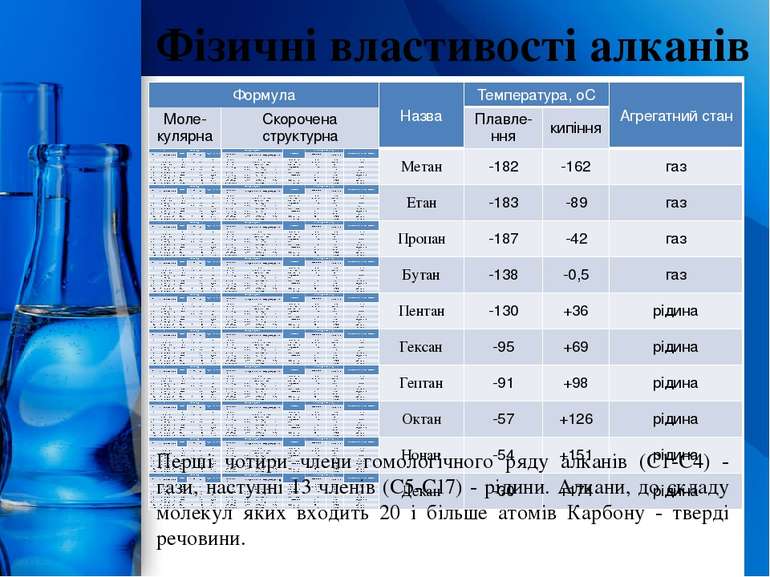
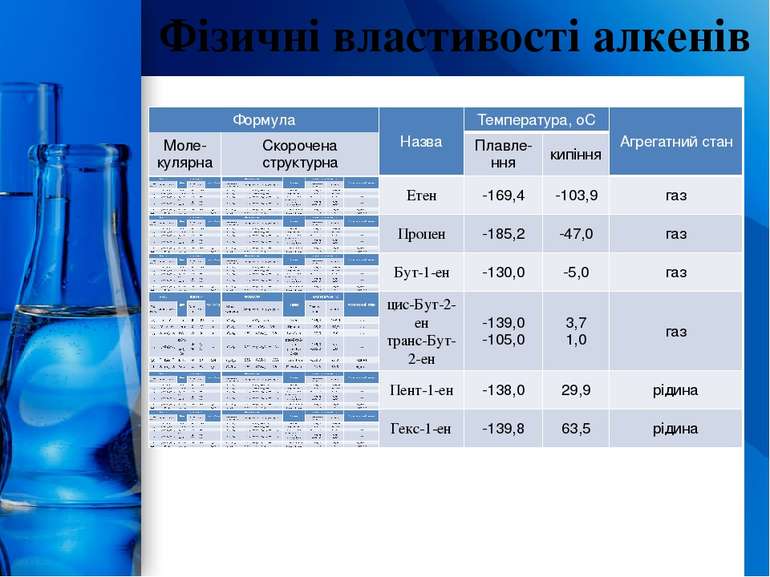
Фізичні властивості алканів Перші чотири члени гомологічного ряду алканів (С1-С4) - гази, наступні 13 членів (С5-С17) - рідини. Алкани, до складу молекул яких входить 20 і більше атомів Карбону - тверді речовини. ProPowerPoint.Ru
Застосування алканів Алкани широко використовують у різних галузях промисловості і сільського господарства. Метан є сировиною для отримання багатьох хімічних продуктів, паливом на підприємствах і в побуті. З вищих алканів добувають ароматичні вуглеводні, застосовують як паливо для двигунів внутрішнього згорання (бензини), для дизельних двигунів (солярові масла), реактивних двигунів (гас). Насичені вуглеводні – добрі розчинники жирів і деяких інших органічних речовин. ProPowerPoint.Ru
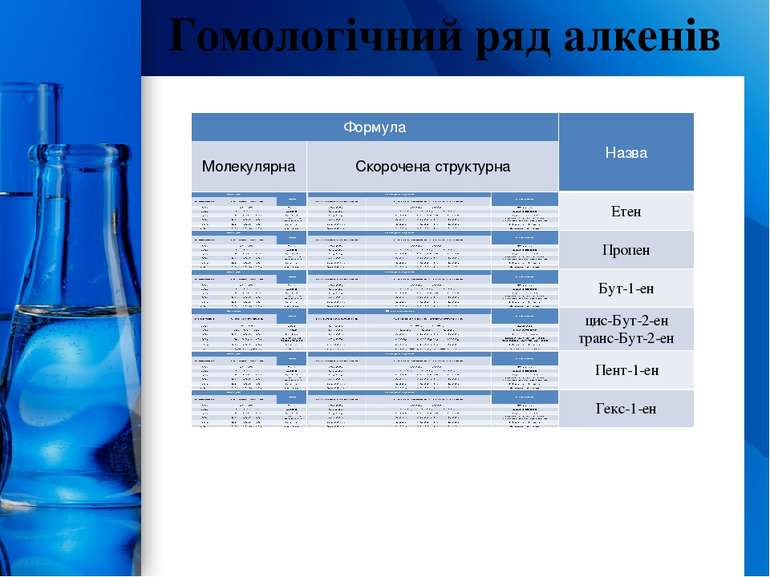
У алкенах з нерозгалуженим карбоновим ланцюгом нумерацію атомів Карбону починають із того кінця, до якого ближче перебуває подвійний зв’язок. У назві відповідного алкану закінчення -ан замінюється на -ін (-ин). У розгалужених алкенах головний ланцюг вибирають так, щоб він містив подвійний зв’язок, навіть якщо він при цьому й не буде найдовшим. Перед назвою головного ланцюга вказують номер атома Карбону, при якому перебуває замісник, і назву цього замісника. Номер після назви головного ланцюга вказує положення подвійного зв’язку, наприклад: Номенклатура алкенів ProPowerPoint.Ru
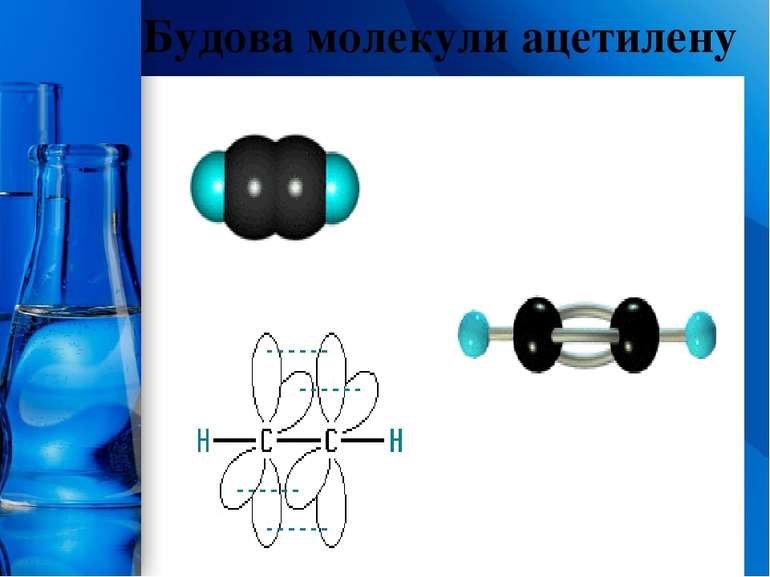
Будова молекул алкенів Характерна риса будови алкенів – наявність в молекулі одного подвійного карбон-карбонового зв'язку. Подвійний зв'язок утвориться за допомогою двох пар узагальнених електронів (чьотирьох-електронний зв'язок). Карбонові атоми, зв'язані подвійним зв'язком, знаходяться в стані sр2-гібридизації, кожний з них утворює три -зв'язки, що лежать в одній площині під кутом 120°. Негібридизовані орбіталі р-електронів розташовані перпендикулярно до площини -зв'язків і паралельно один одному і внаслідок «бічного» перекривання утворюють другий зв'язок, який називається -зв'язком. Електронна хмара -зв'язку частково розташована над площиною, а частково під площиною, у якій лежать атоми. Таким чином, подвійний зв'язок являє собою сполучення - і -зв'язків. Бічне перекривання негібридизованних р-орбіталей, що утворюють -зв'язок, зближує атоми Карбону і відстань між ними стає коротшою – довжина подвійного С=С-зв'язку 0,133 нм (довжина простого С-С-зв'язку 0,154 нм). Схема розташування атомів і зв'язків у молекулі етилену: ProPowerPoint.Ru
Ізомери алкенів Структурні ізомери алкенів можуть відрізнятися будовою карбонового ланцюга і положенням подвійного зв'язку. Так, для бутену С4Н8 відомі три ізомери: СН2 = СН – СН2 – СН3 (бут-1-ен) СН3 – СН = СН – СН3 (бут-2-ен) СН2=С–СН3 (метил-пропен) СН3 Цей приклад показує, що число ізомерів у алкенів вище, ніж у алканів. Для етиленових сполук можлива просторова ізомерія, що пов'язана з розташуванням замісників стосовно площини подвійного зв'язку. Ця ізомерія спостерігається в тих випадках, коли кожний з атомів Карбону, зв'язаних подвійним зв'язком, витрачає інші дві одиниці валентності на зв'язок із двома різними замісниками. Розташування пари однакових замісників по одну сторону площини подвійного зв'язку дає цис-ізомер, по різні сторони — транс-ізомер, наприклад: ProPowerPoint.Ru
(цис-бут-2-ен (tпл = –139,3°С, tкип = +3,7°С)) (транс-бут-2-ен(tпл= –105,8°С, tкип= +0,96°С)) Перетворення цих ізомерів один в одного вимагає обертання навколо подвійного зв'язку, тобто необхідно порушити перекривання р-орбіталей і розірвати -зв'язок. На це потрібно затратити понад 250 кДж/моль енергії. Такий енергетичний бар'єр утруднює обертання й обумовлює існування цис-транс-ізомерів як стійких індивідуальних речовин. Природа цієї ізомерії така ж, як у заміщених циклах. Як правило, транс-ізомери більш стійкі, мають більш високу температуру плавлення. При нагріванні цис-транс-ізомери можуть переходити один в одний: між ними встановлюється рівновага. ProPowerPoint.Ru
Способи добування алкенів Подвійний C=C-зв’язок утворюється внаслідок відщеплення двох замісників від сусідніх атомів Карбону насичених сполук. Зокрема, алкени є продуктами таких реакцій: 1. відщеплення галогеноводню від моногалогенпохідних алкану: HC3 – CH – CH2 + NaOH H3C – CH=CH2 + NaCl + H2O H Cl 2. відщеплення галогену від дигалогенпохідних алканів, у яких атоми галогену зв’язані з сусідніми атомами Карбону: H3C – CH – CH – CH3 + Zn H3C – CH = CH – CH3 + ZnCl2 Cl Cl 3. відщеплення води від спиртів: H2C – CH2 H2C = CH2 + H2O H OH 4. відщеплення водню від алканів (дегідрогенізація): H2C – CH2 H2C = CH2 + H2O H H Спирт t ProPowerPoint.Ru
У промисловості значні кількості алкенів отримують крекінгом нафтопродуктів. Внаслідок крекінгу алканів утворюється 50% алканів і 50% алкенів. Під час крекінгу С – С зв’язок може розриватися у будь-якому положенні, тому утворюється складна суміш насичених і ненасичених сполук. ProPowerPoint.Ru
3. Реакції полімеризації: Алкени, як й інші ненасичені сполуки, вступають у реакції полімеризації. Внаслідок полімеризації утворюються високомолекулярні сполуки (полімери). Етен за високого тиску й підвищеної температури утворює поліетилен: nH2C=CH2 n (–CH2 – CH2 –) ProPowerPoint.Ru
Застосування алкенів Алкени широко використовують у промисловості органічного синтезу для отримання різноманітних речовин. Наприклад, етен є сировиною для добування етанолу, 1,2-дихлоретану, поліетилену. Його використовують у сільському господарстві для прискорення дозрівання плодів. Пропен є сировиною для отримання пропан-2-олу, ацетону, гліцеролу і поліпропілену. ProPowerPoint.Ru
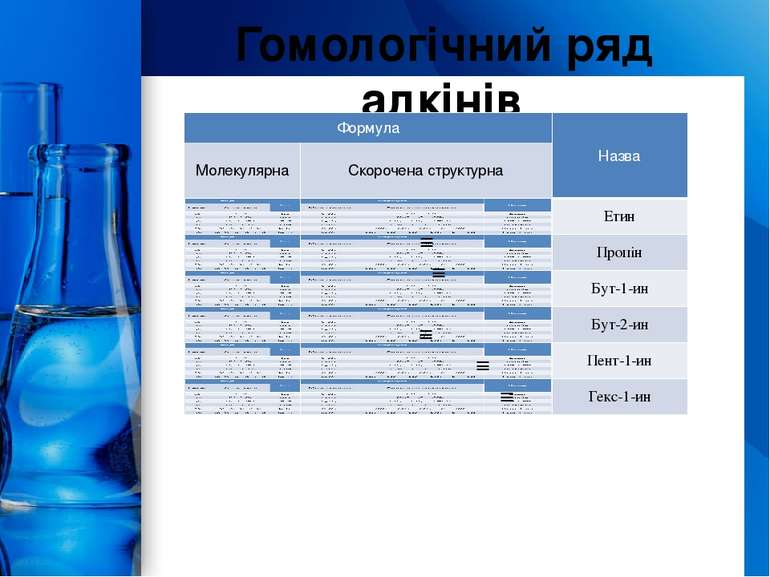
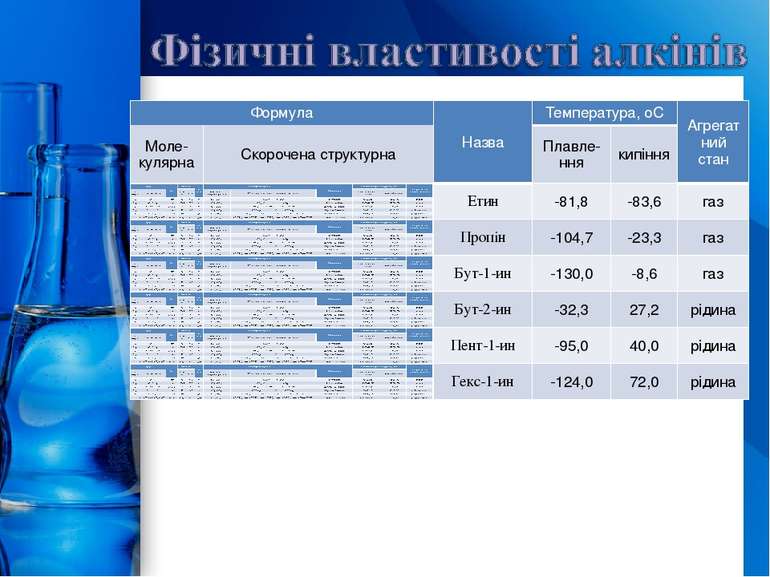
Номенклатура алкінів Назви алкінів утворюють із назв відповідних насичених вуглеводнів заміною суфікса -ан на суфікс -ин (-ін). Якщо молекула алкіну розгалужена, головним ланцюгом вважають найдовший із тих, що містить потрійний зв’язок. Нумерують атоми Карбону головного ланцюга з того краю, до якого ближче знаходиться потрійний зв’язок. ProPowerPoint.Ru
Ізомери алкінів Структурна ізомерія 1. Ізомерія положення потрійного зв’язку (починаючи з С4Н6): СН С СН2 СН3 СН3 С С СН3 бутин-1 бутин-2 2. Ізомерія карбонового скелету (починаючи з С5Н8): СН С СН2 СН2 СН3 СН С СН СН3 СН3 пентин-1 3-метилбутин-1 3. Міжкласова ізомерія з алкадієнами і циклоалкенами, (починаючи з С4Н8): СН = СН СН С–СН2–СН3 СН2=СН–СН=СН2 СН2 –СН2 бутин-1 бутадієн-1,3 циклобутен ProPowerPoint.Ru
Способи добування алкінів Найпоширеніший представник алкінів – ацетилен. У промисловості його добувають трьома методами. Карбідний метод. Спочатку з вапняку і коксу отримують кальцій карбід, який під час взаємодії з водою утворює ацетилен. CaCO3 CaO + CO2 CaO + 3C CaC2 + CO CaC2 + 2H2O CH CH + Ca(OH)2 Піроліз метану. Внаслідок нагрівання метану без доступу повітря (піроліз) утворюється ацетилен, а як побічний продукт – водень. 2CH4 CH CH + 3H2 Дегідрогалогенування дигалогенопохідних алканів. t 2500Oc 1500Oc ProPowerPoint.Ru
Хімічні властивості алкінів Хімічні властивості алкінів обумовлені наявністю в їхніх молекулах потрійного зв’язку. Типовими реакціями для ацетилену та його гомологів є реакції приєднання. Відмінність алкінів від алкенів полягає в тому, що реакції приєднання можуть протікати у дві стадії. На першій стадії йде приєднання до потрійного зв’язку утворенням подвійного зв’язку, а на другій стадії — приєднання за подвійним зв’язком. Реакції приєднання для алкінів протікають повільніше, ніж для алкенів. 1. Галогенування. Галогени приєднуються до алкінів у дві стадії. Наприклад, приєднання брому до ацетилену призводить до утворення диброметену, який, у свою чергу, реагує з надлишком Вr2 з утворенням тетраброметану: Алкіни, так само як і алкени, знебарвлюють бромну воду. 2. Гідрогалогенування. Галогеноводні приєднуються до потрійного зв’язку важче, ніж до подвійного. Для активації галогеноводню використовують АlСl3. З ацетилену при цьому можна добувати вінілхлорид (хлоретен), який використовують для добування важливого полімеру — полівінілхлориду: ProPowerPoint.Ru
У разі надлишку галогеноводню відбувається повне гідрогалогенування, причому для несиметричних алкінів на кожній стадії приєднання йде за правилом Марковникова, наприклад: 3. Гіоратація. Приєднання води до алкінів каталізується солями ртуті (II): На першій стадії реакції утворюється ненасичений спирт, в якому гідроксильна група перебуває безпосередньо в атома Карбону при подвійному зв’язку. Такі спирти заведено називати вініловими, або енолами. Прикметною рисою енолів є їхня нестійкість. У момент утворення вони ізомеризуються в більш стабільні карбонільні сполуки (альдегіди або кетони) за рахунок перенесення протона від гідроксильної групи до сусіднього атома Карбону при подвійному зв’язку. При цьому подвійний зв’язок між атомами Карбону розривається й утворюється подвійний зв’язок з атомом Карбону та атомом Оксигену. Причиною ізомеризації є більша міцність подвійного зв’язку С=О порівняно з подвійним С=С. ProPowerPoint.Ru
У результаті реакції гідратації тільки ацетилен перетворюється в альдегід; гідратація гомологів ацетилену протікає за правилом Марковникова, і утворені еноли ізомеризуються в кетони. Наприклад, пропін перетворюється в ацетон: Реакцію гідратації алкінів відкрив М.Г. Кучеров (1881 р.), саме тому її й називають реакцією Кучерова. 4. Кислотні властивості. Особливістю алкінів, що мають кінцевий кратний зв’язок, є їхня здатність відщеплювати протон під дією сильних основ, тобто проявляти слабкі кислотні властивості. Таким чином, алкіни, на відміну від алкенів та алканів, здатні утворювати солі, які називають ацетиленідами: Ацетиленіди Аргентуму и Купруму(I) легко утворюються й випадають в осад при пропусканні ацетилену через аміачний розчин аргентум оксиду або купрум (І) хлориду. Ці реакції слугують для виявлення алкінів з потрійним зв’язком у кінці ланцюга: ProPowerPoint.Ru
Ацетиленіди Арґентуму й Купруму як солі дуже слабких кислот легко розкладаються при дії хлороводневої кислоти з виділенням вихідного алкіну: Таким чином, використовуючи реакції утворення й розкладу ацетиленідів, можна виділяти алкіни із сумішей з іншими вуглеводнями. 5. Полімеризація. У присутності каталізаторів алкіни можуть реагувати один з одним, причому залежно від умов утворюються різні продукти. Так, під дією водного розчину СuСl та NH4Cl ацетилен димеризується, утворюючи вінілацетилен: Вінілацетилен має велику реакційну здатність, приєднуючи хлороводень, він утворює хлоропрен, який використовують для добування штучного каучуку: При пропусканні ацетилену над активованим вугіллям при температурі +600°С відбувається тримеризація ацетилену з утворенням бензену: ProPowerPoint.Ru
В аналогічні реакції тримеризації можуть також вступати й найближчі гомологи ацетилену, наприклад: 6. Реакції окиснення й відновлення. Алкіни легко окиснюються різними окисниками, зокрема калій перманганатом. При реакції розчин калій перманганату знебарвлюється, що свідчить про наявність потрійного зв’язку. При окисненні зазвичай відбувається розщеплення потрійного зв’язку, утворюються карбонові кислоти: У присутності металевих каталізаторів алкіни відновлюються шляхом послідовного приєднання молекул водню, перетворюючись спочатку в алкени, а потім в алкани: ProPowerPoint.Ru
Застосування алкінів Серед усіх алкінів найбільше застосовують ацетилен (етин). Світова продукція його обчислюється мільйонами тонн за рік. Більша частина C2H2 витрачається на зварювання і різання металів. Ацетилен також є сировиною для отримання багатьох хімічних речовин: оцтового альдегіду, оцтової кислоти, етанолу, галогенопохідних, етену та етану, синтетичного каучуку, пластичних мас тощо. Чистий етин має типовий для ненасичених вуглеводнів запах, виявляє наркотичну дію, тому знаходить застосування в медицині. ProPowerPoint.Ru
Схожі презентації
Категорії





















![Хімічні властивості алкенів кат. H2SO4 (конц.), t [OH-] ProPowerPoint.Ru Хімічні властивості алкенів кат. H2SO4 (конц.), t [OH-] ProPowerPoint.Ru](https://svitppt.com.ua/images/62/61835/770/img24.jpg)





































![Хімічні властивості алкенів кат. H2SO4 (конц.), t [OH-] ProPowerPoint.Ru Хімічні властивості алкенів кат. H2SO4 (конц.), t [OH-] ProPowerPoint.Ru](https://svitppt.com.ua/images/62/61835/210/img24.jpg)