Презентація на тему:
БІОХІМІЯ НЕРВОВОЇ СИСТЕМИ ч.І
Завантажити презентацію
БІОХІМІЯ НЕРВОВОЇ СИСТЕМИ ч.І
Завантажити презентаціюПрезентація по слайдам:
БІОХІМІЯ НЕРВОВОЇ СИСТЕМИ Ч. І. Особливості хімічного складу та метаболізму НС. Нейротрофіни. Гематоенцефалічний бар’єр та ліквор
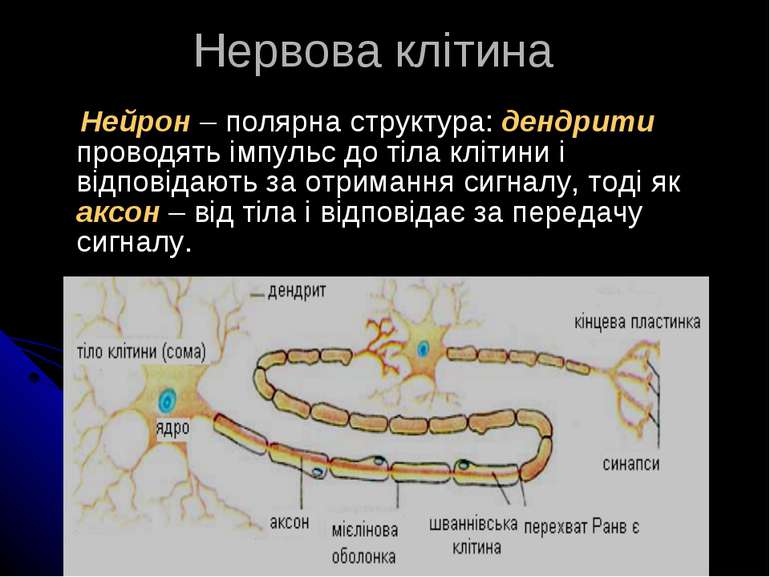
Нейрон – полярна структура: дендрити проводять імпульс до тіла клітини і відповідають за отримання сигналу, тоді як аксон – від тіла і відповідає за передачу сигналу. Нервова клітина
Найважливіші для нейрохімії функціональні елементи нейрона Плазматична мембрана Мієлін Перехват Ранв’є (оголені безмієлінові ділянки ПМ) Аксони і дендрити Синапс як утворення, що забезпечує взаємодію між нейронами та між нейроном й іншими клітинами
Нейроглія Рудольф Вірхов у 1846 р описав речовину, яку він вважав за цементуючу основу, що поєднує в єдине ціле всі елементи нервової системи, і назвав її “нейроглія” (від грец. Glia – клей) Клітини нейроглії (біля 50% об’єму ЦНС і понад 90% всіх її клітин) не є нейронами, не здатні до збудження, не можуть генерувати потенціал дії і не залучені у проведення нервових імпульсів. Це олігодендрогліальні клітини ЦНС та шванівські клітини периферійної нервової системи, які після диференціювання не втрачають здатності до поділу і проліферації. Більшість пухлин мозку – це гліоми, що виникають через злоякісний ріст гліальних клітин. Функції нейроглії: Контроль за позаклітинним оточенням нейрону (зокрема, акумуляція іонів К, поглинання і метаболізм нейромедіаторів (глутамату)) Вплив на інтеграцію нервових клітин (здійснення міжклітинних щілинних контактів); Постачання нервової клітини поживними речовинами, метаболітами і ростовими факторами (щодо останніх – то і їх біосинтез); Участь у відновленні пошкоджених нейронів Олігодендрогліальні клітини ЦНС і шванівські клітини периферійної НС огортаються навколо аксону і утворюють мієлінову оболонку, причому різні відростки такої олігодендрогліальної клітини можуть огортатися навколо різних аксонів, що може сприяти здійсненню інтеграції і координації роботи цілої групи нейронів
Мікроглія (клітини Ортегі) і астроцити Сильно розгалуджені клітини, за розмірами менші за нейрогліальні клітини Мікрогліальні клітини працюють як макрофаги (“імунокомпетентні клітини нервової системи”) Астроцити своїми чисельними відростками контактують зі стінками мікрокапілярів і діють як селективні фільтри, що пропускають деякі сполуки із крові у міжклітинний простір нейронів і затримують інші, створюючи тим самим гематоенцефалічний бар’єр. Інші функції – участь в метаболізмі ГАМК і глутамінової кислоти; ізоляція рецепторних поверхонь нейронів; при патології здатні проліферувати і заміщувати мертві нейрони; фагоцитоз; синтез біологічно-активних сполук (фактор росту нервів, компоненти міжклітинного матриксу ламінін і фібронектин)
Мієлін За наявністю цієї багатошарової оболонки нервові волокна, утворені аксонами нейронів, відносять до мієлінових (м’якотних) або безмієлінових. До мієлінових належать ЦНС та провідникова система соматичної нервової системи – більш вдосконалі структури, які здатні передавати нервові імпульси з високою швидкістю (у 5-10 разів швидше, ніж безмієлінові такого ж діаметру; швидкість зростає при збільшенні діаметру волокна). ФУНКЦІЇ МІЄЛІНУ Ізоляція центральних і периферійних нервових волокон, що унеможливлює електричні контакти між нервовими волокнами у щільноупакованому пучку волокон (причина - дуже високий вміст у ньому ліпідів). Підвищення швидкості проведення нервового імпульсу шляхом збільшення провідності і через економію простору (завдяки наявності мієліну досягається компактність НС) і енергії. Так, в мієлінових волокнах сигнал передається не внаслідок послідовного відкриття і закриття іонних каналів на поверхні ПМ, а через стрибки потенціалу між сусідніми перехватами Ранв’є (відстань 1-2 мм), причому мієлін міжвузлів посилює проведення сигналу. Безхребетні, за виключенням річкового раку, не мають мієліну – проте є випадки початкових стадій мієлінізації, коли аксони вкриваються кількома шарами шваннівської клітини – протомієліном. Біла речовина мозку у вищих організмів на понад 50% складається з мієліну, тому порушення в утворенні мієліну під час онтогенезу чи зміни в його структурі у вже розвинутій НС призводять до тяжкої нейропатії.
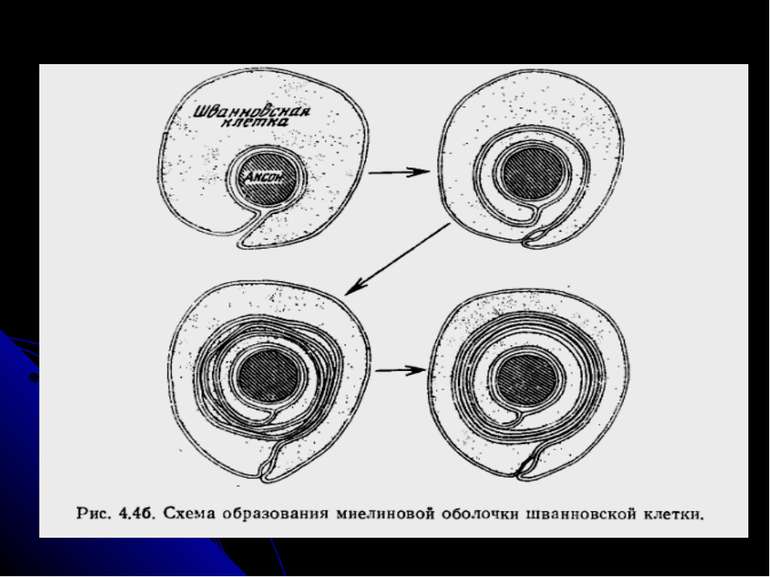
Структура і формування мієліну Зріла мієлінова оболонка – це кілька шарів мембрани шванівської клітини (в ЦНС – олігодендроциту), яка наче намотана навколо аксону. Кожне міжвузля утворюється при цьому із однієї клітини. Під час мієлінізації аксон спричиняє депресію на поверхні шванівської клітини (або олігодендроциту), яка починає рости і утворює навколо його спіраль. Збільшення числа витків спіралі (може бути понад 50) веде до стискання цитоплазми, через що ПМ шванівської клітини стає значно більш щільно упакованою. Паралельно морфологічному розвитку спостерігаються і молекулярні зміни, що стають причиною характерних особливостей складу мембрани мієліну порівняно з іншими плазматичними мембранами, у т.ч. мембранами звичайних шванівських клітин. Формування мієліну таким чином є складним синхронізованим процесом взаємодії аксона і нейроглії, будь-яке порушення якого спричиняє демієлінізацію.
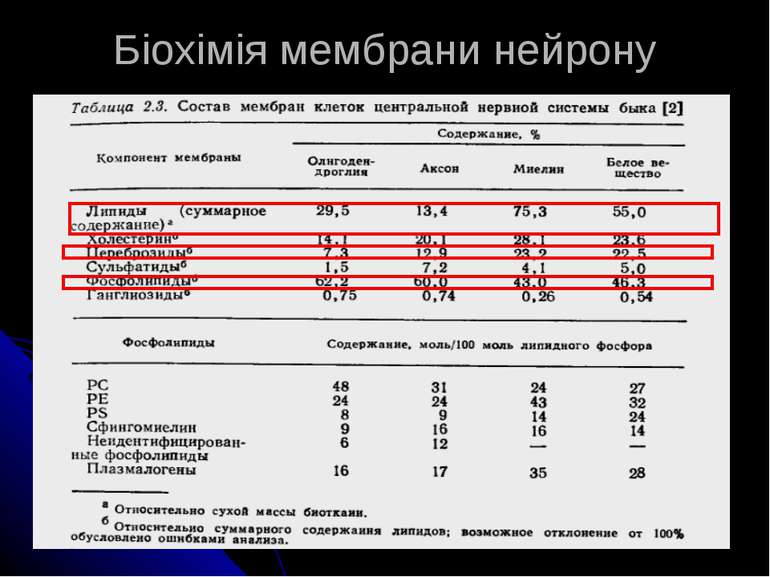
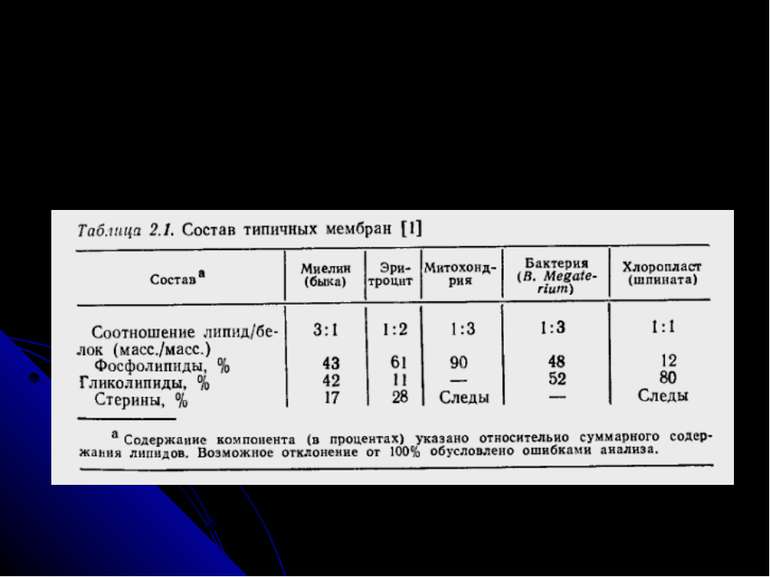
Хімічний склад мієліну: ліпіди Мієлін містить ліпідів більше, ніж будь-яка інша мембранна структура – до 78-80% сухої ваги, а також має великий вміст цереброзидів та цереброзидсульфатів, і знижений вміст гангліозидів і фосфоліпідів. При цьому вміст цереброзидів під час розвитку НС корелює зі ступенем мієлінізації і є змешеним при порушенні цього процесу. Ліпідів, специфічних для мієліну, не виявлено; В сфінголіпідах мієліну в 5-9 разів більше довголанцюгових жирних кислот (19-26 вуглецевих атомів), ніж у сфінголіпідах сірої речовини; в мієліні лише 1 з 17 жирних кислот є поліненасиченою, тоді як в сірій речовині – 1 з 5. Такий склад мієліну пояснює велику стабільність мієлінових оболонок: низький вміст поліненасичених жирних кислот, які знижують стабільність мембран, та велика концентрація довголанцюгових сфінголіпідів, що стабілізують їх. Білки – це друга важлива компонента мієліну (але їх відсоток невеликий).
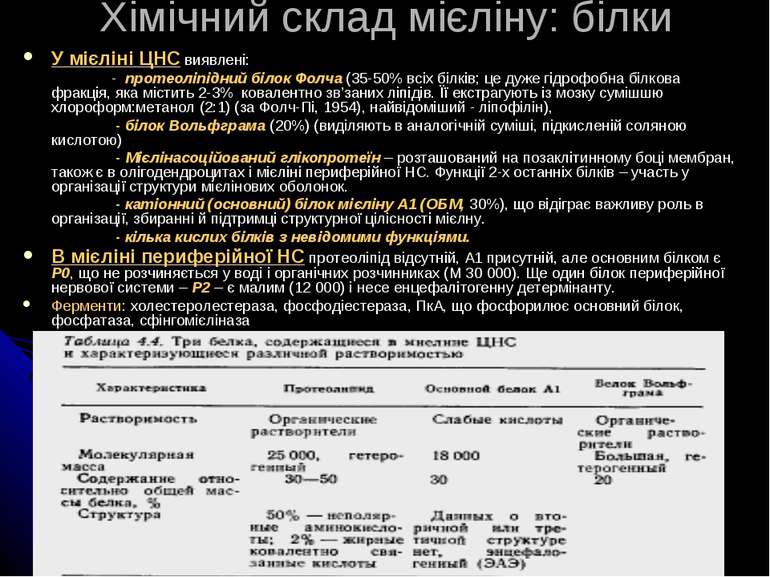
Хімічний склад мієліну: білки У мієліні ЦНС виявлені: - протеоліпідний білок Фолча (35-50% всіх білків; це дуже гідрофобна білкова фракція, яка містить 2-3% ковалентно зв’заних ліпідів. Її екстрагують із мозку сумішшю хлороформ:метанол (2:1) (за Фолч-Пі, 1954), найвідоміший - ліпофілін), - білок Вольфграма (20%) (виділяють в аналогічній суміші, підкисленій соляною кислотою) - Мієлінасоційований глікопротеїн – розташований на позаклітинному боці мембран, також є в олігодендроцитах і мієліні периферійної НС. Функції 2-х останніх білків – участь у організації структури мієлінових оболонок. - катіонний (основний) білок мієліну А1 (ОБМ, 30%), що відіграє важливу роль в організації, збиранні й підтримці структурної цілісності мієлну. - кілька кислих білків з невідомими функціями. В мієліні периферійної НС протеоліпід відсутній, А1 присутній, але основним білком є Р0, що не розчиняється у воді і органічних розчинниках (М 30 000). Ще один білок периферійної нервової системи – Р2 – є малим (12 000) і несе енцефалітогенну детермінанту. Ферменти: холестеролестераза, фосфодіестераза, ПкА, що фосфорилює основний білок, фосфатаза, сфінгомієліназа
Експериментальний аутоімунний енцефаломієліт як модель розсіянного склерозу Основна причина розсіяного склерозу – демієлінізація із наступним порушенням функції НС. Подібні симптоми виникають при введенні тканини мозку, суспендованої в ад’юванті Фрейда, у ЦНС тварини, або при введенні основного білка А1. Причина: при введенні основний білок сенсибілізує імунну систему і веде до виникнення експериментального алергійного енцефаломієліту (ЕАЕ). Механізм: Різні фрагменти поліпептидного ланцюга молекули ОБМ можуть проявляти енцефалітогенні властивості. Найважливіший носій енцефалітогенної детермінанти всього білка є нонапептид з послідовнстю амінокислот 114-122 (-Phe-Ser-Trp-Gly-Ala-Gly-Gln-Arg-). Ймовірно, структурна подібність триптофану білка А1 (116) і серотоніну перешкоджає нормальній дії серотоніну як нейромедіатора у певних ділянках ЦНС. Білок Р2 периферійної НС провокує розвиток експериментального алергійного невриту (ЕАН), прояви якого і механізм розвитку схожі на ЕАЕ. Введення інтактного мієліну не спричиняє таких наслідків через “замаскованість” білка А1. Ад’ювант — (adjuvant) сполука, що виступає неспецифічним стимулятором імуногенезу й іноді має антигенні властивості. Основна властивість більшості ад’ювантів - їх здатність депонувати антиген, тобто адсорбувати його на своїй поверхні й тривалий час зберігати в організмі, що збльшує тривалість його впливу на імунну систему. Ад’ювант Фрейда - це водно-жирова емульсія, що містить вазелинову олію, ланолін і емульгатор. Депонує антиген і посилює його поглинання фагоцитами
Інші захворювання, пов’язані із дефектами мієліну Інфекції, генетичні фактори, інтоксикації, порушення харчування - все це може спровокувати розвиток невропатій, що супроводжуються ураженням мієлінової оболонки Дифтерійний токсин, свинець, гексахлорофен, голодування у періоди, критичні для розвитку центральної нервової системи (у людини – перший рік життя, оскільки при народженні процеси мієлінізації ще не завершені) можуть спричинити порушення у мієліні. Низка дегенеративних захворювань ЦНС можуть бути спровоковані вірусами – напр., деякі форми розсіянного склерозу і аналогічна форма розладу периферійної нервової системи – синдром Ландрі-Гуіллян-Барре; хвороби Крейцфельд-Джакоба і куру, які розповсюджені серед мисливців за головами у Новій Гвінеї і якими заражаються через застосування в їжу ритуального блюда із мозку. Ці віруси за розмірами є меншими за звичайні, є стійкими до протеаз, нуклеаз, до нагрівання (80 С), обробки формальдегідом, УФ, ультразвуком, не проявляють антигенних властивостей. Руйнуванням мієліну супроводжуються сфінголіпідози, за яких внаслідок спадкової недостатності певних ферментів накопичуються сфінголіпіди. Для іншої групи хвороб руйнування мієліну стає не наслідком, а причиною.
Аксональний транспорт Аксон має власну систему транспорту макромолекул і молекул меншого розміру (“аксональний транспорт”, наст. слайд); Він складається із антероградного (від тіла нейрону до нервового закінчення) і ретроградного (в зворотньому напрямку) транспорту. Є також транссинаптичний транспорт – від нейрона до нейрона, а також транспорт від гліальної клітини до нейрона і навпаки, про який насьогодні мало що відомо. Синтез білків відбувається у тілі нейрону – тому білки аксональної і пресинаптичної мембрани, ферменти метаболізму і синтезу нейромедіаторів переносяться антероградним транспортом. Так же переносяться ті нейромедіатори, які синтезувалися у тілі нейрона (напр., катехоламіни, АХ, ГАМК). Можуть транспортуватися молекули фосфоліпідів, гліколіпідів і глікопротеїнів, а також цілі органели, напр., мітохондрії. Є кілька потоків антероградного транспорту (до 5), що різняться швидкістю, причому ідентичні молекули транспортуються із однаковою швидкістю: - повільним аксональним потоком (шв. 1-4 мм/добу) переносяться білки тубулін, актин, міозин, субодиниці нейрофіламентів, розчинні ферменти проміжного метаболізму. Якщо аксон відділити від тіла клітини – повільний транспорт зупиняється. - швидкі потоки переносять сполуки зі швидкістю 200-400 мм/добу. Вони можливі і в ізольованому від тіла аксоні (так переносяться мембранні білки, глікопротеїни, гліколіпіди, ферменти синтезу нейромедіаторів і самі медіатори) - проміжний транспорт (15 – 55 мм/добу) – так транспортуються, напр., мітохондрії ДНК, РНК і гангліозиди не транспортуються. Ретроградного повільного транспорту не спостерігається. Таким шляхом видаляються продукти деградації синапсів, переносяться ферменти, субстрати, які поглинулися пресинаптичною мембраною, напр., фактор росту нервів, токсин правцю і нейротропні віруси.
Аксональний транспорт: аксоплазма; механізми аксонального транспорту Аксоплазма – це гелеподібна маса, що унеможливлює просту дифузію макромолекул із наведеними на наступному слайді швидкостями. Аксоплазма переплетена численними філаментними структурами, які побудовані головним чином із білка і забезпечують гелеподібну консистенцію. Виділяють 3 типи філаментів аксоплазми : - мікротрубочки і мікрофіламенти, які присутні не лише у нейронах, а і в інших типах клітин. Мікротрубочки – це порожнинні трубки діаметром 24 нм; мікротрубочки, побудовані із тубуліну, під впливом колхіцину і вінбластину дисоціюють на субодиниці; одночасно пригнічується і аксональний транспорт. Мікрофіламенти – це волокна діаметром 8 нм. - нейрофіламенти, характерні лише для нейронів і клітин глії, представлені волокнами діаметром відповідно 10 нм.. Мікротрубочки, мікро- і нейрофіламенти переплітаються з акто-міозиновим комплексом аксоплазми і надають їй желеподібної консистенції. Роз’єднувачі окисного фосфорилювання та блокатори дихального ланцюга блокують транспорт, що вказує на його енергозалежність і потребу в кисні. Рослинний алкалоїд колхіцин є потужним інгібітором аксонального транспорту. Ця отрута є класичним інгібітором мітозу, що спричиняє дисоціацію філаментів апарату веретена. Багато чого в аксональному транспорті ще не досліджено, а саме: - чи є певна селективність або специфічність щодо сполук, які переносяться по аксону, чи будь-яка молекула може транспортуватися; - чи залучаються у транспортні процеси мембрани ЕПР.
Аксональний транспорт: механізми аксонального транспорту Ряд сполук переносяться у розчинному стані; інші (гормони, медіатори) – у складі пухирців або гранул Швидкий транспорт розчинених речовин найймовірніше відбувається не простою дифузією, а шляхом току рідини під дією гідродинамічного тиску через міжтубулярний простір Пухирці і гранули транспортуються по мікротрубочках за допомогою моторних білків, які використовують енергію АТФ (кінезин – для антероградного транспорту, динеїн – для ретроградного) При цьому білок зв’язується однією частиною із пухирцем (гранулою), а іншою – з нейротрубочкою і робить крокові переміщення, рухаючись уздовж останньої.
Аксональний транспорт: патологічні аспекти Деякі патологічні стани причетні до аксонного і ретроградного транспорта: - віруси поліомієліту й герпесу, що пошкоджують нервову систему, траспортуються по аксонах до тіла клітини; токсин правцю, який виробляють бактерії, що потрапили у рану на шкірі, надходить шляхом ретроградного транспорта по аксону до ЦНС, де стає причиною м язових судом, які можуть викликати смерть - низка невропатій, а також впливи деяких промислових токсинів (акриламід) - фактори, що порушують енергетичний метаболізм у аксонах (напр., цим пояснюються порушення, спричинені хв. бері-бері та алкогольним поліневритом)
Аксоплазматичні білки, причетні до аксонального транспорту Тубулін можна виділити із мозку як димер, що складається із двох с/о - α і β, амінокислотна послідовність яких є високогомологічною. Мікротрубочки – це полімери тубуліну. Процеси асоціації і дисоціації молекул тубуліну знаходяться у рівновазі, на яку впливають температура, вміст Са++ і ГТФ, фосфорилювання. Крім того, у фізіологічних умовах асоціації сприяють білки, що зв’язані із мікротрубочками (MAPs – microtubule-associated proteines) і білок збирання тубуліну (TAP – tubulin assembly protein). Нейрофіламенти теж складаються із кількох специфічних білків (напр., нейрофіламенти нейрона кроля містять 3 білка, а гігантського аксона кальмара – 2). В усіх аксонах виявлені білки актин і міозин. Високій вміст актину наводить на думку про його залучення до аксонального транспорту, хоча це ще не доведено. Оскільки аксональний транспорт є Са++-залежним процесом, дія останнього часто опосередковується білком кальмодуліном. Комплекс (Са-КМ) може діяти: - як алостеричний регулятор активності низки білків; - через активацію Са++,КМ-залежних ферментів; Приклади впливу комплексу (Са-КМ): - інгібування збирання тубуліну; - регуляція секреції нейромедіаторів нервовим закінченням (це теж Са++-залежний процес). Кальмодулін, в свою чергу, може регулюватися дією білка кальциневрину (серин/треонінова фосфопротеїнфосфатаза, ідентична фосфопротеїнфосфатазі 2В), що має 2 субодиниці – кальциневрин А і В, специфічно зв’язує КМ, має також і центри зв’язування Са++ і володіє фосфатазною активністю.
Нейроспецифічні білки Критерії нейроспецифічних білків: 1) містяться переважно у нервовій тканині або їх вміст у ній більший ніж в інших тканинах; 2) залучені у специфічні функції НС 3) існує тісний зв’язок між їх активністю і функціональним станом НС Нейроспецифічні білки можуть бути виключно або переважно нейрональними або гліальними, а за внутрішньоклітинною локалізацією – цитоплазматичними, ядерними або мембрано-пов’язаними. Особливе значення мають білки, що розташовані в мембранах синапсу. Є низка нейронспецифічних білків із ще невідомими функціями,
Нейроспецифічні білки .Білок S-100 широко представлений у глії (невеликий вміст є і у нейронах), має цитоплазматичну і мембрано-зв’язану форми. Виявлено його структурну гомологію із Са++-зв’язуючою с/о тропоніну. Можливо, він залучений у розвиток НС та її пластичність - його рівні зростають при навчанні, тренуванні, виробленні умовних рефлексів у тварин. Білок 14-3-2 є лише в цитоплазмі нейронів ЦНС. Це гомодимер, що має енолазну активність; інші нейроспецифічні білки-ферменти – альдолаза, ВВ-ізофермент КК, ЛДГ-1 і ЛДГ-2. Білок GAP-43 – з експресією цього фосфобілка пов’язують початок диференціювання нейрону: відросток, який накопичує GAP-43, у подальшому обов’язково стане нейроном. Білок Р-400 виявлений у мозочку, відповідає за контроль рухів. Білок В-50 – мембранний, міститься у мембранах синапсів, фосфорилюється ДАГ- та Са-залежними формами ПкС; таке фосфорилювання стимулює синаптичну передачу. Фодрин – структурний білок постсинаптичних мембран глутаматергічних синапсів. Є блокатором рецепторів глутамату. Кальпаїн – Са-залежна протеїназа, одним із субстратів якої є фодрин, при розщепленні якого рецептори до глутамату звільнюються. Група неферментативних білків-глікопротеїнів НС, які відповідають за клітинну адгезію і розпізнання. Скоротливі і цитоскелетні білки НС (тубулін, актин, міозин, актоміозинподібні білки (нейростенін), кінезин (забезпечує антероградний рух макромолекул по аксонах), динеїн (ретроградний), клатрин (ендоцитоз)
Нейроспецифічні білки Група білків, які секретуються з метою транспорту і захисту від руйнування пептидних регуляторів, синтезованих у ЦНС (нейрофізини – нековалентно зв’язуються з нейропептидами, що запобігає руйнуванню останніх); Нейротрофіни – регуляторні молекули: фактор росту нервів (NGF), ростовий фактор, який виробляється мозком (BDGF) і нейротрофін-3 (NT-3) Білки мієліну Є також нейронспецифічні білки, що виявляються при наявності генетичних нервових розладів. Так, наявність білка PcI Duarte – специфічного білка мозку – пов’язують із захворюванням на шизофренію. За допомогою імунологічних методів виявлено поверхневі антигени нейрональної мембрани – NS1, NS2, L1 – з невідомими функціями, і N-CAM – фактор адгезії нервових клітин, залучений у розвиток НС. Взагалі, виявлено, що мозок експресує понад 300 000 генів, продукти яких все ще не досліджені. Глія також має свої специфічні білки (приклад – білок S-100)
Нейротрофіни: відкриття На початку 1950-х рр. Ріта Леві-Монтальчіні й Віктор Хамбургер показали, що in vitro й in vivo загибель або збереження нейронів залежать від тканин-мішеней, які їми інервуються. Це відкриття невздовж було відмічене присудженням Нобелівської премії. Надалі було отримано фактор росту нервів (ФРН; Nerve Growth Factor, NGF) й доведено синтез цього фактора росту тканинами-мішенями, а також встановлено, що нейрони намагаються отримати ФРН. Фактори росту є поліфункціональними регуляторами й належать до класу цитокінів Поряд із нейротрофінами майже всі відомі класичні і нові фактори росту за певних умов можуть здійснювати трофічну підтримку певних груп нейронів, оскільки в нервовій системі присутні рецептори більшості трофічних факторів, а внутрішньоклітинні системи передачі сигналів у ядро, які використовуються різними рецепторами, взаємно перекриваються. Однак роль інших нейротрофних факторів у розвитку і функціонуванні нервової системи є набагато меншою за вплив нейротрофінів
Цитокіни (довідка) Цитокіни - це різноманітні білки, які здійснюють передачу сигналів між різними клітинами організму. У людини ідентифіковано понад сто різних цитокінів, і постійно з’являються повідомлення про відкриття нових. Цитокіни впливають на клітину, сполучаючись зі специфічними рецепторами на цитоплазматичній мембрані і спричиняючи каскадну реакцію, яка веде до індукції, посилення чи пригнічення активності низки генів, які ними регулюються. Цитокін може мати кілька ефектів, різні цитокіни - одинакові ефекти. Цитокін може впливати на низку клітин і тканин організму. В більшості випадків клітина організму є мішенню кількох цитокінів. Один цитокін може регулювати утворення і функціонування іншого. За функціональною ознакою цитокіни згруповані у кілька великих родин (Ройт, 2000): - інтерлейкіни, - інтерферони, - хемокіни, - колонієстимулювальні фактори, - фактори некрозу пухлин (ФНП; Tumor Necrosis Factor, TNF), - фактори росту, зокрема ФРН.
Ростові фактори у нервовій системі Нейротрофіни Ф-р росту нервів (NGF) Brain-derived neurotrophic factor (BDNF) Нейротрофін 3 (NT3) Нейротрофін 4/5 (NT4/5) Нейрокіни Війчастий нейротрофний фактор (Ciliary neurotrophic factor, CNTF) Інгібіторний фактор лейкемії (LIF) Інтерлейкін 6 (IL-6) Кардіотрофін 1 (CT-1) Ф-ри росту фібробластів FGF-1 FGF-2 Суперродина трансформуючих ф-рів росту Трансформуючий фактор росту- (TGF ) Морфогенетичні фактори кістки (BMPs) Нейротрофний фактор глії (Glial-derived neurotrophic factor, GDNF) Суперродина ф-рів росту епідермісу Epidermal growth factor (EGF) Transforming growth factor (TGF ) Інші ф-ри росту Ф-р росту тромбоцитів (PDGF) Інсулін-подібний ф-р росту I (IGF-I)
Нейротрофіни Нейротрофіни - регуляторні білки нервової тканини, що мають найпотужніший трофичний влив на всі основні процеси життєдіяльності нейронів. В організмі, що розвивається, вони синтезуються клітиною-мішенню (напр., м’язовим веретеном), дифундують у напрямку нейрону, зв’язуються з молекулами рецепторів на його поверхні, внаслідок чого ініціюється сигнальний каскад, що спричиняє активний ріст аксону. В результаті аксон досягає клітини-мішені і встановлює з нею синаптичний контакт. Фактори росту підтримують життя нейронів , останні за їх відсутності не можуть існувати. Вони діють локально в місці звільнення і особливо інтенсивно індукують розгалудження дендритів (арборизацію) і ріст аксонів (спрутінг) у напрямку клітин-мішеней. Синаптичний спрутінг, який забезпечує "репосилення" існуючих нейрональних потоків і утворення нових полісинаптичних зв’язків, зумовлює пластичність нейрональної тканини і формує механізми, які залучені у відновлення порушених неврологічних функцій. Білки цієї родини мають високогомологічні амінокислотні послідовності й здатні утворювати гомодимери, причому димеризація є обов’язковою умовою для здійснення біологічних функцій нейротрофінів. Найвивченішими нейротрофінами, близькими один до одного за структурою, є: - фактор росту нервів (NGF); - фактор росту, виділений із головного мозку (BDNF); - нейротрофін-3 (NT-3), а також NT-6 й NT4/5 (у різних видів просто NT4 або NT5 ).
Участь нейротрофінів у функціонуванні НС Розвиток нервової системи Розвиток процесів ішемічного ушкодження тканини мозку - в основі лежить недостатність трофічного забезпечення. Природною захисною реакцією мозку в перші хвилини ішемії є синтез трофічних факторів і рецепторів до них. За швидкої та активної экспресії генів, які кодують нейротрофіни та інші фактори росту, ішемія мозку може тривало не спричиняти інфарктні зміни. Таким чином, важливим напрямком вторинної нейропротекції є розробка і втілення у клінічну практику препаратів з вираженими нейротрофічними й ростовими властивостями. Ендогенні фактори росту є ідеальними претендентами для лікування інсульту, оскільки мають нейропротективні, репаративні й проліферативні властивості. Однак значні розміри поліпептидної молекули нейротрофіну не дозволяють йому проникати через гематоенцефалічний бар’єр, що обмежує можливості його терапевтичного застосування. Доведено нейропротективні властивості bFGF, BDNF, протизапального цитокіну TGF-бета1, інсулін-залежного фактора росту (IGF), які при введенні після індукції ішемії зменшують розмір інфарктної зони на 35-50%.
Механізми впливу нейтрофінів Сигнали від нейтрофінів передаються двома типами рецепторів: 1) TRKA, TRKB, TRKC, що належать до рецепторних тирозинових протеїнкіназ і специфічно взаємодіють з різними нейтрофінами; 2) p75NTR, який взаємодіє із всіма нейтрофінами. Рецептори виявлені окрім нейронів у різноманітних тканинах.
Механізми впливу NGF та інших нейротрофінів Ефекти NGF на ріст нейронів і виживання опосередковані високоафінним рецептором TRKA (Tyrosine Kinase Receptor-A) і низькоафінним рецептором p75(NTR) (p75 Neurotrophic Receptor). Тому NGF може спричиняти як нейропротективну дію (через TRKA рецептор), так і запускати апоптоз в деяких клітинах (через p75 рецептор). Є три інші подібні Trk-рецептори, TrkВ і TrkC. Також є інші ростові фактори, структурно подібні NGF: BDNF (Brain-derived neurotrophic factor), NT-3 (Neurotrophin-3) і NT-4 (Neurotrophin-4). TrkA зв’язує і активується NGF TrkB опосередковує ефекти від BDNF і NT-4 TrkC зв’язує і активується NT-3. NT-3 також зв’язується із TrkA і TrkB, але з меншою афінністю.
Brain-derived neurotrophic factor ( BDNF) BDNF – це другий нейротрофін, що був охарактеризований після NGF. Brain-derived neurotrophic factor ( BDNF) діє на нейрони ЦНС і периферійної НС, сприяє виживанню нейронів і відповідає за ріст і диференціювання нових нейронів і синапсів. У мозку він є активним у гіпокампі, корі і базальних ядрах, які відповідають за навчання, пам’ять і мислення. BDNF сам по собі є важливим для функціонування довготривалої пам’яті. Хоча переважна більшість нейронів мозку ссавців формується в постнатальний період, деякі ділянки дорослого мозку мають здатність до росту нових нейронів із нейрональних стволових клітин у процесі, що отримав назву нейрогенез. Нейротрофіни стимулюють і регулюють нейрогенез, серед яких BDNF володіє найбільшою активністю. BDNF виявлено не лише в мозку, але й в ретині, ЦНС, мотонейронах, нирках, простаті. Також BDNF може модулювати активність численних рецепторів нейромедіаторів, включаючи нікотиновий р-р до АХ. BDNF зв’язується як мінімум із 2-ма рецепторами на поверхні клітин-мішеней - TrkB і p75.
Нейтрофіни: патологічні аспекти За нейродегенеративних розладів (хв.. Альцгеймера, Гентінгтона) виявлено зміни в рівнях NGF, так же, як і за психіатричних розладів, напр.., при депресіях. Так, виявлено знижені рівні BDNF у мозку хворих на хв. Альцгеймера, хоча природа цього є незрозумілою. Дослідження вказують на протективну роль нейротрофінів проти токсичності бета-амілоїду. Показано зв’язок BDNF із такими розладами, як депресія, шизофренія, маніакально-депресивний синдром, синдром Ретта, деменція, анорексія-булімія. Зростання рівнів BDNF може індукувати зміни, подібні до опіатної залежності. Вплив стресу або стресових гормонів знижує експресію BDNF у щурів, і, якщо вплив є тривалим, це спричиняє атрофію гіпокампу. Атрофія гіпокампу та інших лімбічнх структур спостерігається також і у людей із хронічною депресією. Вплив збуджуючого нейромедіатора глутамату, навантажувальні вправи, обмеження калорійності їжі, інтелектуальне навантаження, лікування депресії (антидепресанти і електроконвульсивна терапії, обмеження у сні) підвищують експресію BDNF у мозку. Високі рівні BDNF і речовини P асоційовані з підвищенням можливості розвитку екземи. Епілепсія також пов’язана із поліморфізмами у BDNF. Рівні як mRNA BDNF, так і білка BDNF є підвищеними за епілепсії. BDNF модулює збуджуючі і гальмівні сигнали у синапсах шляхом пригнічення ГАМК-рецептор-опосередкованих постсинаптичних подій, що і лежить в основі механізмів розвитку епілепсії.
Особливості метаболізму НС Висока інтенсивінсть метаболізму: за використанням кисню і глюкози мозок займає першість (20-25% кисню, що надходить до організму, і до 70% глюкози, яка виділяється із печінки в артеріальну кров). Глюкоза є основним субстратом окиснення. Власні глікогенні резерви мозку є незначними, тому цей орган є найчутливішим до гіпоксії і гіпоглікемії. Найбільш інтенсивно метаболізм протікає у філогенетично більш молодих відділах НС: максимальною швидкість дихання є в корі великих півкуль, мінімальною – у спинному мозку і в периферійних нервах; для нейронів цей показник є вищим, ніж для гліальних клітин. Як другорядні енергетичні субстрати клітини НС можуть використовувати глутамат і аспартат, в умовах голодування і в ранній постнатальний період – жирні кислоти і кетонові тіла. Висока інтенсивність енергетичного обміну є фактором, що забезпечує протікання таких процесів, як передача нервового імпульсу, зберігання і обробка інформації, яка надходить, інтегративна діяльність мозку.
Особливості метаболізму НС Метаболізм амінокислот у НС має характерні риси; Особливу роль відіграють дикарбонові амінокислоти, вміст і інтенсивність метаболізму яких у ГМ є набагато вищими за інші тканини: глутамінова к-та, глутамін, ГАМК, аспарагінова к-та і N-ацетиласпарагін складають біля 75% вього пулу амінокислот у ГМ. Низка ароматичних амінокислот виступає або нейромедіаторами, або попередниками останніх (катехоламінів, серотоніну). Порушення, в т.ч. і генетичні, обміну і транспорту амінокислот спричиняють тяжкі неврологічні розлади. Важливе значення у НС мають специфічні альтернативні шляхи перетворення низки ключових метаболітів, напр., α-кетоглутарату, пірувату. Так, ГАМК-шунт є різновидом циклу Кребса, який виявлено лише у нервових клітинах і фізіологічне значення якого полягає в утворенні нейромедіатора ГАМК із α-кетоглутарату. Для НС характерна чітко виражена компартменталізація метаболізму. Як приклад можна навести специфічні метаболічні реакції, що протікають у синаптичних закінченнях і лежать в основі функціональної активності синапсів. Для метаболізму мозку характерна висока автономія відносно інших ділянок організму, яка забезпечується функціонуванням гематоенцефалічного бар’єру.
Специфічні функції НС, які потребують енергозатрат Передача нервового імпульсу – для створення електрохімічного градієнту за рахунок функціонування Na,K-АТФази та його відновлення після проходження нервового імпульсу Процеси зберігання і переробки інформації – синтез специфічних білків, нейропептидів, компонентів ліпо- і глікопротеїнових комплексів, що залучені в окремі етапи цих процесів; Синаптична передача – енергетично-залежне фосфорилювання синаптичних білків забезпечує вихід низки нейромедіаторів у синаптичну щілину та їх зворотнє поглинання. Аксональний і ретроградний транспорт – функціонування білків тубуліну, кінезину, ін Підтримання певної конформації білків нейрофіламентів за рахунок їх фосфорилювання/дефосфорилювання, що важливо для певної просторової локалізації нервових відростків, а отже для здійснення нейрональних контактів, організації функціональних ансамблів нейронів і для інтегративної функції мозку
Поняття про гематоенцефалічний бар єр ГЕБ - це фізіологічний механізм, що вибірково регулює обмін речовин між кров ю і ЦНС і забезпечує відносну постійність складу, фізико-хімічних і біологічних властивостей ліквору Він здійснює захисну функцію, запобігаючи потраплянню у ліквор і мозок (головний і спинний) низки чужорідних сполук, що надходять у кров, і проміжних продуктів обміну речовин, що утворюються в організмі за деяких патологичних станів. В здійсненні функції ГЕБ беруть участь анатомічні елементи, розташовані між кров ю і нейронами: ендотелій капілярів, базальна мембрана клітин, нейроглія, судинні сплетення, оболонки мозку, основна речовина, що складається із мукополісахаридів (глікозаміногліканів). У цих структурах відбуваються ферментативні реакції, що сприяють перебудові, окисленню, нейтралізації і руйнуванню речовин, які надходять із крові Регулююча функція ГЕБ оцінюється за коефіцієнтом проникності - тобто відношенням вмісту тієї чи іншої сполуки у лікворі до її концентрації у сироватці крові. Для більшості досліджуємих сполук ця величина менше одиниці; лише для іонів Mg і Cl - більше У мозку є т. зв. “безбар єрні зони”, в яких введені у кров речовини надходять майже без перешкод (ніжка гіпофізу, нейрогіпофіз, епіфіз); в інших ділянках (напр., гіпоталамус) проникність ГЕБ по відношенню до біогенних амінів, електролітів, деяких чужорідних сполук є вищою, ніж в інших ділянках мозку, що забезпечує своєчасне надходження гуморальної інформації у вищі вегетативні центри
Поняття про гематоенцефалічний бар єр (продовження) Виникнення низки патологічних процесів м.б. пов язане зі зростанням чи із зниженням проникності ГЕБ. ГЕБ має вищу проникність у ембріонів і новонароджених по відн. до дорослої людини - із цим частково пов язана висока лабільність нервової системи у дітей ГЕБ є саморегулюючою системою, стан якої залежить від потреб нейронів і від рівня метаболічних процесів не лише у мозку, а й в інших тканинах організму; ГЕБ регулюється нейрогуморальним шляхом Зниження бар єрної функції ГЕБ сприяє проникненню в ЦНС чужорідних сполук і продуктів метаболізму; посилення опору ГЕБ частково чи повністю закриває шлях гормонам, метаболітам, медіаторам, захисним сполукам. Обмежена проникність ГЕБ по відношенню до низки хіміотерапевтичних засобів (сполуки ртуті, вісмуту, миш яку), антибіотиків (пеніцилін, стрептоміцин), антитілами (антитоксини, агглютиніни, гемолізини) часто стає перешкодою для лікування захворювань ЦНС. Для зниження бар єрної функції в таких випадках застосовують перегрів чи охолодження організму, вплив рентгенівських променів, тощо. За неефективності лікувальні речовини вводять безпосередньо у ліквор
Біохімія спинномозкової рідини (ліквору) Спинномозкова рідина утворюється у судинних сплетеннях шлуночків ГМ, надходить у субарахноїдальні простори ГМ і спинного мозку в результаті діалізу плазми крові через стінки судин - тому її якісний склад аналогічний плазмі, але кількісні показники інші Ліквор, розміщений в еластичному «мішку» оболонки мозку, оточує ГМ як “водяна подушка”, а спинний мозок - як “рукав”, і тому виконує специфічні функції Функції ліквору: - при механічних ударах він передає тиск у всі сторони рівномірно, що запобігає ушкодженню мозку; - регулює внутрішньочерепний тиск - підтримує осмотичний тиск в клітинах ГМ і його оболонках - транспортує метаболіти - виконує респіраторну функцію - видаляє продукти метаболізму нервових клітин У дорослої людини - 110-160 мл ліквору (з них у спинномозковому каналі - 50 - 70 мл) Оновлення ліквору йде безперервно зі шв. 0,2 - 0,8 мл/хв, що залежить від внутрішньочерепного тиску (чим нижче - тим швидше); оновлюється ліквор від 1 до 6-ти разів на добу; за добу у здорової людини утворюється 350 - 1150 мл ліквора Дослідження біохімічного складу ліквору важливе при діагностиці й диференційній діагностиці низки ушкоджень ЦНС -менінгіти, внутрішньомозкові крововиливи, пухлини
Біохімічний склад ліквору: білки та метаболіти азотистого обміну Склад ліквору залежить від віку: з 6 місяців життя і до глибокої старості він постійний, тоді я к у дітей до 6-ти місяців він має низку особливостей - підвищений вміст загального білка, меншу концентрацію цукру, тощо. Ліквор дітей містить менше альбумінів, а у лікворі людей похилого віку більше глобулінів (IgG i IgA). Гіпопротеїнархія (зниження рівня білка в лікворі) нижче 0,22 г/л (норма - 0,22 - 0,9 г/л, у новонароджених - 0,6 - 0,9 г/л) - ознака гідроцефалічного ліквору Гіперпротеїнархія - показник патологічного процесу (травма, пухлина, запалення, внутрішньомозкові крововиливи) внаслідок порушення гемодинаміки в судинах мозку, що спричиняє зростання проникності їх стінок і надходження білкових молекул плазми крові у ліквор Ліквор здорової людини багатий на вільні амінокислоти - медіатори (ГАМК, гліцин), попередники біогенних амінів-медіаторів (тирозин, триптофан), амінокислоти, залучені у знешкодження аміаку (глутамат, глутамін, аспартат). Вільні амінокислоти або переносяться через гематоенцефалічний бар єр за участю специфічних транспортерів (які є для нейтральних амінокислот, основних і дикарбонових), або синтезуються безпосередньо у ЦНС (глутамат, аспартат, аланін, глутамін). В лікворі виявляється 20 - 25 амінокислот, вміст їх нижчий, ніж у сироватці. Вміст амінокислот має діагностичне значення за епілепсії, наркоманії, хв. Паркінсона, хореї Гентінгтона, генетичного захв. на фенілпіровіноградну олігофренію, тощо В лікворі виявляють сечовину, сечову к-ту, креатинін - вони не мають великої діагностичної цінності. Поява у лікворі аміаку є поганою із т.з. прогнозів ознакою
Біохімічний склад ліквору: вуглеводи і ліпіди Норма вмісту глюкози в лікворі - 2,22 - 3, 33 ммоль/л; в невеликій к-ті містяться фруктоза й глікоген. Транспорт глюкози в ліквор відбувається шляхом полегшеної дифузії і глюкоза складає 70% від її вмісту у крові. Зменшення її вмісту - гіпоглікоархія - при туберкульозних, бактреіальних і гнійних менінгітах (внаслідок посилення гліколізу, порушення гематоенцефалічного бар єру, посиленного використання глюкози клітинами), первинних і метастатичних пухлинах оболонок ГМ (через інтенсивне метаболізування глюкози клітинами пухлин за порушеної проникності гематоенцефалічного бар єру), внутрішньомозкових крововиливах Гіперглікоархія - спостерігається порівняно рідко (епілепсія, епідемічний енцефаліт), вона не характерна навіть для цукрового діабету. Через зменшення кровообігу й зменшення загального мозкового метаболізму спостерігається фізіологічна гіперглікоархія під час сну За захворювань нервової системи вміст глюкози у лікворі зростає або зменшується без аналогічних змін у складі крові Вміст загальних ліпідів у крові низький (0,1 - 0,02 г/л) - серед них холестерол, фосфоліпіди (1,5% від їх вмісту у сироватці крові - сфінгомієлін, лізолецитин, серин, фосфатидилетаноламін). Дослідження фосфоліпідного спектру має велике діагностичне значення стосовно хронічних демієлінізуючих захворювань
Біохімічний склад ліквору: мінеральні речовини, рН, ферменти і фізіологічноактивні речовини Основні мінеральні компоненти ліквору: натрій, калій, хлор, магній, кальцій, бікарбонат, неорганічний фосфор, залізо, мідь, цинк рН ліквору - 7,35 - 7,40; буферна система ліквору не має гемоглобінової буферної системи; внесок у регуляцію кислотно-лужного балансу ліквору білкової системи менший, т.я. вміст білка у лікворі у порівн. із плазмою є нижчим. Тому основною буферною системою ліквору є бікарбонатна Основні ферменти ліквору походять із тканин мозку: альдолаза, ЛДГ1 (в сироватці крові основним є ЛДГ2; важливий при діагностиці менінгітів, злоякісних пухлин), амінотрансферази (АсАТ і АлАТ), лейцинамінотрансфераза, бета-глюкуронідаза (важлива при діагностиці злоякісних пухлин), гамаглутамілтрансфераза, креатинфосфокіназа (при пухлинах і судинних захв. - ВВ ізоформа, при метастазах у мозок - ВВ і ММ), фосфатази (ЛФ і КФ - їх активність зростає при менінгітах, поліомієлітах), холінестерази, протеїназа і рибонуклеаза (діагн. важливі при розсіяному склерозі) Фізіологічно-активні речовини: медіатори (АХ, НА, дофамін, серотонін, субстанція Р, ендорфіни, енкефаліни), гормони (мелатонін), власне фізіологічноактивні сполуки (кініни, простагландини, циклічні нуклеотиди)
Схожі презентації
Категорії