Презентація на тему:
Відкритий урок хімії
Завантажити презентацію
Відкритий урок хімії
Завантажити презентаціюПрезентація по слайдам:
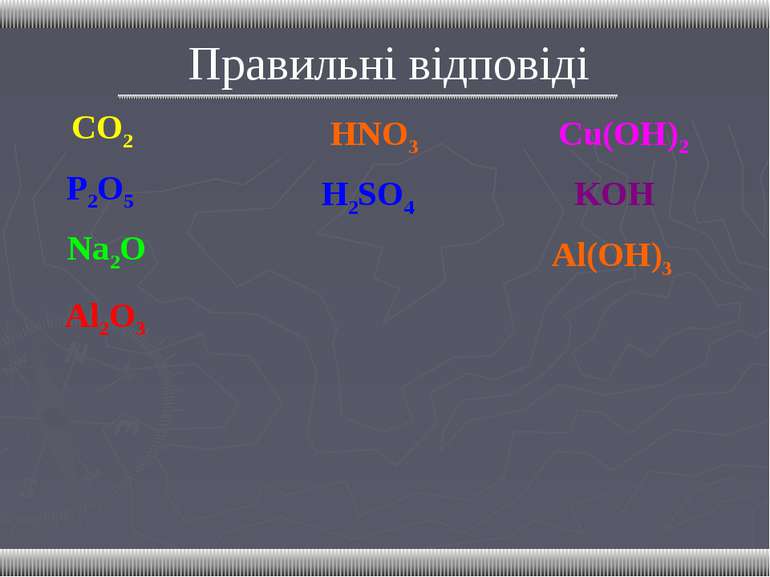
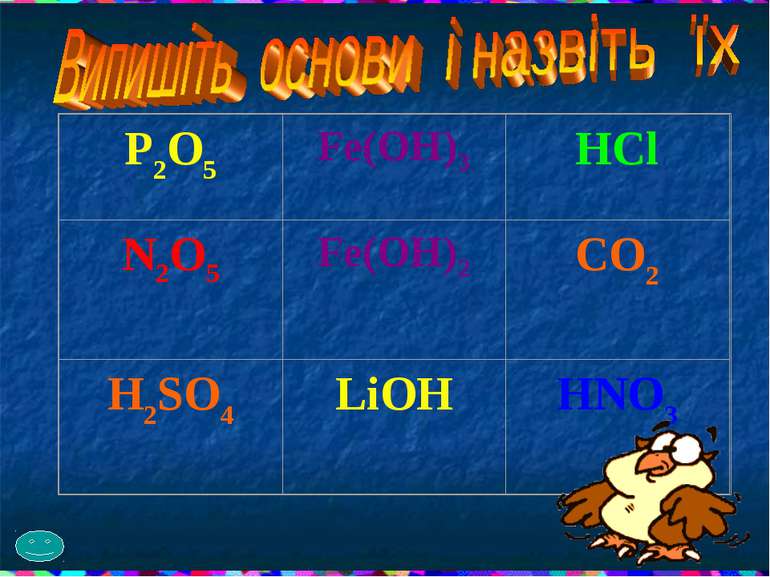
Гра “Хрестики – нулики” В дві колонки виписати оксиди, кислоти. В окрему колонку виписати тих, хто лишився.
Тема. ОСНОВИ: поняття, склад і назви, класифікація, виявлення, використання Мета уроку: проконтролювати знання учнів про склад основ; вивчити фізичні властивості основ; активізувати пізнавальну діяльність учнів на всіх етапах уроку; розвивати їх логічне мислення та творчі здібності; виховувати витримку, силу волі, уміння співпрацювати та об’єктивно оцінювати свою роботу та роботу інших учнів. Тип уроку: комбінований.
Загальна формула основ Ме(ОН)n Основи – це складні речовини, в яких атоми металів з’єднані з гідроксигрупою.
НАЗВИ ГІДРОКСИДІВ УТВОРЮЮТЬСЯ ТАК : назва металу + гідроксид NaOH натрій гідроксид Якщо метал має змінну валентність : назва металу + валентність металу + гідроксид Fe(OH)3 ферум ( ІІІ ) гідроксид
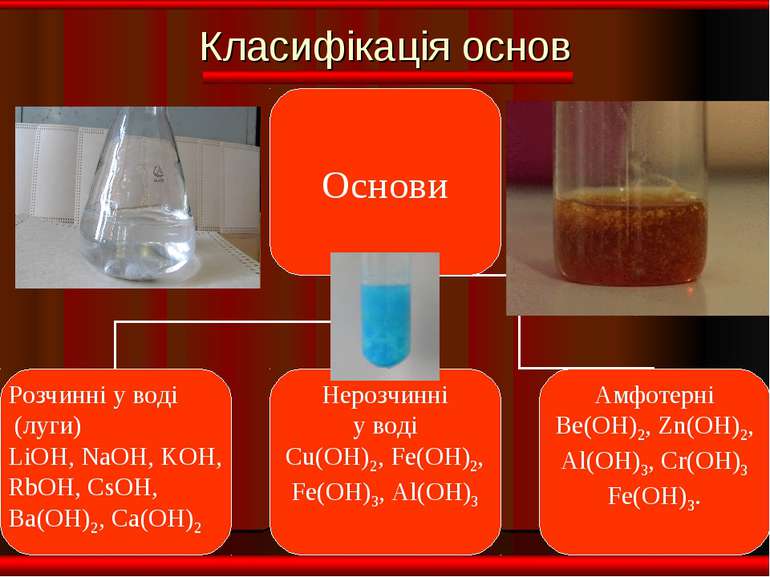
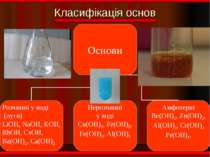
Фізичні властивості ОСНОВИ Розчинні Нерозчинні тверді; білі; без запаху; милкі на дотик; добре розчинні у воді. тверді; різнокольорові; без запаху; не милкі на дотик; не розчинні у воді.
Будьте обережні!!! Потрапляння їдких лугів на шкіру призводить до опіків, а на одяг – до його руйнування! В хімічний клас заходь в халаті, Комфортно буде, як у хаті, І тому під час дифузій Тобі не трапиться конфузій. Не лий води до кислоти- Очей лишитись можеш ти. Не заглядай у різну “воду”, Бо загубити можеш вроду!!!
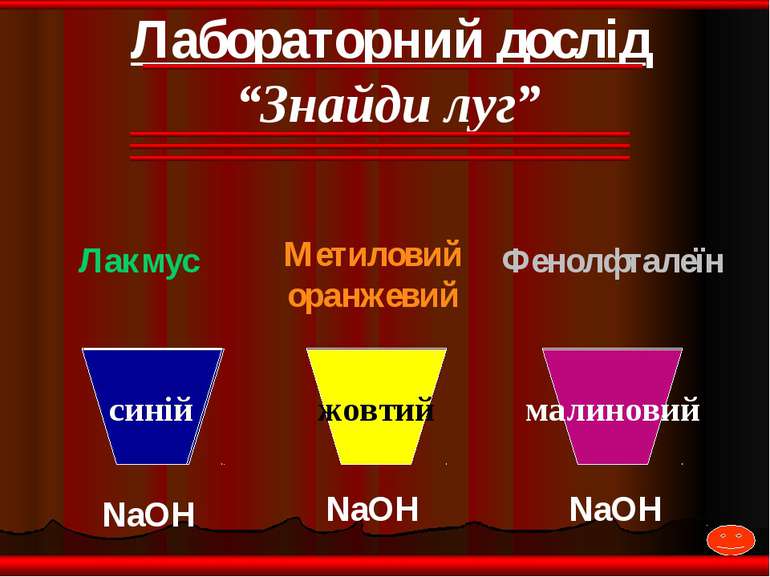
NaOH NaOH NaOH Лакмус Метиловий оранжевий Фенолфталеїн жовтий малиновий синій Лабораторний дослід “Знайди луг”
Використання основ: Са(ОН)2 Будівництво, цукрова промисловість, зубні пасти, фарбування дерев. NаОН Виготовлення твердого мила, паперу, ліків, штучного волокна, миючих засобів, шкіряній промисловості, очищення нафти . КОН Виготовлення рідкого мила, електроліт.
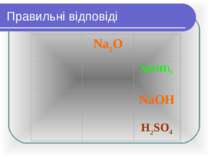
Правильні віповіді: Fe(OH)3 ферум (ІІІ) гідроксид Fe(OH)2 ферум (ІІ) гідроксид LiOH літій гідроксид
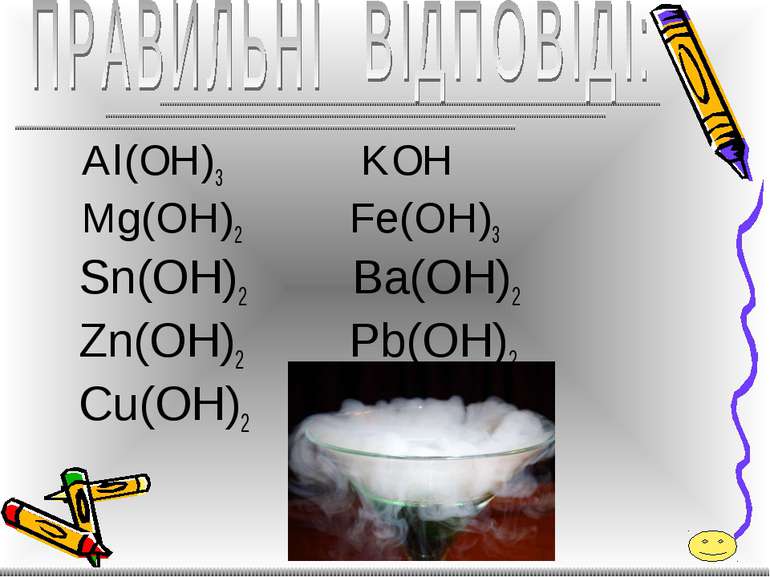
СКЛАДІТЬ ФОРМУЛИ ГІДРОКСИДІВ: - алюмінію; - калію; - магнію; - феруму( ІІІ ); - стануму( ІІ ); - барію; - цинку; - плюмбуму( ІІ ); - купруму(ІІ).
Домашнє завдання. Параграф 11, стор. 67-69, 71. Повторити формули кислот, вивчити конспект. Підготуватись до хімічного диктанту такого плану: дати назви наступним речовинам –HCl, Zn(OH)2, Fe(OH)2,HPO3,KOH, HNO3,Ba(OH)2,HNO2, Ca(OH)2, HI.
Схожі презентації
Категорії