Презентація на тему:
Швидкість хімічної реакції, залежність швидкості реакції від різних чинників
Завантажити презентацію
Швидкість хімічної реакції, залежність швидкості реакції від різних чинників
Завантажити презентаціюПрезентація по слайдам:
Згадай Що таке хімічна реакція? Що відбувається з молекулами при перебігу реакції? Які ознаки хімічної реакції? Які типи реакції ви знаєте? Які реакції бувають за температурним ефектом? Що таке каталізатор?
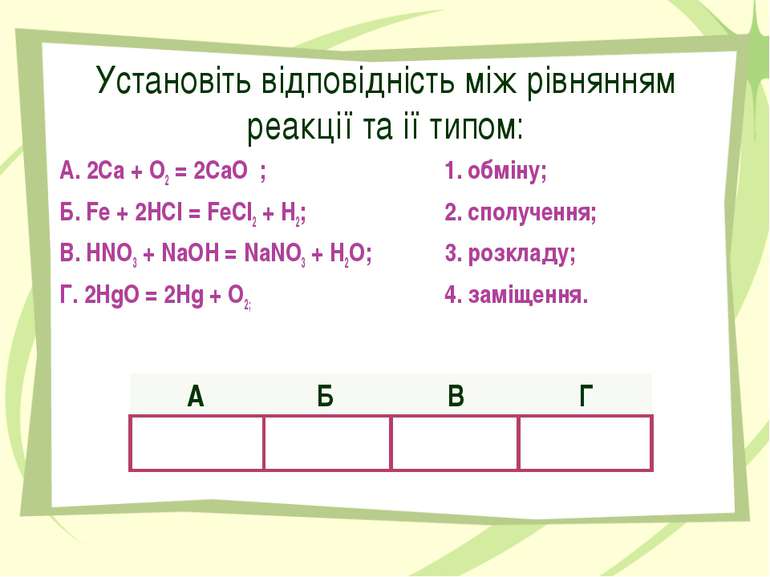
Установіть відповідність між рівнянням реакції та ії типом: А. 2Са + О2 = 2СаО ; 1. обміну; Б. Fe + 2HСl = FeCl2 + H2; 2. сполучення; В. HNO3 + NaOH = NaNO3 + H2O; 3. розкладу; Г. 2HgO = 2Hg + O2; 4. заміщення. А Б В Г 2 4 1 3
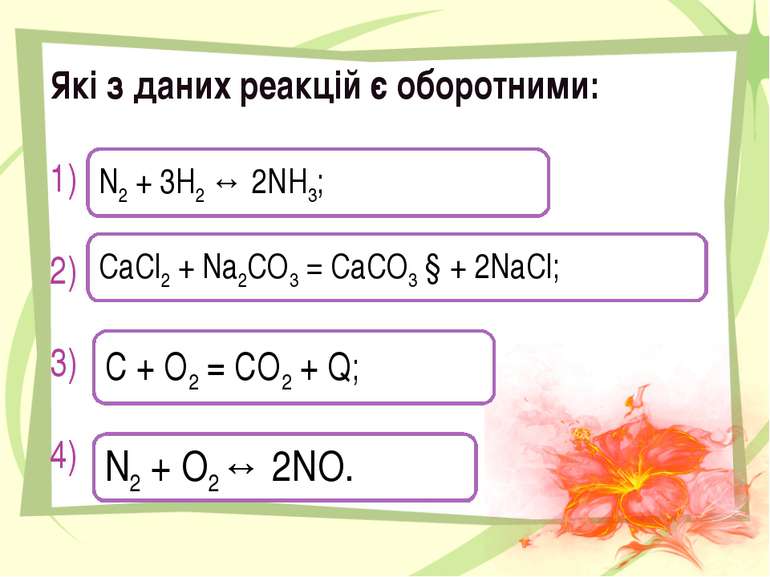
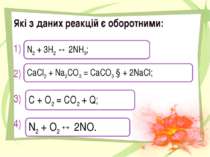
Які з даних реакцій є оборотними: 1) 2) 3) 4) N2 + 3H2 ↔ 2NH3; CaCl2 + Na2CO3 = CaCO3 ↓+ 2NaCl; С + О2 = СО2 + Q; N2 + O2↔ 2NO.
«Є ТІЛЬКИ ДВІ ФОРМИ ЖИТТЯ: ГНИТТЯ І ГОРІННЯ. БОЯГУЗИ ТА ЖАДІБНІ ОБЕРУТЬ ПЕРШУ, МУЖНІ ТА ЩЕДРІ – ДРУГУ» Гниття і горіння – процес окиснення, що відбувається з різною швидкістю і якістю
Швидкість – це величина, яка чисельно дорівнює шляху, який проходить тіло за одиницю часу З фізики
Вибух газу Ржавіння заліза Утворення мінералів у природі Бродіння виноградного соку Згоряння бензину в двигуні Скисання молока Розташуйте явища за зростанням швидкості хімічних реакцій
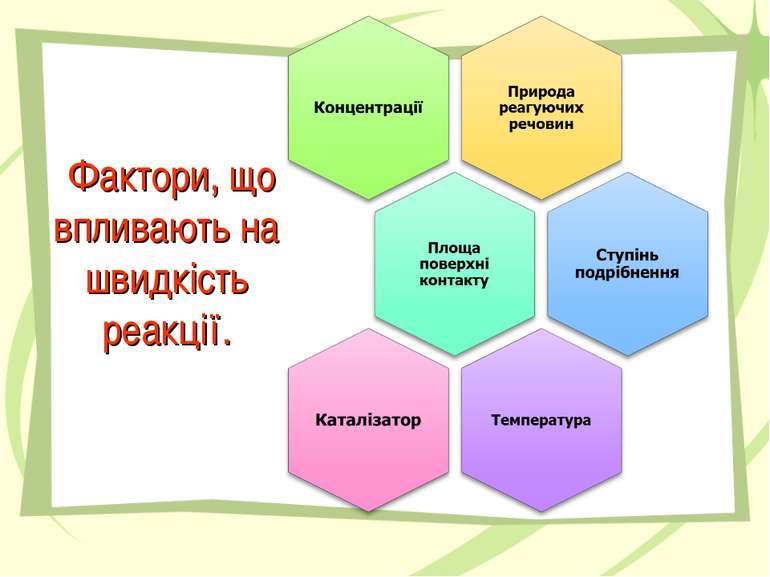
Концентрація Величина, що показує вміст кількості речовини в одиниці об’єму називається концентрацією. де c – концентрація , n – кількість речовини [моль], V – об’єм [л]. швидкість реакції - це зміна концентрації одного з реагентів чи одного з продуктів реакції за одиницю часу при незмінному об’ємі системи. де v – швидкість хімічної реакції , c1 та c2 – початкова та кінцева концентрація (відповідно) , t1 та t2 – початковий та кінцевий час (відповідно) – ∆ C зміна концентрації , ∆ t – проміжок часу [с]. Швидкість реакції
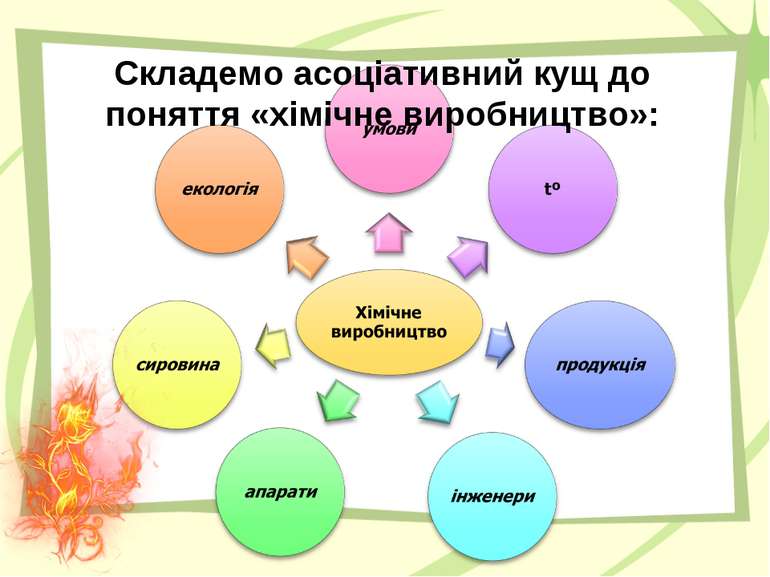
Швидкість хімічної реакції визначається зміною концентрації речовин за одиницю часу. В хімії
Вчені, що зробили внесок в розвиток хімічної кінетики Якоб Вант – Гофф голландський вчений, перший лауреат Нобелівської премії з хімії (1901 р) Сванте Арреніус (лауреат Нобелівської премії за відкриття в області розчинів, відкрив залежність миттєвої швидкості реакції від температури) М.М.Семенов - лауреат Нобелівської премії з хімії "за дослідження в області механізму хімічних реакцій", 1956
Лабораторний дослід Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічної реакції. Група №1. Завдання . Дослідіть вплив природи реагуючих реагентів на швидкість хімічної реакції. Група №2. Завдання. Дослідіть вплив концентрації речовини на швидкість хімічної реакції. Група №3. Завдання . Дослідіть вплив площі поверхні контакту реагентів на швидкість хімічної реакції. Група №4. Завдання. Дослідіть вплив температури на швидкість хімічної реакції. Група №5 Завдання. Дослідіть розкладання гідроген пероксиду в присутності каталізатора.
Закон діючих мас 1867 рік Норвезькі дослідники Гульдберг Като Максиміліан Петер Вааге Математична залежність швидкості від концентрації для реакції : А + Б = АБ має вигляд: v = k[А][Б] Де V –швидкість реакции; K – константа швидкості; [А] и [Б] – концентрації речовин А и Б відповідно Швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин, взятих у ступенях рівних їх коефіцієнтам в рівнянні реакції. Цей закон ще називають законом діючих мас. 1865 рік - російський вчений Н.І. Бекетов
Задача Складіть кінетичне рівняння для наступних речовин H2+I2=2HI 2. Як зміниться швидкість для наступного кінетичного рівняння v= kC2CB, якщо концентрацію речовини А збільшити у 3 рази; У розв'язок підставимо данні кінетичного рівняння, та порівняємо швидкість. Швидкість реакції збільшиться у 9 разів На домашнє опрацювання У скільки разів збільшиться швидкість реакції, якщо збільшити концентрації речовин в 2 рази? Рівняння реакції: N2+ 3H2= 2NH3
В гетерогенних системах реакція відбувається на поверхні, а не в об’ємі речовини. Тому для характеристики швидкості реакції використовують відношення кількості речовини до площі поверхні.
Правило Вант - Гоффа При збільшенні температури на кожні 100 швидкість реакции зростає у 2-4 рази. Величина, що показує, у скільки разів збільшиться швидкість реакції, називається температурним коефіцієнтом, або коефіцієнтом Вант-Гоффа(Υ) Математичний вираз правила Вант- Гоффа
Задача 1.Визначита ,як зміниться швидкість реакції, якщо збільшити температуру з 10° до 50° С; Швидкість реакції збільшується у 81 раз. 2.У скільки разів збільшиться швидкість реакції при підвищенні температури з 50°С до 80°С, якщо γ =2? Швидкість реакції збільшиться у 8 разів 50º - 60º - 70º - 80º у 2 р. у 2 р. у 2 р = 23 = 8
Аналізуючи причини різної швидкості хімічних реакцій, учень дійшов таких висновків: швидкість хімічної реакції зростає з підвищенням температури; швидкість хімічних реакцій прямо пропорційна концентрації реагуючих речовин; з часом швидкість реакції зростає; швидкість реакції можна змінити застосовуючи каталізатор. В якому пункті учень помилився?
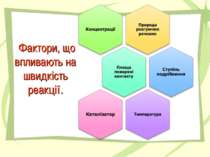
Хімічна реакція Чинники, що впливають на швидкість реакції 1. Якщо збільшити вміст кисню в повітрі, яке вдихає людина,- температура тіла людини зросте. А. Збільшення поверхні зіткнення реагуючих речовин прискорює хімічну реакцію . 2. Улітку зростає небезпека харчових отруєнь. Б. Каталізатори прискорюють хімічні реакції 3. Золота монета , на відміну від мідної, в грунті не руйнується. В. Зі збільшенням концентрації реагентів швидкість реакції зростає 4. Пероксид водню, залитий у рану, піниться. Г. Швидкість хімічної реакції залежить від природи реагентів Д. Зі зростанням температури швидкість реакції збільшується. 1 2 3 4 2 4 1 3
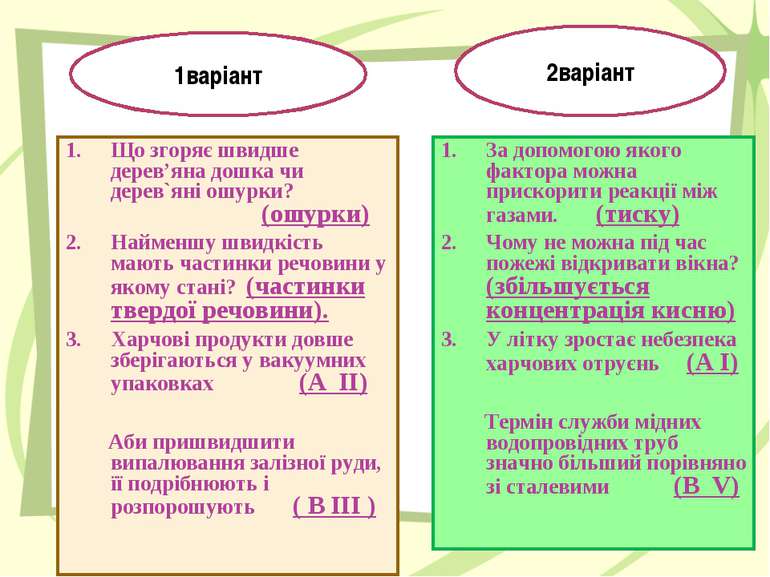
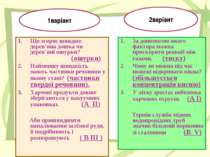
Самостійна робота 1 варіант Що згоряє швидше дерев’яна дошка чи дерев`яні ошурки? (2 бали) Найменшу швидкість мають частинки речовини у якому стані? (2 бали) Для кожної позиції лівої колонки знайдіть усі правильні відповіді з правого стовпчика: (по 3 бали) А. Харчові продукти довше зберігаються у вакуумних упаковках Б. Аби пришвидшити випалювання залізної руди, її подрібнюють і розпорошують Зі зростанням температури швидкість реакції збільшується Зі зменшенням концентрації реагентів швидкість реакції зменшується Зі зростанням площі поверхні контакту реагентів швидкість реакції збільшується Каталізатори пришвидшують хімічні реакції Швидкість хімічної реакції залежить від природи реагентів Відповідь: А.__________________ В.__________________ 2 варіант За допомогою якого фактора можна прискорити реакції між газами. (2 бали) Чому не можна під час пожежі відкривати вікна? (2 бали) Для кожної позиції лівої колонки знайдіть усі правильні відповіді з правого стовпчика: (по 3 бали) А. У літку зростає небезпека харчових отруєнь Б.Термін служби мідних водопровідних труб значно більший порівняно зі сталевими Зі зростанням температури швидкість реакції збільшується Зі зменшенням концентрації реагентів швидкість реакції зменшується Зі зростанням площі поверхні контакту реагентів швидкість реакції збільшується Каталізатори пришвидшують хімічні реакції Швидкість хімічної реакції залежить від природи реагентів Відповідь: А.__________________ В.__________________
Що згоряє швидше дерев’яна дошка чи дерев`яні ошурки? (ошурки) Найменшу швидкість мають частинки речовини у якому стані? (частинки твердої речовини). Харчові продукти довше зберігаються у вакуумних упаковках (А ІІ) Аби пришвидшити випалювання залізної руди, її подрібнюють і розпорошують ( В ІІІ ) За допомогою якого фактора можна прискорити реакції між газами. (тиску) Чому не можна під час пожежі відкривати вікна? (збільшується концентрація кисню) У літку зростає небезпека харчових отруєнь (А І) Термін служби мідних водопровідних труб значно більший порівняно зі сталевими (B V) 1варіант 2варіант
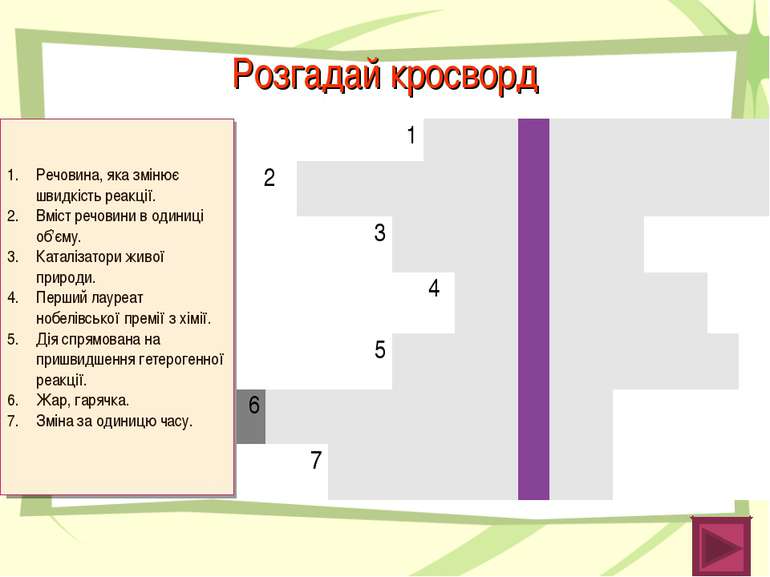
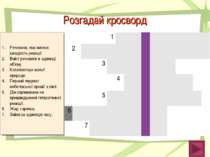
Розгадай кросворд Речовина, яка змінює швидкість реакції. Вміст речовини в одиниці об’єму. Каталізатори живої природи. Перший лауреат нобелівської премії з хімії. Дія спрямована на пришвидшення гетерогенної реакції. Жар, гарячка. Зміна за одиницю часу. 1 К А Т А Л І З А Т О Р 2 К О Н Ц Е Н Т Р А Ц І Я 3 Ф Е Р М Е Н Т И 4 В А Н Т Г О Ф Ф 5 П О Д Р І Б Н Е Н Н Я 6 Т Е М П Е Р А Т У Р А 7 Ш В И Д К І С Т Ь 1 2 3 4 5 6 7
Схожі презентації
Категорії