Презентація на тему:
Осаджувальне титрування
Завантажити презентацію
Осаджувальне титрування
Завантажити презентаціюПрезентація по слайдам:
План Суть та класифікація методів осаджувального титрування Криві титрування та їх аналіз Аргентометрія Тіоціанатометрія Меркурометрія Сульфатометрія Гексаціанофератометрія
Методи осаджувального титрування – це методи титриметричного аналізу, в яких застосовуються титранти, що утворюють осади з визначуваними речовинами.
Вимоги до реакцій і визначуваних речовин: Визначувана речовина повинна бути добре розчинна у воді і повинна утворювати іон, який би був активним у реакції осадження. Отримуваний у реакції осад повинен бути практично нерозчинним (ДР
Класифікація методів осаджувального титрування за використовуваним титрантом: аргентометрія меркурометрія тіоціанатометрія сульфатометрія хроматометрія гексаціанофератометрія
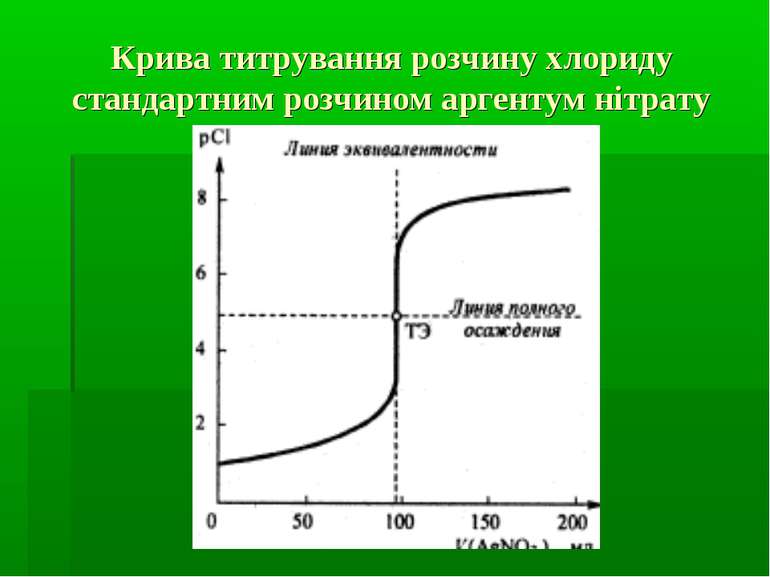
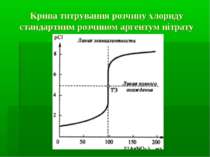
Криві титрування та їх аналіз Побудова кривих титрування здійснюється на основі розрахунків згідно правила добутку розчинності. і відповідно
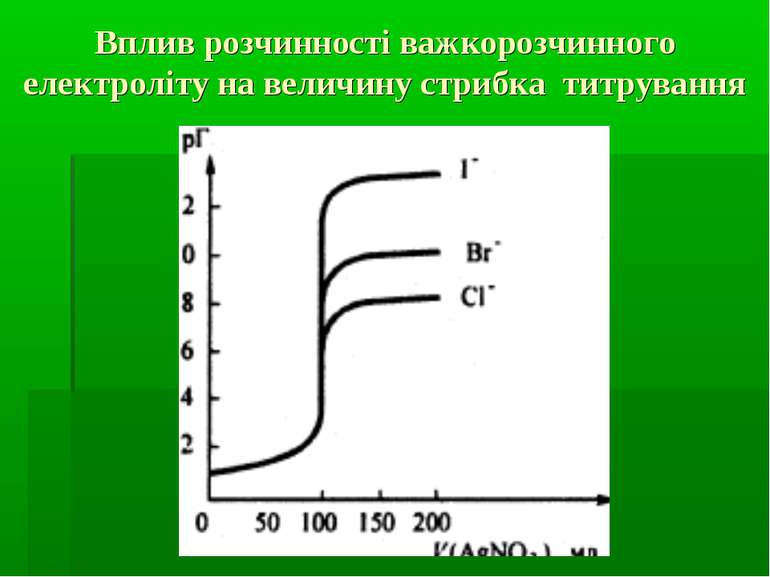
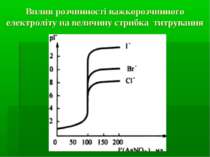
Фактори, які впливають на величину стрибка титрування на кривих осаджувального титрування концентрація розчинів титранту і визначуваного іона (чим вищі концентрації, тим більший стрибок титрування). розчинність осаду, який утворюється в процесі титрування (чим менша розчинність, тим більший стрибок титрування).
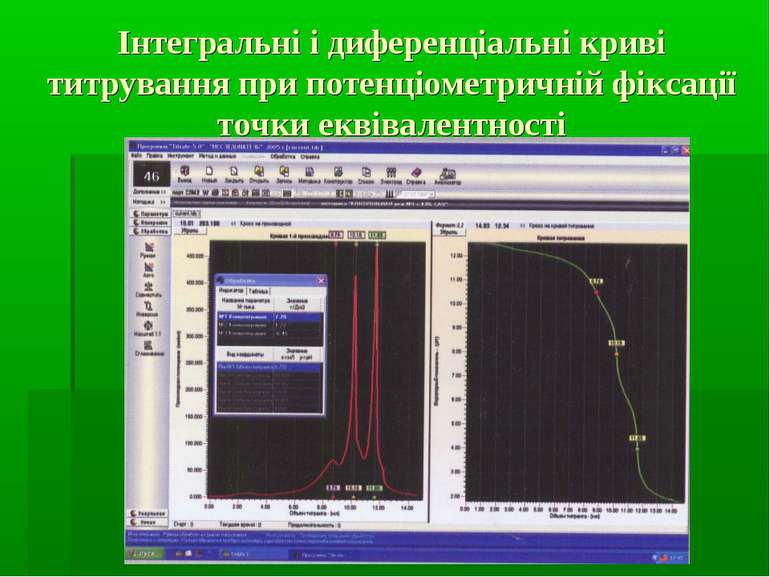
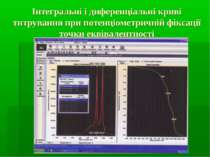
Інтегральні і диференціальні криві титрування при потенціометричній фіксації точки еквівалентності
Фактори, які впливають на величину стрибка титрування на кривих осаджувального титрування Температура (чим вища температура, тим більша розчинність осаду і тим менший стрибок титрування). Іонна сила розчину (вплив відносно незначний, тому що іонна сила розчину, порівняно з іншими факторами, не так сильно змінює розчинність осаду; проте, чим вища іонна сила розчину, тим вища розчинність і менший стрибок титрування).
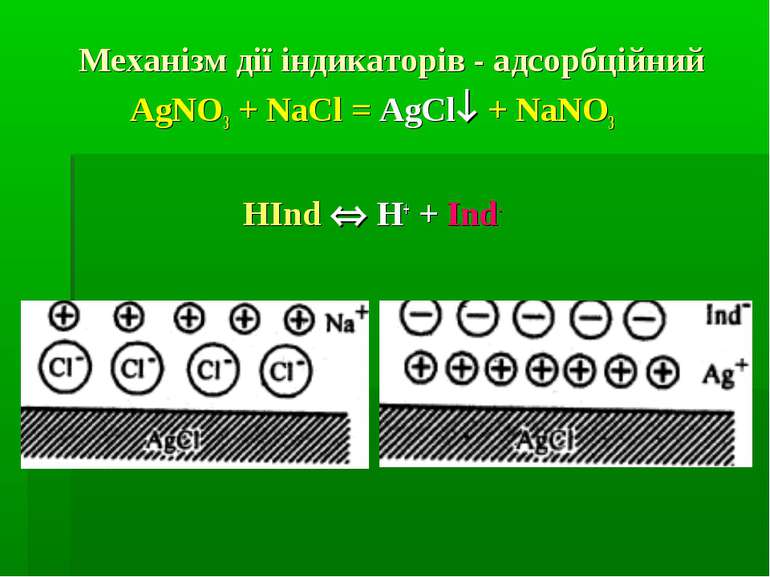
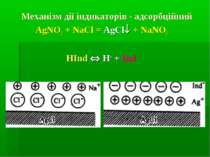
Аргентометрія - X- + Ag+ = AgX де X- = Cl-, Br-, I-, CN-, SCN- та ін. Титрант: AgNO3 – втор. станд. розчин. Стандартизація за перв. станд. роз. натрій хлориду AgNO3 + NaCl = AgCl + NaNO3 Індикатором при стандартизації є 5 % калій хромат K2CrO4 (до появи коричнево-червоного осаду аргентум хромату): 2AgNO3 + K2CrO4 = Ag2CrO4 + 2KNO3.
В залежності від способу проведення титрування і використовуваного індикатора методи аргентометрії поділяють на: безіндикаторні: - метод Гей-Люсака (метод рівного помутніння) - метод до точки просвітлення індикаторні: - метод Мора - метод Фаянса – Фішера - Ходакова - метод Фольгарда
Метод Мора Титрант: AgNO3 – втор. станд. розчин. Стандартизація за перв. станд. розч. натрій хлориду NaCl методом піпетування: AgNO3 + NaCl = AgCl + NaNO3 Індикатором є 5 % калій хромат K2CrO4 (до появи коричнево-червоного аргентум хромату): 2AgNO3 + K2CrO4 = Ag2CrO4 + 2KNO3 Визначувані речовини: хлориди Cl-, броміди Br-. Середовище: рН~ 6,5-10,3. Застосування: кількісне визначення натрій хлориду, калій хлориду, натрій броміду, калій броміду та ін.
Обмеження застосування методу Мора: Не можна титрувати кислі розчини: 2CrO42- + 2H+ = Cr2O72- + H2O Не можна титрувати в присутності аміаку та інших іонів, молекул, які можуть виступати лігандами по відношенню до іонів арґентуму в реакціях комплексоутворення. Не можна титрувати в присутності багатьох катіонів (Ba2+, Pb2+, та ін.), які утворюють забарвлені осади з хромат - іонами CrO42-. Не можна титрувати в присутності відновників, які перетворюють хромат - іони CrO42- в іони Cr3+. Не можна титрувати в присутності багатьох аніонів (PO43-, AsO43-, AsO33-, S2- та ін.), які з іонами арґентуму утворюють забарвлені осади арґентуму.
Метод Фаянса-Фішера-Ходакова Титрант: AgNO3 – втор. станд. розчин. Стандартизація за перв. станд. розч. натрій хлориду NaCl методом піпетування Середовище: рН~ 6,5-10,3 при визначенні хлоридів і рН~ 2,0-10,3 при визначенні бромідів і йодидів. Індикатори методу: - флуоресцеїн при визначенні хлоридів - еозин при визначенні бромідів і йодидів
Метод Фаянса-Фішера-Ходакова Забарвлення Індикатор розчин на поверхні осаду Флуоресцеїн зелено-жовте рожеве Еозин жовтувато-червоне червоно-фіолетове Ряд адсорбційної здатності аніонів при рН~7 на поверхні осаду аргентум хлориду I- > CN- > SCN- > Br- > еозин > Сl- > флуоресцеїн > NO3- > ClO4-
Метод Фаянса-Фішера-Ходакова Умови проведення титрування: кислотність розчинів концентрація реагуючих розчинів врахування адсорбційної здатності індикаторів та присутніх у розчині іонів. титрування поблизу т.е. слід проводити повільно титрування з адсорбційними індикаторами проводять в розсіяному світлі Застосування: кількісне визначення хлоридів, бромідів, йодидів, тіоціанатів, ціанідів.
Метод Фольгарда Титранти: AgNO3, амоній або калій тіоціанат NH4SCN, KSCN - втор. станд. розчини. Стандартизація AgNO3 за перв. станд. розчином NaCl методом піпетування Стандартизація NH4SCN, KSCN за стандартним розчином AgNO3: AgNO3 + NH4SCN = AgSCN + NH4NO3 Індикатором при стандартизації амоній чи калій тіоціанату є солі феруму (ІІІ) (наприклад, NH4Fe(SO4)2 12H2O в присутності нітратної кислоти) до появи слабкого рожевого забарвлення : Fe3+ + SCN- = [Fe(SCN)]2+ Середовище: нітратнокисле. Індикатори методу: солі феруму (ІІІ) NH4Fe(SO4)2 12H2O в присутності нітратної кислоти. Визначувані речовини: галогеніди, ціаніди, тіоціанати, сульфіди, карбонати, хромати, оксалати, арсенати та ін.
До т.е. Hal- + Ag+ (надлишок) = AgHal Ag+(залишок) + SCN- = AgSCN Після т. е. Fe3+ + SCN- = [Fe(SCN)]2+ (рожево-червоний) !!! При визначенні йодидів індикатор додають наприкінці титрування, щоб уникнути паралельної реакції: 2Fe3+ + 2I- = 2Fe2+ + I2 Перевага методу Фольгарда можливість титрування: - в дуже кислих розчинах - в присутності багатьох катіонів, які заважали при визначенні по методу Мора
Тіоціанатометрія Титрант: амоній або калій тіоціанат NH4SCN, KSCN - втор. станд. розчини. Стандартизація: за стандартним розчином AgNO3: AgNO3 + NH4SCN = AgSCN + NH4NO3 Індикатором при стандартизації амоній чи калій тіоціанату є солі феруму (ІІІ): Fe3+ + SCN- = [Fe(SCN)]2+ Середовище: нітратнокисле. Індикатор методу: солі феруму (ІІІ) NH4Fe(SO4)2 12H2O в присутності нітратної кислоти.
Тіоціанатометрія Визначувані речовини: лікарські засоби, які містять срібло (протаргол, коларгол, срібла нітрат). !!! При аналізі препаратів, які містять неіонне срібло, попередньо переводять срібло в іонний стан, обробляючи препарат сульфатною, нітратною кислотами при нагріванні. !!! При визначенні йодидів індикатор додають наприкінці титрування, щоб уникнути паралельної реакції: 2Fe3+ + 2I- = 2Fe2+ + I2 Переваги тіоціанатометрії можливість титрування: - в дуже кислих розчинах - в присутності багатьох катіонів, які заважали при визначенні по методу Мора
Меркурометрія Меркурометрія – 2Cl- + Hg22+ = Hg2Cl2 ДР = 1,3 10-18 2I- + Hg22+ = Hg2I2 ДР = 4,5 10-29 Титрант: втор. станд. розчин Hg2(NO3)2 Стандартизація: за стандартним розчином NaCl: Hg2(NO3)2 + 2NaCl = Hg2Cl2 + 2NaNO3
Меркурометрія Індикатори: 1) розчин ферум (ІІІ) тіоціанату (від червоного до знебарвлення) 2Fe(SCN)2+ + Hg22+ = Hg2(SCN)2 + 2Fe3+ !!! Для врахування об’єму титранта, який витрачено на титрування індикатора титрують “сліпу пробу” 2) 1-2 % спиртовий розчин дифенілкарбазону (до появи синього забарвлення). !!! Індикатор додають перед закінченням титрування Визначувані речовини: хлориди і йодиди. Середовище: дуже кисле (може бути до 5 моль/л іонів H+).
Переваги меркурометрії порівняно з аргентометрією: можливість титрування в дуже кислих розчинах титрант дешевший солі меркурію (І) є менш розчинні, тому точність і чутливість титрування вищі, а стрибок титрування на кривій є значно більшим можливість проведення титрувань з індикатором дифенілкарбазоном в каламутних і забарвлених розчинах можливе реверсивне титрування солей меркурію (І) Недолік: солі меркурію (І) – дуже токсичні.
Сульфатометрія Сульфатометрія – Інколи виділяють бариметрію – В основі методу: Ba2+ + SO42- = BaSO4↓ визн. реч. титрант Титранти: втор. станд. розч. H2SO4, Ba(NO3)2, BaCl2. Стандартизація: розчин H2SO4 по Na2B4O7 чи Na2CO3 з метиловим оранжевим; Ba(NO3)2 і BaCl2 по H2SO4 з нітрхромазо чи ортаніловим А.
Сульфатометрія Індикатори: застосовують металохромні індикатори нітрхромазо (ортаніловий С), ортаніловий А. BaInd + H2SO4 = BaSO4 + H2Ind фіолетовий білий осад рожевий розчин Визначувані речовини: пряме титрування: - сульфатною кислотою - вміст барію - барій хлоридом чи барій нітратом - вміст сульфатів. !!! Для покращення осадження іонів барію застосовують як розчинник 50 % етанол. !!! Інколи, як індикатор застосовують натрій родизонат
Гексаціанофератометрія Титрант: вторинний стандартний розчин K4[Fe(CN)6] Стандартизація: за станд. розч. KMnO4 в сульфатнокислому середовищі 5K4[Fe(CN)6] + KMnO4 + H2SO4 = 5K3[Fe(CN)6] + MnSO4 + 3K2SO4 + 4H2O Індикатор при стандартизації є метиловий фіолетовий (зміна забарвлення від жовто-зеленого до червоно-коричневого.
Гексаціанофератометрія Індикатори: - дифеніламін в присутності невеликої кількості калій гексаціаноферату (ІІІ) при визначенні Zn2+, Mn2+ - 3,3-диметилнафтизин при визначенні Cu2+, Zn2+, Cd2+, Pb2+, Fe2+, Ni2+ та ін. - алізариновий червоний S при визначенні Zn2+, Pb2+, Th(IV) - дифенілкарбазон при визначенні Cd2+ Визначувані речовини: катіони металів, а непрямим титруванням фосфат-іони.
Схожі презентації
Категорії


























![Гексаціанофератометрія Титрант: вторинний стандартний розчин K4[Fe(CN)6] Стан... Гексаціанофератометрія Титрант: вторинний стандартний розчин K4[Fe(CN)6] Стан...](https://svitppt.com.ua/images/23/22533/770/img29.jpg)



























![Гексаціанофератометрія Титрант: вторинний стандартний розчин K4[Fe(CN)6] Стан... Гексаціанофератометрія Титрант: вторинний стандартний розчин K4[Fe(CN)6] Стан...](https://svitppt.com.ua/images/23/22533/210/img29.jpg)