Презентація на тему:
Пневмонії
Завантажити презентацію
Пневмонії
Завантажити презентаціюПрезентація по слайдам:
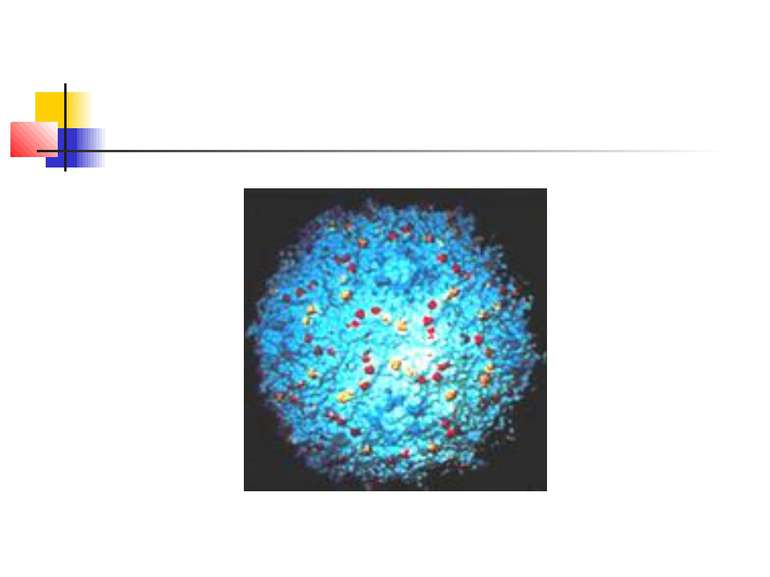
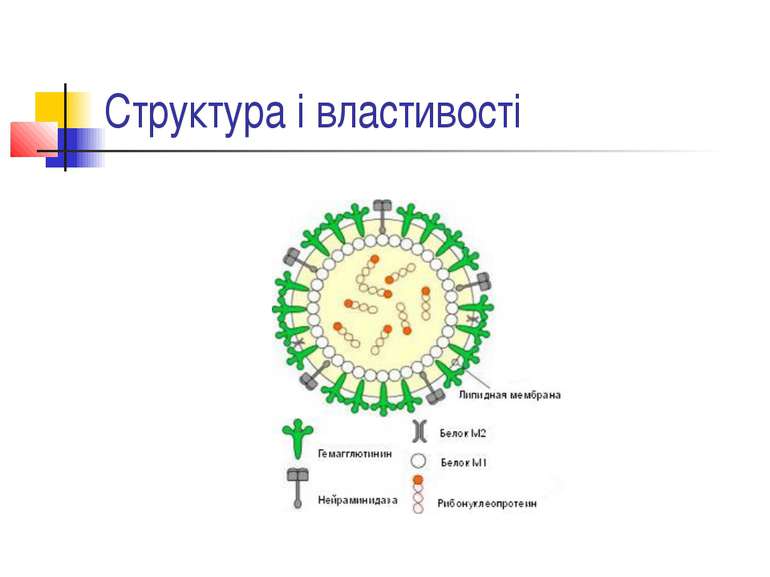
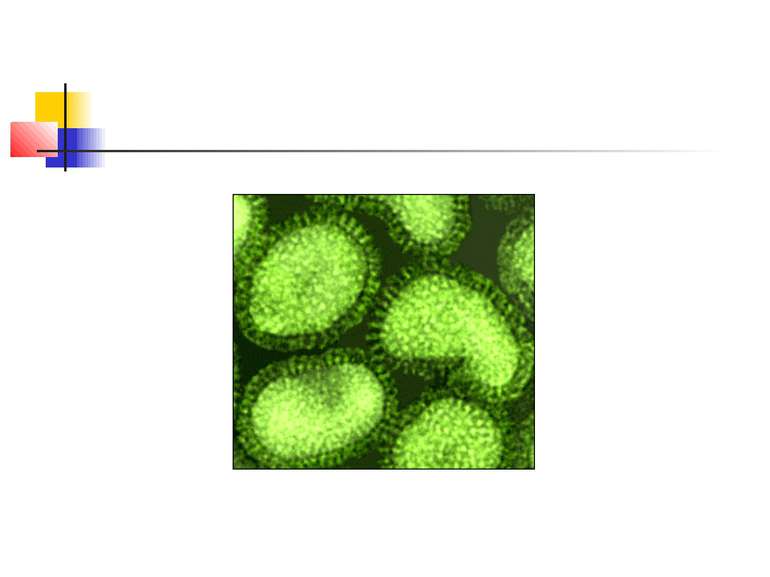
ПНЕВМОНІЯ - це гостре інфекційне захворювання, переважно бактеріальної етіології, яке характеризується вогнищевим ураженням респіраторних відділів легень та наявністю внутрішньоальвеолярної ексудації КЛАСИФІКАЦІЯ ПНЕВМОНІЇ (наказ МОЗ України від 28.10.2003 р. № 499) негоспітальна (позалікарняна, розповсюджена, амбулаторна) – пневмонія, що виникла поза лікувальним закладом; госпітальна, або нозокоміальна – пневмонія, що виникла через 48 годин і пізніше після госпіталізації хворого до стаціонару за відсутності будь-якого інфекційного захворювання в інкубаційний період на час госпіталізації; аспіраційна пневмонія; пневмонія в осіб з тяжкими порушеннями імунітету (вроджений імунодефіцит, ВІЛ-інфекція, ятрогенна імуносупресія).
ПНЕВМОНІЯ - це гостре інфекційне захворювання, переважно бактеріальної етіології, яке характеризується вогнищевим ураженням респіраторних відділів легень та наявністю внутрішньоальвеолярної ексудації Аспіраційна та пневмонії в осіб з тяжкими порушеннями імунітету можуть бути як негоспітальними, так і госпітальними.
ПНЕВМОНІЯ - це гостре інфекційне захворювання, переважно бактеріальної етіології, яке характеризується вогнищевим ураженням респіраторних відділів легень та наявністю внутрішньоальвеолярної ексудації аспірація вмісту ротоглотки; вдихання аерозолю, що містить мікроорганізми; гематогенне поширення мікроорганізмів з позалегеневого вогнища інфекції (ендокардит з ураженням тристулкового клапана, септичний тромбофлебіт вен таза); безпосереднє поширення інфекції з уражених тканин сусідніх органів (наприклад, абсцес печінки) або внаслідок інфікування під час проникних поранень грудної клітки. ЕТІОПАТОГЕНЕЗ ПНЕВМОНІЇ Виділяють 4 шляхи інфікування, які з різною частотою зумовлюють розвиток пневмонії:
НЕГОСПІТАЛЬНА ПНЕВМОНІЯ Гостре захворювання, що виникло в позалікарняних умовах і супроводжується симптомами інфекції нижніх дихальних шляхів (лихоманкою, кашлем, виділенням харкотиння, болем у грудях і задишкою) та рентгенологічними ознаками вогнищево-інфільтративних змін у легенях за умови відсутності очевидної діагностичної альтернативи (О.Я.Дзюблик, 2006).
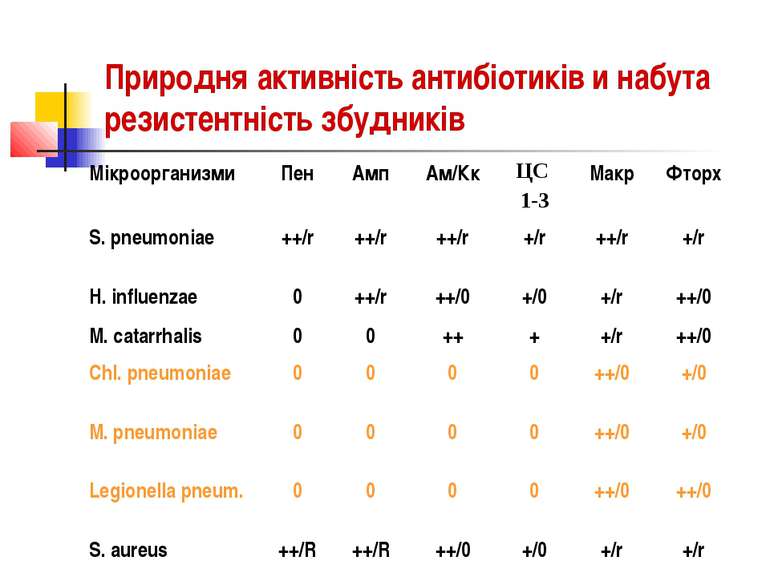
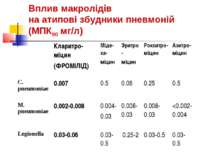
ОСНОВНІ ЗБУДНИКИ НЕГОСПІТАЛЬНИХ ПНЕВМОНІЙ : Streptococcus pneumoniae, Heamophilus influenzae, Moraxella catarrhalis, Mycoplasma pneumoniae, Chlamidia pneumoniae, Legionella pneumophila.
АТИПОВІ ЗБУДНИКИ НЕГОСПІТАЛЬНИХ ПНЕВМОНІЙ Mycoplasma pneumoniae, Chlamidia pneumoniae, Legionella pneumophila відносяться до внутрішньоклітинних патогенів, здатних до реплікації всередині клітин хазяїна.
АТИПОВІ ЗБУДНИКИ НЕГОСПІТАЛЬНИХ ПНЕВМОНІЙ Атипові збудники проникають через неушкоджені епітеліальні бар’єри організму при інфікуванні слизових оболонок; швидко розповсюджуються по організму людини за рахунок реплікації всередині клітин імунної системи, що циркулюють в крові (макрофаги); блокують механізми протиінфекційного імунітету. Не чутливі до -лактамів. Чутливі до макролідів, фторхінолонів та тетрациклінів.
АНТИБІОТИКОРЕЗИСТЕНТНІСТЬ ОСНОВНИХ ЗБУДНИКІВ НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Streptococcus pneumoniae Основний механізм резистентності Streptococcus pneumoniae до пеніциліну пов’язаний з появою мутантної ДНК у генах, що кодують пеніцилінзв’язувальні білки.
АНТИБІОТИКОРЕЗИСТЕНТНІСТЬ Основний механізм резистентності Heamophilus influenzae до -лактамних антибіотиків полягає в продукуванні -лактамаз, які гідролізують амінопеніциліни та цефалоспарини І покоління.
АНТИБІОТИКОРЕЗИСТЕНТНІСТЬ 90-100% штамів Moraxella catarrhalis продукують -лактамази, які зумовлюють гідроліз природних і незахищених напівсинтетичних пеніцилінів. Резистентність до макролідів виявляють вкрай рідко.
ДІАГНОСТИКА НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Діагностика негоспітальної пневмонії грунтується на виявленні загальних (слабкість, адинамія, зниження апетиту, лихоманка) та локальних респіраторних (кашель, виділення харкотиння, задишка, біль в грудях) симптомів, а також фізикальних даних (притуплений або тупий перкуторний звук, ослаблене або жорстке бронхіальне дихання, фокус дзвінких дрібнопухирцевих хрипів та/або крепітації).
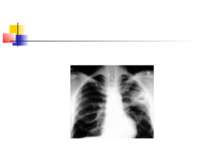
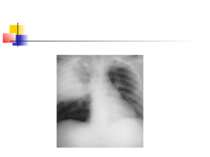
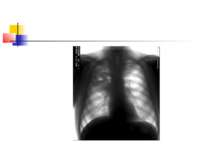
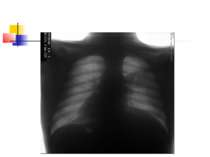
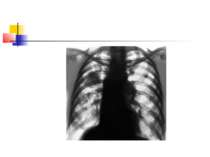
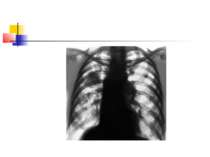
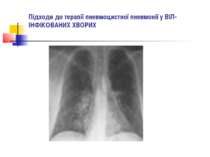
ДІАГНОСТИКА НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Рентгенографія органів грудної клітки повинна проводитись в двох проекціях (передньозадній та боковій). Діагностика пневмонії передбачає виявлення вогнищево-інфільтративних змін в легенях у поєднанні з відповідною сиптоматикою інфекції нижніх дихальних шляхів.
ДІАГНОСТИКА НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Додаткове рентгенологічне дослідження (рентгенотомографію, комп’ютерну томографію) доцільно проводити для диференціальної діагностики в разі ураження верхніх часток легень, лімфатичних вузлів, середостіння, при зменшенні об’єму частки легені, при абсцедуванні, а також при неефективності попередньої антибактеріальної терапії.
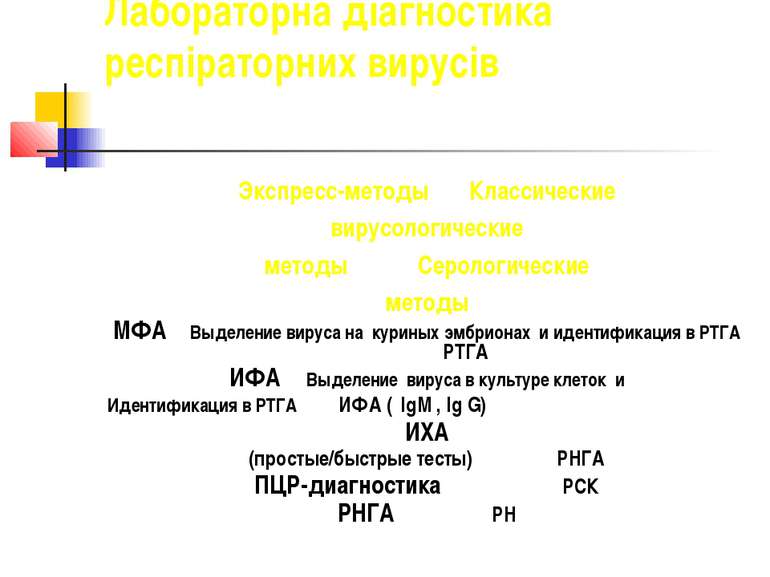
ДІАГНОСТИКА НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Мікробіологічне дослідження при пневмонії спрямоване на виявлення збудника захворювання в матеріалі, отриманого з вогнища інфекції. Матеріал для дослідженя необхідно збирати до початку антибактеріальної терапії. Стандартними методами дослідження є бактеріоскопія пофарбованих за Грамом мазків мокротиння та засів мокротиння, яке отримане при глибокому відкашлюванні.
ДІАГНОСТИКА НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Діагностична цінність результатів мікробіологічного дослідження мокротиння оцінюють як високу, якщо кількість виявленого в ньому потенційного збудника становить 10. 6 КУО/мл. У пацієнтів з важким перебігом негоспітальної пневмонії обов’язковим є проведення мікробіологічного дослідження крові (необхідно взяти 2 зразки венозної крові з різних вен з інтервалом 10 хв і більше).
Інвазивні методи діагностики: фібробронхоскопія з міні-БАЛ або “захищеною” браш-біопсією слизової оболонки бронхів, транстрахіальну аспірацію, трансторакальну біопсію використовують у разі важкого перебігу захворювання, за підозри на туберкульоз легень, за наявності “обструктивної пневмонії” на тлі бронхогенної карциноми, при аспірації чужерідного тіла.
Інвазивні методи діагностики: Результати дослідження визнають діагностично значущими, якщо в матеріалі, отриманому під час БАЛ, концентрація потенційного збудника складає 10 .4 КУО/мл, а отриманого за допомогою “захищених” щіток – 10 .3 КУО/мл.
Інвазивні методи діагностики: Дані клінічного аналізу крові не дозволяють визначити потенційного збудника пневмонії, однак лійкоцитоз вище 10-12.109/л свідчить про високу ймовірність бактеріальної інфекції, а лейкопенія ниже 3.109/л або лейкоцитоз вище 25.109/л є несприятливими прогностичними ознаками. Гази артеріальної крові. Гіпоксемія (SaO2 менше 90% або PaO2 нижче 60 мм рт.ст. при диханні кімнатним повітрям) є прогностично несприятливою ознакою.
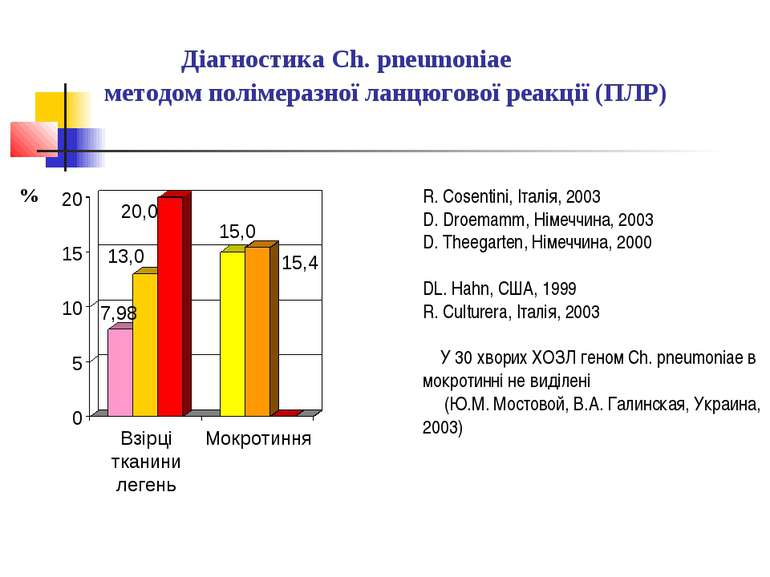
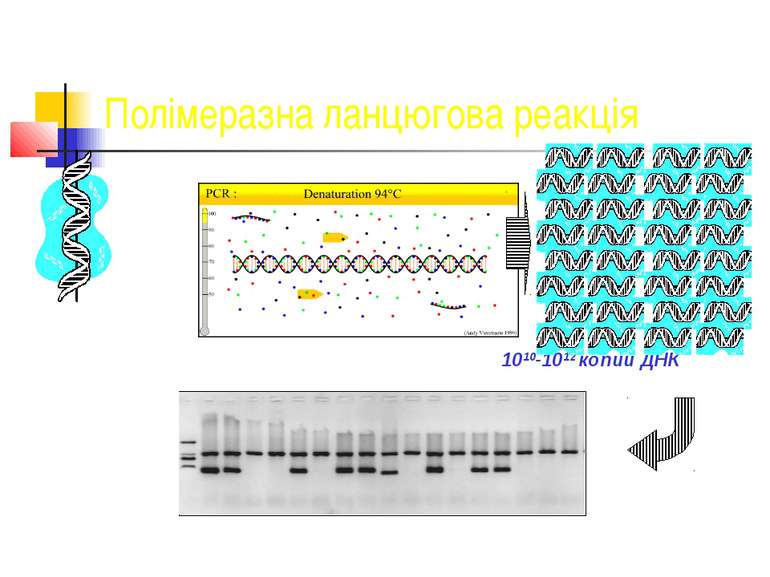
Серологічна діагностика негоспітальної пневмонії Серологічна діагностика негоспітальної пневмонії, що спричинена Mycoplasma pneumoniae, Chlamydia pneumoniae і бактеріями роду Legionella, не розглядається як обов’язковий метод дослідження і має переважно епідеміологічний рівень діагностики. Пропонують використовувати імуноферментний тест з визначенням в сечі специфічного розчинного антигену та полімеразну ланцюгову реакцію (ПЛР).
Дослідження плеврального випоту Дослідження плеврального випоту проводиться із визначенням кількості лейкоцитів та лейкоцитарної формули, рН, активності лактатдегідрогенази, кількості білка, фарбованого за Грамом та на кислотостійкі бактерії, посівом на виявлення аеробів, анаеробів та мікобактерій
ОСОБЛИВОСТІ ПЕРЕБІГУ АТИПОВИХ ПНЕВМОНІЙ Пневмонії, що викликані легіонелами Відомо 30 видів легіонел, 19 із яких викликають пневмонію у людини. Найбільш часто – це Legionella pneumophila. Легіонели являються Г(-) бактеріями, що не входять до складу фізіологічної флори людини. Вони широко розповсюджені у водному середовищі, системах кондиціювання, вентиляції, сантехніці душових та ванних приміщень, в озерах, річках.
легіонельозні пневмонії Найбільш часто легіонельозні пневмонії спостерігаються у осіб: що страждають на хронічний алкоголізм,
легіонельозні пневмонії що працюють в приміщеннях з кондиціонерами або за специфікою роботи пов’язані з водним середовищем, промисловими стоками, каналізацією, душем.
легіонельозні пневмонії Клінічні особливості легіонельзних пневмоній Інкубаційний період захворювання в середньому складає 7 діб. На 2-3 добу від початку захворювання у хворих з’являється озноб, температура тіла підвищується до 39-400 С. З 4-7 дня зявляється сухий кашель, пізніше – з виділенням слизистого харкотиння з домішками крові. Спостерігається виражена задишка. Частіше уражується права нижня частка легень. При фізикальному обстеженні визначається притуплений перкуторний звук, дрібнопухирцеві хрипи, крепітація. Часто в запальний процес залучається плевра. Плеврит, переважно фібринозний, проявляється болем в грудній клітці.
легіонельозні пневмонії При легіонельозній пневмонії можуть уражатись інші органи і системи: травна (нудота, блювота, діарея); печінка (гепатомегалія, синдром цитолізу); нирки (мікрогематурія, протеїнурія, гостра ниркова недостатність);
легіонельозні пневмонії Біохімічний аналіз крові характеризується гіпонатрійемією, збільшенням активності трансаміназ, лужної фосфатази, білірубіну, зниженням рівня альбумінів. При дослідженні периферичної крові визначається лейкоцитоз, зсув лейкоцитарної формули вліво, лімфопенія, тромбоцитопенія, різко прискорена ШОЕ. Діагноз легіонельозної пневмонії базується на визначенні легіонел в харкотинні та інших біологічних матеріалів імунофлюоресцентним методом, за допомогою ПЛР та визначенні титру антитіл до легіонел методом ІФА.
Діагностика Ch. pneumoniae методом полімеразної ланцюгової реакції (ПЛР) R. Cosentini, Італія, 2003 D. Droemamm, Німеччина, 2003 D. Theegarten, Німеччина, 2000 DL. Hahn, США, 1999 R. Culturera, Італія, 2003 У 30 хворих ХОЗЛ геном Ch. pneumoniae в мокротинні не виділені (Ю.М. Мостовой, В.А. Галинская, Украина, 2003)
Пневмонії, що викликані мікоплазмами Мікоплазми не мають клітинної стінки. За морфологічною і клітинною структурою вони нагадують L-форми бактерій, а за розмірами наближаються до вірусів. Mycoplasma pneumoniae належить до частих збудників інфекцій респіраторного тракту, особливо серед дітей і осіб молодого віку. Захворювання передається повітряно-крапельним шляхом.
Клінічні прояви мікоплазменої пневмонії (В.І.Покровський, 1995) І. Респіраторні ознаки: верхні дихальні шляхи (фарінгіт, трахеїт, бронхіт); легеневі (пневмонія, плевральний випіт, абсцес). ІІ. Нереспіраторні ознаки: гематологічні (гемолітична анемія, тромбоцитопенічна пурпура); шлунково-кишкові ( гастроентерит, гепатит, панкреатит); м’язево-скелетні (міалгія, артралгія);
Клінічні прояви мікоплазменої пневмонії (В.І.Покровський, 1995) серцево-судинні (міокардит, перикардит); дерматологічні (поліморфна ерітема); неврологічні (менінгіт, менінгоенцифаліт, периферійні неврити); генералізована інфекція (полілімфоаденопатія, септикопіємія).
Клінічні прояви мікоплазменої пневмонії (В.І.Покровський, 1995) Інкубаційний період мікоплазменної інфекції в середньому складає 3 тижні. Розвитку пневмонії передує клініка ураження верхніх дихальних шляхів. При виникненні пневмонії симптоматика наростає, температура тіла підвищується до 39-400 С. Характерною ознакою пневмонії є тривалий сильний кашель з виділенням невеликої кількості в’язкого слизистого харкотиння. Фізикальні ознаки пневмонії проявляються укороченням перкуторного звуку, ослабленим везикулярним диханням, дрібнопухирцевими хрипами, крепітацією.
Клінічні прояви мікоплазменої пневмонії (В.І.Покровський, 1995) Рентгенологічні ознаки пневмонії проявляються у вигляді інтерстиціальних змін, сегментарною та вогнищевою інфільтрацією легеневої тканини. В периферичній крові визначається нормальна кількість лейкоцитів, відсутність зсуву формули вліво, прискорена ШОЕ.
Пневмонії, що викликані хламідіями Відомо 3 види хламідій, що викликають пневмонію: Chlamydia pneumoniae викликає пневмонію, бронхіти, фарингіти, синусити, отитити. Chlamydia trachomatis – збудник урогенітальних хламідіозів, трахоми та пневмонії у новонароджених; Chlamydia psittaci – збудник орнітозу (пситакозу).
Пневмонії, що викликані хламідіями Захворювання починається із сухого, надсадного, непродуктивного кашлю. Температура тіла субфебрильна (іноді фебрильна), не супроводжується ознобами. Хворі скаржаться на головний біль, загальну слабкість, нездужання. При аскультації легень вислуховуються ослаблене везикулярне дихання, сухі розсіяні (рідше – вологі, дрібнопухирцеві) хрипи. У 10-15 % хворих захворювання перебігає важко, з вираженим синдромом інтоксикації, збільшенням печінки та селезінки.
Пневмонії, що викликані хламідіями Рентгенологічно виявляються переважно інтерстиціальні зміни, периваскулярна, перібронхіальна інфільтрація, підсилення легеневого малюнку. У загальному аналізі крові визначається лейкопенія, прискорена ШОЕ. Діагноз захворювання підтверджується ПЛР, ІФА.
ХЛАМІДІЙНІ ПНЕВМОНІЇ Паралельне визначення Ig M, Ig G, Ig A дозволяє не тільки визначати наявність хламідійної інфекції, але і уточнити фазу захворювання: в гострій фазі (5-7 доба захворювання) визначаються антитіла класу Ig M. Через тиждень зявляються Ig A, наприкінці 2-3 тижня - Ig G; прогресування захворювання, перехід гострої стадії в хронічну супроводжується високим титром Ig A тривалий термін, в той час як титр Ig M зменшується.
ХЛАМІДІЙНІ ПНЕВМОНІЇ для хронічного перебігу характерна наявність антитіл класів Ig G, Ig A, що зберігається тривалий час. Низькі титри цих антитіл свідчать про персистенцію збудника;
ХЛАМІДІЙНІ ПНЕВМОНІЇ при реінфекції або реактивації спостерігається скачкоподібний підйом титрів Ig G (бустер-ефект), низькі титри Ig G вказують на початковий етап інфікування, або на давно перенесену інфекцію («серологічні шрами»)
ХЛАМІДІЙНІ ПНЕВМОНІЇ досліджуючи титри антитіл класу Ig M, Ig G, Ig A через 1 – 1,5 місяці оцінюють ефективність лікування. Значне підвищення титру Ig A та Ig G ( > 4 рази) свідчить про прогресування інфекційного процесу або про рецидив захворювання, що вимагає використовувати антибактеріальну терапію. Носійство хламідійної інфекції характеризується невеликим рівнем Ig G і не потребує використання антибактеріальних препаратів.
ПНЕВМОНІЇ З ТЯЖКИМ ПЕРЕБІГОМ -ЦЕ ОСОБЛИВА ФОРМА ЗАХВОРЮВАННЯ РІЗНОЇ ЕТІОЛОГІЇ, ЯКА ПРОЯВЛЯЄТЬСЯ ВИРАЖЕНИМ ІНТОКСИКАЦІЙНИМ СИНДРОМОМ, ГЕМОДИНАМІЧНИМИ ЗМІНАМИ, ВИРАЖЕНОЮ ДИХАЛЬНОЮ НЕДОСТАТНІСТЮ ТА/АБО ОЗНАКАМИ ТЯЖКОГО СЕПСИСУ АБО СЕПТИЧНОГО ШОКУ, ХАРАКТЕРИЗУЄТЬСЯ НЕСПРИЯТЛИВИМ ПРОГНОЗОМ І ПОТРЕБУЄ ПРОВЕДЕННЯ ІНТЕНСИВНОЇ ТЕРАПІЇ.
“Малі” критерії важкого перебігу негоспітальної пневмонії: частота дихання 30 за одну хвилину та більше; порушення свідомості; SaO2 менше 90% (за даними пульсоксиметрії), РaO2 нижче 60 мм рт.ст.; систолічний артеріальний тиск нижче 90 мм рт.ст.; двобічне або багаточасткове ураження легень, порожнини розпаду, плевральний випіт.
“ВЕЛИКІ” критерії важкого перебігу негоспітальної пневмонії: потреба в проведенні штучної вентиляції легень; швидке прогресування вогнищево-інфільтративних змін в легенях – збільшення розмірів інфільтрації більше ніж на 50% протягом найближчих двох діб; септичний шок або необхідність введення вазопресорних препаратів протягом більше чотирьох годин;
“ВЕЛИКІ” критерії важкого перебігу негоспітальної пневмонії: гостра ниркова недостатність (кількість сечі менша 80 мл за 4 години або рівень креатиніну в сироватці крові вище 0,18 ммоль/л або концентрація азоту сечовини вище 7 ммоль/л. За важкий перебіг негоспітальної пневмонії свідчить наявність у хворих не менше двох “малих” або одного “великого” критерію, кожен з яких достовірно підвищує ризик розвитку летального кінця. У всіх хворих після госпіталізації необхідно кожних 12 годин проводити оцінку ступеня тяжкості перебігу захворювання.
КРИТЕРІЇ ДІАГНОЗУ НП Діагноз НП є визначеним за наявності у хворого рентгенологічно підтвердженої вогнищевої інфільтрації легеневої тканини та 2 клінічних ознак: гострий початок захворювання з підвищення температури тіла > 38 С; кашель із виділенням харкотиння; фізикальні ознаки (притуплений або тупий перкуторний звук, ослаблене або жорстке бронхіальне дихання, фокус дзвінких дрібнопухирцевих хрипів і /або крепітації); Лейкоцитоз (>10.10 9/л) і /або паличкоядерний зсув (>10%).
КРИТЕРІЇ ДІАГНОЗУ НП За відсутності або неможливості отримати рентгенологічне підтвердження вогнищевої інфільтрації в легенях діагноз вважається неточним/невизначеним. Діагноз встановлюють із урахуванням даних епідеміологічного анамнезу, скарг хворого та наявності фізикаль них ознак.
КРИТЕРІЇ ДІАГНОЗУ НП Припущення про наявність НП малоймовірне у хворих з лихоманкою, скаргами на кашель, задишку, виділення харкотиння та/або біль у грудях за відсутності фізикальних ознак і неможливості проведення рентгенологічного обстеження органів дихання.
Прогностичні чинники ризику летального кінця у хворих на НП 1. Основні: порушення свідомості; частота дихання>30 уд./хв; артеріальна гіпотензія (САТ
Прогностичні чинники ризику летального кінця у хворих на НП Додаткові: двобічне або багаточасткове ураження легень, порожнини розпаду, плевральний випіт (за даними рентгенологічного дослідження органів грудної клітки); гіпоксемія (SaO2
Прогностичні чинники ризику летального кінця у хворих на НП Чинники, які були у хворого до початку захворювання на НП: вік > 50 років; наявність супутніх захворювань (ХОЗЛ, бронхоектатичної хвороби, злоякісних новоутворів, ЦД, застійної СН, хронічних захворювань печінки, цереброваскулярних захворювань, алкоголізму, наркоманії).
Прогностичні чинники ризику летального кінця у хворих на НП За відсутності будь-яких несприятливих прогностичних чинників ризик летального кінця становить 0,1-0,4%. Хворі підлягають лікуванню в амбулаторних умовах; хворих із наявністю одного з основних несприятливих прогностичних чинників необхідно госпіталізувати; наявність у хворого двох або більше основних несприятливих прогностичних чинників свідчить про тяжкий перебіг захворювання та високий ризик летального кінця (23%- при наявності двох чинників, 33%-трьох). Хворі терміново госпіталізуються до ВРІТ.
ГРУПИ ХВОРИХ НА НЕГОСПІТАЛЬНУ ПНЕВМОНІЮ ТА ЇХ ЛІКУВАННЯ З урахуванням вищенаведених даних пропонується розподіляти дорослих пацієнтів з негоспітальною пневмонією на 4 групи:
ГРУПИ ХВОРИХ НА НЕГОСПІТАЛЬНУ ПНЕВМОНІЮ ТА ЇХ ЛІКУВАННЯ до першої групи відносять хворих з нетяжким перебігом негоспітальної пневмонії, які не потребують госпіталізації, без супутньої патології та інших “модифікуючих” факторів;
ГРУПИ ХВОРИХ НА НЕГОСПІТАЛЬНУ ПНЕВМОНІЮ ТА ЇХ ЛІКУВАННЯ до другої групи відносять хворих з нетяжким перебігом, які не потребують госпіталізації, з наявністю супутньої патології (ХОЗЛ, ниркової та серцевої недостатності, цереброваскулярних захворювань, пухлин, цукрового діабету, захворювань печінки, психічних розладів, хронічного алкоголізму) та/або інших “модифікуючих” факторів;
ГРУПИ ХВОРИХ НА НЕГОСПІТАЛЬНУ ПНЕВМОНІЮ ТА ЇХ ЛІКУВАННЯ до третьої групи відносять хворих з нетяжким перебігом захворювання, які потребують госпіталізації у терапевтичне відділення за медичними (наявність несприятливих прогностичних факторів) або за соціальними показаннями;
ГРУПИ ХВОРИХ НА НЕГОСПІТАЛЬНУ ПНЕВМОНІЮ ТА ЇХ ЛІКУВАННЯ до четвертої групи відносять хворих на негоспітальну пневмонію важкого перебігу, які потребують госпіталізації у ВРІТ.
ГРУПИ ХВОРИХ НА НЕГОСПІТАЛЬНУ ПНЕВМОНІЮ ТА ЇХ ЛІКУВАННЯ У пацієнтів з НП першої групи найчастішими етіопатогенами є Streptocjccus pneumoniae, Hemophilus influenzae, Mycoplasma pneumoniae, Chlamidia pneumoniae. Препаратами вибору для емпіричної терапії є пероральний прийом амоксициліну або сучасних макролідів (спіраміцину, азитроміцину, рокситроміцину, кларитроміцину), а альтернативним препаратом є доксициклін.
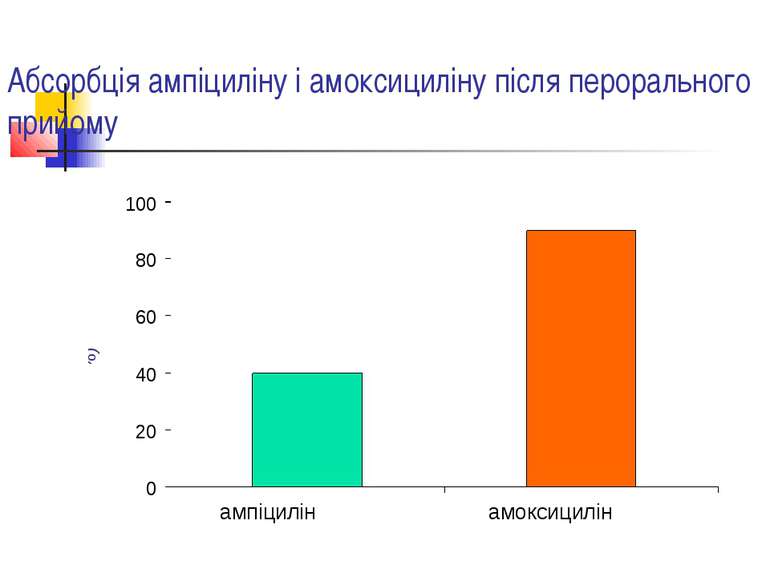
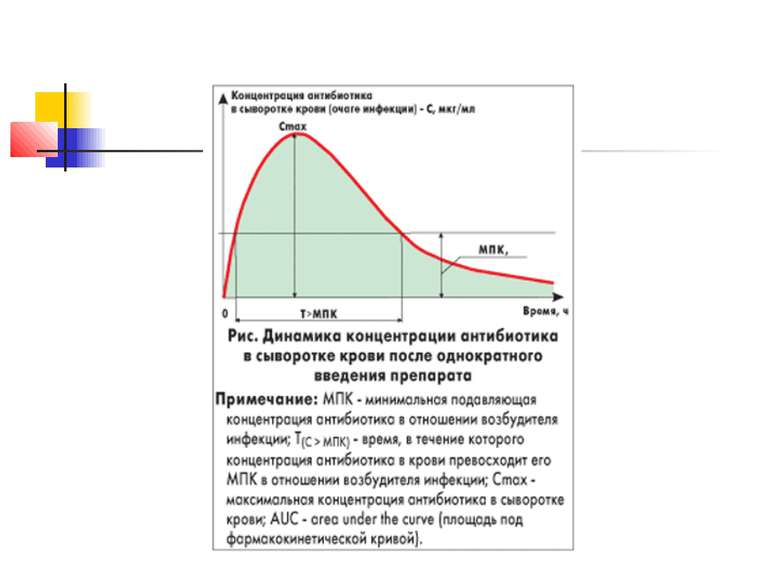
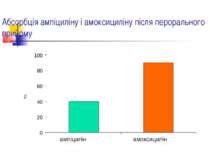
Фармакокінетика амоксициліну Абсорбція: 90 %. Прийом їжі суттєво не впливає на всмоктування препарату. Виводиться з сечею: 60 % протягом 6 год. Високі концентрації в сироватці крові, жовчі, сечі.
Протимікробний спектр G+ бактерії стрептококи пневмококи стафілококи ентерококи B. anthracis L. monocytogenes C. diphteriae B. burgdorferi G- бактерії H. influenzae H. pylori N. meningitidis E. coli Salmonella sp. Shigella sp. P. mirabilis P. multocida Примітка: Чутливі штами, які не продукують бета-лактамазу.
Протипокази Підвищена чутливість до амоксициліну, інших компонентів препарату або інших пеніцилінових антибіотиків Інфекційний мононуклеоз, злоякісні захворювання лімфатичних вузлів
Побічні ефекти розлади з боку травного каналу (нудота, блювання, діарея) реакції підвищеної чутливості (висипка на шкірі, свербіння, ангіоневротичний набряк, бронхоспазм) транзиторні зміни лабораторних показників (анемія, тромбоцитопенія, еозинофілія, лейкопенія)
Упаковка 16 або 100 капсул по 250 мг і 500 мг порошок для приготування 10 мл крапель для приймання всередину (100 мг/1 мл) порошок для приготування 60 мл суспензії для приймання всередину (125 мг/5 мл) порошок для приготування 100 мл суспензії для приймання всередину (250 мг/5 мл) У співпраці з компанією Bristol-Myers Squibb.
Дозування Хіконцил можна приймати натще або після їди, запиваючи невеликою кількістю рідини. Таблетки і суспензію треба приймати тричі на добу (через кожні 8 годин). Звичайну добову дозу можна збільшити, але треба водночас збільшити інтервали між дозами (через кожні 12 годин). Добова доза для дітей становить 20-40 мг/кг, її ділять на 3 прийоми. Максимальна добова доза для дітей становить 100 мг/кг, для дорослих - 6 г.
ГРУПИ ХВОРИХ НА НЕГОСПІТАЛЬНУ ПНЕВМОНІЮ ТА ЇХ ЛІКУВАННЯ У хворих з НП другої групи в якості можливих збудників розглядають Streptocjccus pneumoniae, Hemophilus influenzae, Staphylococcos aureus, Moraxella catarrhalis, родину Enterobacterіaceae. В якості препаратів вибору використовують пероральний прийом амоксицилін/клавуланової кислоти або цефуроксим/аксетилу. Альтернативними препаратами є макроліди або фторхінолони ІІІ-IV покоління та цефтриаксон.
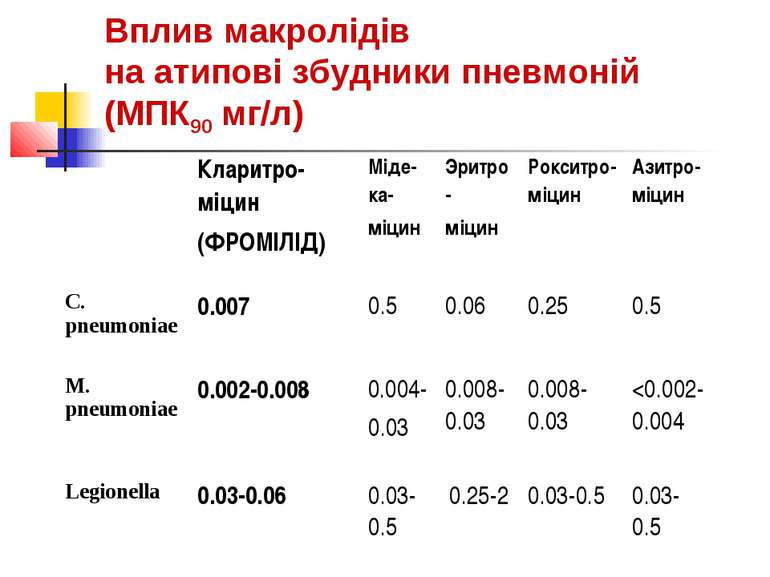
Переваги кларитроміцину (ФРОМіЛіДу) в порівнянні з іншими макролідами Найсучасніший з нових макролидов Кларитроміцин 1991 рік Спираміцин 1954 рік Рокситроміцин 1987 рік Джозаміцин 1970 рік Максимально збалансований антибактеріальний ефект против патогенів, що мають як поза- так і внутрішньоклітинну локалізацію. У присутності активного метаболіту 14-гідроксикларитроміцину, кларитромицин – макролід активний і проти Haemophylus influenzae 6
Вплив ФРОМІЛІДУ (кларитроміцину) на імунну систему ФРОМІЛІД (кларитроміцин), на відміну від більшості антибактеріальних препаратів, не пригнічує імунну систему, а навпаки: Сприяє активації фагоцитарно-макрофагальної системи та ряду ферментів, що беруть участь у руйнуванні патогенних мікроорганізмів (Auteri A. et al., 1993) Підвищує активність Т-кілерів, що особливо важливо для лікування змішаних бактеріально-вірусних інфекцій (H.Takeda et al., 1991) Інгібує продукцію цитокінів (H.Takeda et al., 1991) Має синергизм з комплементом сироватки крові.
Протизапальна активність КЛАРИТРОМІЦИНУ (ФРОМІЛІДУ) пригнічує продукцію цитокинів усуває інтраназальну гіперсекрецію поліпшує реологію мокротиння, зменшує її кількість пригнічує утворення і вивільнення NO альвеолярними макрофагами, що зменшує запалення
Бронходилатаційні ефекти кларитроміцину Тривале застосування в низьких дозах зменшує гіперреактивність при бронхіальній астмі (H. Miyatake et all., 1991) Послабляють скорочення гладеньких м'язів дихальних шляхів, цим не володіють b-лактами (J. Tamajki et all., 1995) Пригнічують секрецію келихоподібних клітин і нейтрофільну інфільтрацію слизової оболонки бронхів після інгаляції ІЛ-8 (O. Khair et all., 1996) В експерименті встановлено 4-х кратне збільшення рівня глюкокортикоідів у сироватці крові в зв'язку з активацією гіпоталамо-гіпофізарно-наднирникової системи. 16-членні макроліди цим ефектом не володіють (S. Hori et all., 1996) Кларитроміцин потенційно більш сильний, ніж еритроміцин, інгібітор цитохрома Р450, він на 20% підвищує концентрацію в крові еуфіллину, пролонгованих теофіллінів (R. Jacobs et all., 1997) Пригнічує окисний вибух, зменшує вироблення цитокинів, збільшує активність Т-кіллерів, что важливо при лікуванні інфекцій, викликаних вірусно-бактеріальними асоціаціями. (H. Takeda et all., 1991)
ГРУПИ ХВОРИХ НА НЕГОСПІТАЛЬНУ ПНЕВМОНІЮ ТА ЇХ ЛІКУВАННЯ У хворих з НП третьої групи в якості можливих збудників розглядають Streptocоccus pneumoniae, Hemophilus influenzae, атипові збудники, родину Enterobacterіaceae. В якості препаратів вибору застосовують парентеральне (в/м, в/в) введення амінопеніцилінів, переважно захищених або цефалоспоринів ІІ-ІІІ покоління +/- макролід. Альтернативними препаратами є внутрішньовенне застосування фторхінолонів III-IV покоління.
ГРУПИ ХВОРИХ НА НЕГОСПІТАЛЬНУ ПНЕВМОНІЮ ТА ЇХ ЛІКУВАННЯ У хворих з НП четвертої групи (госпіталізовані у ВРІТ з тяжким перебігом захворювання) в якості можливих збудників розглядають Streptocоccus pneumoniae, Hemophilus influenzae, Staphylococcos aureus, родину Enterobacterіaceae, Pseudomonas spp, полімікробні асоціації. В якості препаратів вибору використовують захищені амінопеніциліни внутрішньовенно або цефалоспорини третього покоління + макролід.
Фторхінолони в практиці сімейного лікаря Професор кафедри терапії і сімейної медицини Тернопільського державного медичного університету Звершхановський Ф.А.
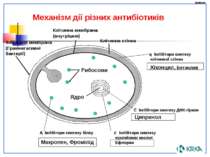
В основі виборчої дії антибактеріальних препаратів лежить специфічне скріплення з мішенями, унікальними для бактерій і відсутніми у людини і тварин. Відомі два основні механізми селективної дії антибактеріальних препаратів:
пригнічення активності специфічних ферментів (β-лактами інгібірують карбоксипептидазу, фторхинолони- топоізомерази) і скріплення з унікальними структурними елементами (наприклад, макроліди зв'язуються з рибосомами, не будучи прямими ферментативними інгібіторами).
Коли з'явилися перші хінолони, ніхто не чекав, що їх чекає таке блискуче майбутнє: з невеликої групи препаратів, що використалися для лікування інфекцій сечовивідних шляхів, вони перетворилися на один з домінуючих класів антибіотиків.
Група хінолонів — численна група антибактеріальних лікарських препаратів, що володіють схожим механізмом дії: інгібіруванням синтезу бактерійної ДНК.
Родоначальником даної групи являється синтезована в 1962 році налідиксова кислота. У подальші роки були створені такі препарати, як оксолінова, піпімедиева і піромідієва кислоти, а також циноксацин.
Буквально революційний переворот в подальшому розвитку описуваної групи зробила ідея включення атомів фтору в 6-е положення молекули хіноліну. Це корінним чином змінило спектр антибактеріальної дії у бік значного його розширення і всі клинико-фармакологічні показники нового покоління фторуючих похідних.
Залежно від кількості атомів фтору, включених в молекулу хінолонів, розрізняють монофторуючі з'єднання (ципрофлоксацин, норфлоксацин, офлоксацин, пефлоксацин, руфлоксацин, еноксацин) ди- (ломефлоксацин, спарфлоксацин)
Перші препарати групи фторхінолонів були запропоновані для клінічної практики в 1978–1980 рр. До теперішнього часу розроблені більше 30 препаратів і більше 20 з них детально вивчені в клініці. За 20 років клінічного застосування фторхінолони зайняли одне з провідних місць серед антимікробних засобів.
Всі хінолони селективно інгібірують один з ключових ферментів мікробної клітини — ДНК-ГіРАЗУ, відповідальну за нормальний біосинтез і реплікацію ДНК бактерій.
Мішенями дії фторхінолонових препаратів є два ферменти класу топоізомераз в бактерійній клітині ДНК-ГіРАЗи (топоізомерази II) і топоізомерази IV.
Інгібірування цих ферментів порушує процеси росту і ділення бактерійної клітини, що приводить до її загибелі.
Фторхінолони — препарати широкого спектру дії активні відносно грампозитивних і грамнегативних, аеробних і анаеробних мікроорганізмів, хламідій, микоплазм, легионел, мікобактерій.
Гриби, віруси, трепонеми, більшість простих стійкі до дії фторхинолонів. Проте при всій схожості антибактеріального спектру існують відмінності в чутливості мікроорганізмів як до представників різних поколінь фторхинолонов, так і до тих або інших препаратів усередині покоління
Як вже указувалося вище, спектр дії хінолонів I покоління обмежується впливом на деякі грамнегативні мікроорганізми сімейства Enterobacteriaceae. У II покоління хінолонів (ранні фторхінолони) значно зросла активність відносно широкого спектру грамнегативних аеробних мікроорганізмів, а також золотистих стафілококів.
Ципрофлоксацин, офлоксацин і ломефлоксацин пригнічують зростання мікобактерій туберкульозу. Недоліком препаратів II покоління є їх низька активність відносно пневмококів, хламідій, мікоплазм і анаеробів.
Результатом наукових досліджень з'явилося створення фтохінолонів III і IV покоління, антибактеріальна дія яких по відношенню до грамнегативних мікроорганізмів не поступається дії препаратів II покоління (окрім синегнійної палички).
Що ж до грампозитивної флори (зокрема пневмококів), а також хламідій, мікоплазм, мікобактерій, то в даному випадку нові фторхінолони істотно перевершують ранні.
Крім того, препарати IV покоління ефективні також відносно неспоротворних анаеробів, зокрема відносно штамів, стійких до дії ранніх фторхінолонів. Нові фторхінолони за активність, що проявляється до респіраторних патогенів, а також здатність добре проникати в слизову оболонку дихальних шляхів і секрет бронхів, називають «респіраторними».
У клінічну практику поступово входять такі нові фторхінолони, такі як левофлоксацин, спарфлоксацин, моксифлоксацин, гатіфлоксацин, геміфлоксацин, ситафлоксацин, клінафлоксацин і ін.
Левофлоксацин (лефлоцин компанії ,таванік) — лівообертаючий ізомер офлоксацина поєднує в собі високу ефективність офлоксацина із стійкістю молекули до біотрансформації в організмі і можливістю розробки 2-х лікарських форм.
При цьому левофлоксацин в 2 рази активніший за офлоксацин на тлі кращої переносимості. Препарат активний відносно ентерококів, синегнійної палички (але поступається ципрофлоксацину), хламідій, микоплазм, золотистого і епідермального стафілококів, збудника газової гангрени.
Цілком природно, що разом з офлоксацином не був обійдений увагою дослідників і один з найактивніших фторхінолонів — ципрофлоксацин (Ципринол фірми КRKA)
Інтенсивні пошуки у ряді його аналогів (з'єднань, що мають циклопропильний радикал в положенні 1) завершилися створенням таких фторхінолонів, як спарфлоксацин, грепафлоксацин, моксифлоксацин, гатіфлоксацин, геміфлоксацин, ситафлоксацин, клинафлоксацин. Моксифлоксацин і гатіфлоксацин (БІГАФЛОН фірми Юрія-Фарм) мають зміни в положенні 8 ОСН3. Спарфлоксацин є дифторхінолоном (6,8 ФХ) з аміногрупою в 5 положенні.
Моксифлоксацин (авелокс) як і всі похідні 8-метокси-6-ФХ інгібірує функції одночасно двох ферментів-мішеней для фторхінолонів (топоізомерази IV і ДНК-ГіРАЗи), у зв'язку з чим володіє високою бактерицидною активністю і підвищеною здатністю перешкоджати відбору резистентних мутантів. Моксифлоксацин високо активний проти грампозитивних і грамнегативних мікроорганізмів (включаючи полірезистентні мікроорганізми), анаеробів і атипових збудників.
Препарат є одним з найактивніших відносно стафілококів (у тому числі і метициллин-резистентних) фторхінолоном (МИК90 0,015-2 мг/л). По дії на мікоплазми і уреаплазми перевершує ципрофлоксацин і левофлоксацин, а по дії на хламідії — ципрофлоксацин і офлоксацин
Ефективність препарату проти спорооутворюючих і неспоротворних анаеробів порівняна з іміпенемом, метронідазолом і кліндаміцином. Моксифлоксацин перевершує дію ципрофлоксацина, офлоксацина і левофлоксацина проти туберкульозної палички, проявляючи активність також відносно полірезистентних штамів мікобактерій (МИК90 0,5 мг/л).
По силі антипневмококового ефекту поступається тільки ситафлоксацину і геміфлоксацину. Препарат має тільки пероральну лікарську форму, проте передбачається створення і ін'єкційної форми.
Необхідно відзначити, що вельми перспективними в створенні нових високоефективних препаратів виявилися дослідження в плані вивчення похідних нафтиридонкарбонової кислоти (аналоги налідиксової кислоти). Першим препаратом в цьому ряду був темафлоксацин, потім був одержаний тровафлоксацин
Тровафлоксацин (тровак) — спектр дії препарату зіставимо із спектром іміпенема. До препарату високо чутливі стрептококи, метицилін-чутливі стафілококи, анаероби, ентеробактерії, гемофільна паличка. Активність препарату відносно ряду штамів синегнойной палички перевищує активність ципрофлоксацина.
Всі фторхінолони швидко і добре всмоктуються в шлунково-кишковому тракті. Їжа, як правило, уповільнює всмоктування препаратів, але не знижує їх біодоступність. Всмоктування фторхинолонів порушується при одночасному прийомі антацидів, що містять алюміній і магній, сукральфата, препаратів заліза.
Біодоступність для більшості фторхінолонів при прийомі всередину складає 80–100% (табл. 2), окрім норфлоксацина (20–40%). Максимальна концентрація в крові досягається через 1–2,5 години. Зв'язок з білками — в межах 20–50% (норфлоксацин і моксифлоксацин — 10%).
Фторхінолони добре проникають в тканини і рідини організму, альвеолярні макрофаги, поліморфно-ядерні лейкоцити, жовчовивідні, дихальні шляхи, легені, слизисту шлунково-кишкового тракту, нирки, статеві органи, сечу, слину, мокроту, жовч, альвеолярну рідину.
Найбільш високі показники проникнення в ЦНС спостерігаються у пефлоксацина, тровафлоксацина.
Концентрації фторхіолонів в багатьох тканинах близькі до сироваткових або перевищують їх. Так, наприклад, ломефлоксацин, завдяки своїй оптимізованій фармакокінетиці, створює концентрацію в органах і тканинах, в 2–7 разів концентрацію, що перевищує, в плазмі крові.
Всі фторхінолони піддаються метаболізму з утворенням неактивних метаболитів. Препарати поволі виводяться з організму.
Період напіввиведення для більшості препаратів II покоління складає 5–9 годин, а для нових фторхінолонів — 10–20 і навіть 36 годин (руфлоксацин). Такий тривалий період виведення, а також наявність антибіотичної дії дозволяє призначати їх 2 рази (ранні фторхинолони) або 1 раз на добу
Виводяться фторхінолони нирками шляхом клубочкової фільтрації і канальцієвої секреції, а також з жовчю і фекаліями. При цьому офлоксацин і ломефлоксацин виводяться головним чином нирками, пефлоксацин — з жовчю, інші препарати — і нирками, і з жовчю.
Фторхінолони — високоефективні лікарські засоби. Область застосування препаратів другого покоління — як правило, внутрішньолікарняні інфекції різного генезу і локалізації: інфекції дихальних шляхів, черевної порожнини, шкіри і м'яких тканин, кісток і суглобів, менінгіт, кишкові, урогенітальні інфекції, септицемія, бактеріємія, деякі з них застосовуються в комплексному лікуванні туберкульозу.
Фторхинолони III–IV поколінь є препаратами вибору в лікуванні позалікарняних інфекцій, викликаних пеницилін-резистентними штамами S. pneumoniae, S. aureus, H. influenzae, M.catarrhalis. Вони застосовуються для лікування інфекцій дихальних шляхів, кісток і м'яких тканин, урогенітальних інфекцій.
Фторхінолони — відносно малотоксичні препарати. Проте і при їх застосуванні можуть виникати несприятливі явища.
Найчастіше (3–6% хворих) виникають реакції з боку шлунково-кишкового тракту (нудота, зміни смаку, діарея, болі в животі і ін.) і центральної нервової системи (1–4% хворих) — головний біль, запаморочення, дратівливість, порушення сну; розвиток судом в основному спостерігається у хворих, схильних до них (епілепсія, гіпоксія, черепномозкова травма, одночасне призначення з теофіліном) .
при застосуванні фторхінолонів можуть зустрічатися випадки важчого ураження печінки і жовчовивідних шляхів, такі як гепатит, некроз печінки, печінкова недостатність, холестатична жовтяниця. Гепатотоксична дія найчастіше виникає при застосуванні нових фторхинолонов.
При дії на серцево-судинну систему необхідно відзначити здатність фторхінолонів подовжувати інтервал QT на ЕКГ. Зміна інтервалу QT реєструється в експерименті у всіх фторхинолонов і є дозозалежною.
фторхінолони слід призначати з обережністю пацієнтам, страждаючим важкою серцево-судинною патологією, а також при комбінації цих засобів з препаратами, які можуть викликати подовження інтервалу QT: антиаритмиками (хінідин, соталол, амиодарон), антигістамінними (терфенадин, астемизол), психотропними (флуоксетин), макролідами, ко-тримоксазолом, імідазолами і схожими з хінолонами протималярійними препаратами.
Фторхінолони володіють фототоксичністю. Найбільшою мірою ця дія виражена у трифторхінолона флероксацина, дифторхинолонів спарфлоксацина і ломефлоксацина, а також у монофторуючого препарату клінафлоксацина.
Загальновідомо, що фторхінолони мають в застосуванні вікові обмеження. Це пов'язано з наявністю артротоксичних ефектів, виявлених в експерименті у статевонезрілих тварин (собаки).
FDA рекомендує обережно використовувати ФХ другого і третього покоління у осіб похилого віку, особливо в комбінації з ГКС і при появі перших ознак ураження сухожилків припинити застосування ФХ та утримуватись від фізичної активності.
Фторхінолони можуть впливати на систему цитохром Р-450 і метаболізм метилксантинів (теофіліну, кофеїну).
Хороші мікробіологічні характеристики моксифлоксацина поєднуються із сприятливою фармакокінетикою і фармакодинамікою цього препарату: тривалий період напіввиведення, що забезпечує одноразовий прийом, високі концентрації в тканинах бронхів і легенів роблять цей препарат незамінним при лікуванні респіраторних інфекцій.
Враховуючи переважаючий спектр мікрофлори при інфекціях дихальних шляхів (S. pneumoniae, Moraxella catarrhalis, Haemophilus influenzaе, а також атипові збудники хламідії і мікоплазми), моксифлоксацин є препаратом вибору при лікуванні респіраторних інфекцій.
Крім того, моксифлоксацин високо ефективний по відношенню до Staph. aureus, Enterobacteriaceae spp., особливо до полірезистентних штамів.
М.В. КОСЕНКО, член-кореспондент УААН, доктор ветеринарних наук, Ю.М. КОСЕНКО, кандидат біологічних наук, В.П. МУЗИКА, М.В. ПАШКОВСЬКА, О.З. БАЛЯН, наукові співробітники Державний науково-дослідний контрольний інститут ветеринарних препаратів та кормових добавок В.П. ЛИТВИН, доктор ветеринарних наук Національний аграрний університет
Авторами визначена висока протимікробна і лікувальна ефективність вітчизняного фторхінолонового препарату “Бороцин 4%” при лікуванні ешерихіозу і сальмонельозу птиці.
Першим кроком в лікуванні пневмоній завжди є рішення про застосування антибактеріальних засобів, які повинні призначатися в перші дві години при пневмоніях важкої течії, а при пневмоніях важкої течії з різними чинниками ризику – негайно.
Найбільш частими бактерійними збудниками позалікарняних пневмоній є пневмококи, стрептококи, гемофільні палички. З 1970х років об'єктивною реальністю стало зростання епідеміологічної значущості раніше маловідомих агентів, таких як легионелла, мікоплазма, хламідія, пневмоцисты, різні мікобактерії і гриби .
Серйозною проблемою є зростаюча придбана резистентність до антибіотиків багатьох мікроорганізмів.
При виборі антибактеріальних засобів слід враховувати регіональні особливості придбаної резистентності до антибіотиків. Багато в чому вона обумовлена традиціями антибактеріальної терапії, доступністю препаратів і шаблонністю їх застосування.
Аналіз чутливості до антибіотиків мікроорганізмів, виділених з мокроти хворих пневмоніями в Москві [3], показав часту стійкість стрептококів (включаючи пневмококів) до пеніциліну, ампіциліну, доксициклину, еритроміцину, лінкоміцину, котримоксазолу.
Офлоксацин і ципрофлоксацин мають невисоку активність відносно грампозитивних бактерій, перш за все пневмококів і стрептококів, що знижувало їх ефективність при лікуванні позалікарняних бронхолегеневих інфекцій.
Ці фторхінолони, що одержали назву респіраторних на відміну від фторхіолонів попередніх генерацій, ефективно пригнічують грампозитивні мікроорганізми.
Левофлоксацин (Лефлоцин,Таванік), моксифлоксацин, спарфлоксацин, гатіфлоксацин (бігафлон) високо активні відносно грампозитивних мікроорганізмів: стрептококів, пневмококів, стафілококів, листерий, коринебактерий і, у меншій мірі, здатні пригнічувати ентерококи.
Антибактеріальні препарати цієї групи володіють також високою активністю відносно більшості грамнегативних бактерій: гемофільних паличок, моракселлы, ацинетобактера, энтеробактера, цитробактера, гонокока. Дещо нижче їх ефективність відносно клебсиеллы, синегнойной і кишкової паличок.
Респіраторні фторхинолони високо активні відносно внутріклітинних мікроорганізмів легионелл, микоплазм, хламідій. Вони також пригнічують мікобактерії туберкульозу і деякі анаероби.
Хороші мікробіологічні характеристики моксифлоксацина поєднуються із сприятливою фармакокінетикою і фармакодинамікою цього препарату: тривалий період напіввиведення, що забезпечує одноразовий прийом, високі концентрації в тканинах бронхів і легенів роблять цей препарат незамінним при лікуванні респіраторних інфекцій.
29 серпня 2006 «Public Citizen» — національна неприбуткова організація по захисту споживачів в США, що представляє їх інтереси в Конгресі, органах виконавчої і судової влади, — подала клопотання в Управління по контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA) про негайне додавання в інструкції до всіх протимікробних засобів групи фторхинолонов строгих попереджень (у чорній рамці) про ризик виникнення тендинопатии і розриву зв'язок
Серед лікарських засобів, на які звернуло увагу «Public Citizen», — антибактеріальні препарати, що призначаються при інфекціях ШКТ, дихальних і сечовивідних шляхів: ципрофлоксацин (Cipro®, «Bayer»), еноксацин (Penetrex®, «Aventis»), гатіфлоксацин (Tequin®, «Bristol-Myers Squibb»), левофлоксацин (Levaquin®, «Ortho-McNeil»), ломефлоксацин (Maxaquin®, «Unimed»), моксифлоксацин (Avelox®, «Bayer»), норфлоксацин (Noroxin®, «Merck»), офлоксацин (Floxin®, «Daiichi-Sankyo»).
У листопаді 1997 – грудні 2005 рр. зареєстровані 262 випадки розривів зв'язок, 258 випадків тенденіта і 274 випадків інших захворювань зв'язок під час прийому фторхінолонів; з них 175 випадків відмічені з початку 2003 р. 61% розривів зв'язок виявлений у людей, що приймали Levaquin® (левофлоксацин), частка якого серед всіх прописуваних фторхинолонов складає 45% за останні 4 роки в США. 23% розривів зв'язок відбулося у людей, що приймали Cipro® (ципрофлоксацин).
Найчастіше відбувається розрив ахіллового сухожилля, сухожиль ротаторної манжети плеча (rotator cuff), біцепса, м'язів кисті і великого пальця. Імовірно, фторхинолоны надають токсичний ефект на сухожильні волокона і зменшують їх кровопостачання.
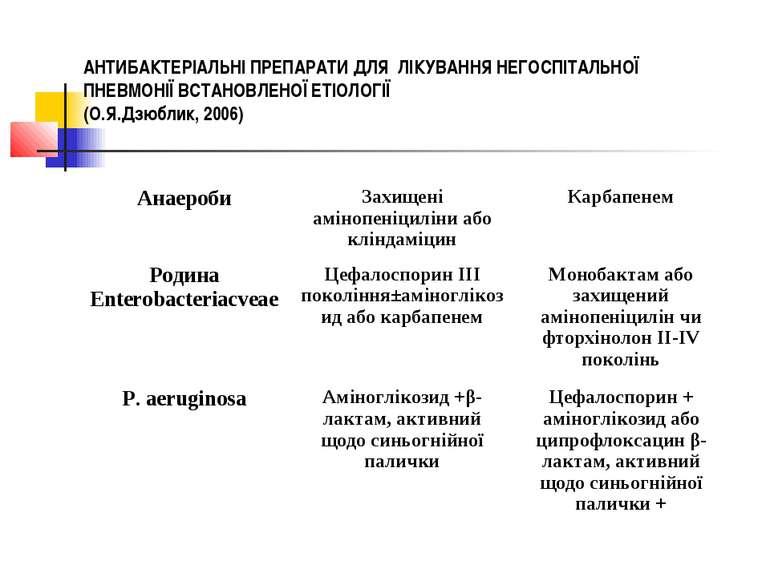
ГРУПИ ХВОРИХ НА НЕГОСПІТАЛЬНУ ПНЕВМОНІЮ ТА ЇХ ЛІКУВАННЯ При підозрі на Pseudomonas aeruginosa: ципрофлоксацин (в/в) + -лактам, активний до синьогнійної палички або аміноглікозид. Альтернативним лікуванням є внутрішньовенне застосування фторхінолонів ІІІ-IV покоління + -лактами, а при підозрі на Pseudomonas aeruginosa - -лактам активний по відношенню до синьогнійної палички + аміноглікозид.
ВИБІР АНТИБАКТЕРІАЛЬНОГО ПРЕПАРАТУ В РАЗІ НЕЕФЕКТИВНОСТІ ПОЧАТКОВОГО ЛІКУВАННЯ (О.Я.Дзюблик, 2006) Група хворих Прпарат, який отримував пацієнт Препарат, який слід застосовувати Можлива причина неефективності препарату I МАКРОЛІД АТИПОВІ ЗБУДНИКИ I МАКРОЛІД АМОКСИЦИЛІН МАКРОЛІДОРЕЗИСТЕНТНИЙ ШТАМ S.PNEUMONIAE II ЗАХИЩЕНИЙ АМІНОПЕНІЦИЛІН АБО ЦЕФАЛОСПОРИН II ПОКОЛІННЯ ДОДАТИ ДО β-ЛАКТАМА МАКРОЛІД АБО МОНОТЕРАПІЯ ФТОРХІНОЛОНОМ III-IV ПОКОЛІННЯ АТИПОВІ ЗБУДНИКИ
АНТИБАКТЕРІАЛЬНІ ПРЕПАРАТИ ДЛЯ ЛІКУВАННЯ НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ ВСТАНОВЛЕНОЇ ЕТІОЛОГІЇ (О.Я.Дзюблик, 2006) Збудник Прнепарати вибору Альтернативний препарат S.pneumoniae:чутливий до пеніциліну Стійкий до пеніциліну Бензилпеніцилін або амінопеніцилін Цефалоспорин III поколіня або ванкоміцин чи фторхінолон III-IV поколінь Цефалоспорин I-IV поколінь або ванкоміцин чи макролід чи тетрациклін Карбапенем H.influenzae Захищщений амінопеніцилін або азитроміцин (кларитроміцин) чи цефалоспорин II-III поколінь Фторхінолон III-IV поколінь
АНТИБАКТЕРІАЛЬНІ ПРЕПАРАТИ ДЛЯ ЛІКУВАННЯ НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ ВСТАНОВЛЕНОЇ ЕТІОЛОГІЇ (О.Я.Дзюблик, 2006)
АНТИБАКТЕРІАЛЬНІ ПРЕПАРАТИ ДЛЯ ЛІКУВАННЯ НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ ВСТАНОВЛЕНОЇ ЕТІОЛОГІЇ (О.Я.Дзюблик, 2006)
АНТИБАКТЕРІАЛЬНІ ПРЕПАРАТИ ДЛЯ ЛІКУВАННЯ НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ ВСТАНОВЛЕНОЇ ЕТІОЛОГІЇ (О.Я.Дзюблик, 2006)
КРИТЕРІЇ ЕФЕКТИВНОСТІ АНТИБАКТЕРІАЛЬНОЇ ТЕРАПІЇ Оцінку ефективності антибактеріальної терапії необхідно проводити через 48-72 години від початку лікування. Основними критеріями ефективності слід вважати зменшення проявів інтоксикації та зниження температури тіла хворого, відсутність ознак дихальної недостатності. За наявності позитивної динаміки наведених показників призначену антибактеріальну терапію продовжують.
КРИТЕРІЇ ЕФЕКТИВНОСТІ АНТИБАКТЕРІАЛЬНОЇ ТЕРАПІЇ Для оцінки стану хворого та ефективності терапії доцільно провести такі дослідження: клінічний аналіз крові на другий день та після закінчення антибактеріальної терапії;
КРИТЕРІЇ ЕФЕКТИВНОСТІ АНТИБАКТЕРІАЛЬНОЇ ТЕРАПІЇ біохімічний аналіз крові – за наявності змін при першому дослідженні – контрольний аналіз через один тиждень; дослідження газів крові або SaO2 у хворих з тяжким перебігом НП – щоденно до нормалізації показників; рентгенографію органів грудної клітки – через 2-3 тижні після початку лікування, а при погіршенні стану – у більш ранні терміни. У пацієнтів з нетяжким перебігом НП антибактеріальна терапія може бути завершена після досягнення стійкої нормалізації температури тіла протягом 3 - 5 днів. У таких випадках тривалість лікування складає, як правило, 7 – 10 днів. При мікоплазменній або хламідійній пневмонії тривалість антибактеріальної терапії сягає в середньому 10 – 14 днів, а при легіонельозній – 21 день.
СТУПІНЧАСТА АНТИБАКТЕРІАЛЬНА ТЕРАПІЯ ХВОРИХ НА НП Основними критеріями для переведення хворого на пероральний прийом антибіотика є:
СТУПІНЧАСТА АНТИБАКТЕРІАЛЬНА ТЕРАПІЯ ХВОРИХ НА НП нормальна температура тіла під час двох послідовних вимірювань з інтервалом 8 годин; позитивна динаміка інших симптомів захворювання; зменшення вираженості задишки; відсутність порушення всмоктування в травному тракті; непорушена свідомість; згода пацієнта на пероральний прийом препарату. Як правило, можливість переходу на пероральне застосування антибіотику виникає через 2 – 4 дні від початку лікування.
УСКЛАДНЕННЯ НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ гостра дихальна недостатність; інфекційно-токсичинй шок; вторинна бактеріємія, сепсис, гематогенні вогнища відсіву; перикардит, міокардит. деструкція/абсцес легеневої тканини; гострий респіраторний дистрес-синдром;
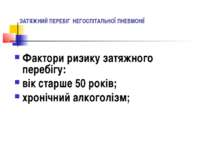
ЗАТЯЖНИЙ ПЕРЕБІГ ПНЕВМОНІЇ Наявність рентгенологічних ознак вогнищево-інфільтративних змін в легенях більше 4х тижнів на фоні покращення клінічної картини свідчить про пневмонію із затяжним перебігом. При відсутності ознак клінічного покращення та/або при наявності у пацієнтів факторів ризику затяжного перебігу НП показані додаткові методи обстеження – комп’ютерна томографія органів грудної клітки, фібробронхоскопія та інш.
ЗАТЯЖНИЙ ПЕРЕБІГ НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Фактори ризику затяжного перебігу: вік старше 50 років; хронічний алкоголізм;
ЗАТЯЖНИЙ ПЕРЕБІГ НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ наявність супутніх інвалідизуючих захворювань внутрішніх органів; тяжкий перебіг пневмонії; мультичасткова поширеність пневмонічної інфільтрації; вірулентні збудники пневмонії;
ЗАТЯЖНИЙ ПЕРЕБІГ НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ клінічна неефективність призначеної терапії; вторинна бактеріемія; набута антибіотикорезистентність збудника захворювання.
ЗАТЯЖНИЙ ПЕРЕБІГ НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Проводиться диференціальна діагностика з: вогнищево-інфільтративним туберкульозом легень та неінфекційними захворюваннями;
ЗАТЯЖНИЙ ПЕРЕБІГ НЕГОСПІТАЛЬНОЇ ПНЕВМОНІЇ ТЕЛА; імунопатологічними захворюваннями (системними васкулітами, вовчаковим пневмонітом, аспергільозом, ідеопатичним фіброзом, еозинофільною пневмонією, бронхоцентричним гранульоматозом); іншими захворюваннями та патологічними станами: застійною серцевою недостатністю, аспірацією чужерідного тіла, саркоїдозом, легеневим альвеолярним протеїнозом, круглястим ателектазом.
ПРИМІТКИ: аналіз використання засобів неантибактеріальної терапії у хворих на НП показує, що призначення амброксолу сприяє більш швидкому припиненню кашлю, нормалізації аускультативної та рентгенологічної картини пневмонії. В чисельних рандомізованих дослідженнях доведена ефективність сумісного призначення амброксолу з азитроміцином або амоксициліном.
ПРИМІТКИ: нестероїдні протизапальні препарати повинні використовуватися у хворих на НП тільки за показами, переважно для купування лихоманки та за наявності вираженого больового синдрому через суттєво високу вірогідність побічних ефектів. Позитивного впливу на легеневу мікро циркуляцію та оксигенацію крові НПЗП не мають.
ПРИМІТКИ: використання глюкокортикостероїдів базується на індивідуальному підході і показано, насамперед, хворим на НП із документованою вірусною етіологією (вітряна віспа, кір) та при пневмонії з важкими поза легеневими ускладненнями.
ПРИМІТКИ: використання інших небактеріальних засобів при НП (імуномодуляторів, вітамінів, антигістамінних, протигрибкових препаратів) не виправдано (Л.В. Богун, И.Г. Березняков 2005) загальним недоліком не медикаментозної терапії (фізіотерапії та інш.) є неможливість проведення сліпого дослідження, однак в період лихоманки у хворих на НП фізіотерапія здатна проявити жарознижуючу дію.
Найтиповіші помилки під час проведення антибактеріальної терапії негоспітальної пневмонії у дорослих (О.Я.Дзюблик, 2006) Часта зміна антибіотиків у процесі лікування, яку “пояснюють” небезпекою розвитку антибіотикорезистентності Показання до заміни антибіотиків: - клінічна неефективність, про яку можна судити через 48-72 год. терапії; -розвиток серйозних побічних ефектів, що потребують відміни антибіотиків; - висока потенційна токсичність препарату, що обмежує тривале його застосування
Найтиповіші помилки під час проведення антибактеріальної терапії негоспітальної пневмонії у дорослих (О.Я.Дзюблик, 2006)
Абсцес легень та емпієма плеври Професор кафедри терапії та сімейної медицини ФПО Звершхановський Фелікс Андрійович
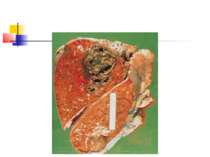
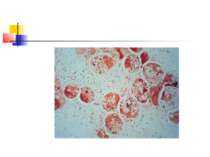
Абсцес легені - обмежена ділянка легеневого некрозу інфекційної етіології з єдиною або домінуючою порожниною розміром 2 см і більш. За наявності множинних порожнин або при солітарній порожнині менше 2 см в діаметрі використовують термін "некротизуючої", або "деструктивної" пневмонії.
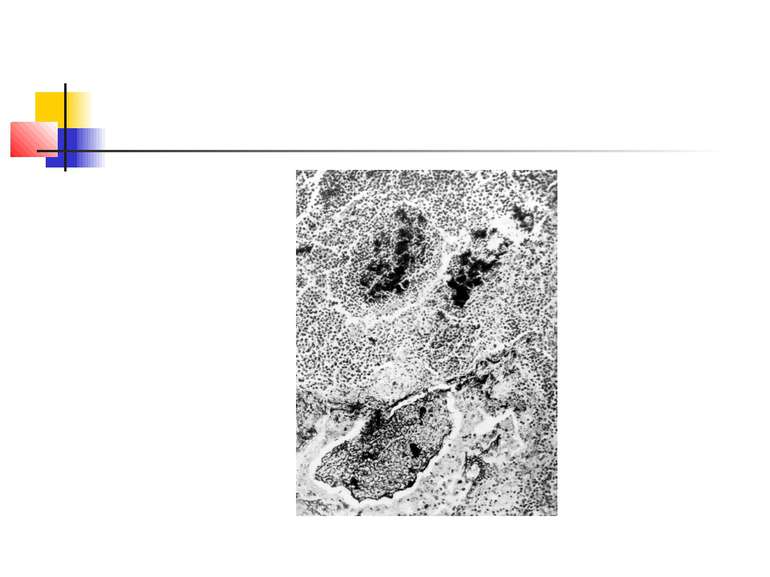
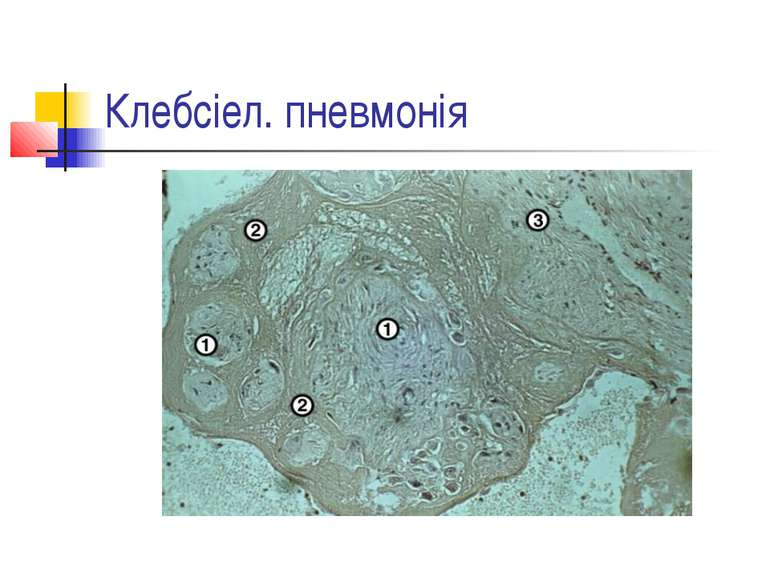
Найчастіше деструкція легеневої тканини розвивається при пневмонії, викликаній Staphylococcus aureus і Klebsiella pneumoniae. В той же час для пневмококової пневмонії звичайно не характерний розвиток деструкції легенів. Останніми роками показана роль стрептококів групи А (Streptococcus pyogenes) в розвитку некрозу легеневої тканини [1].
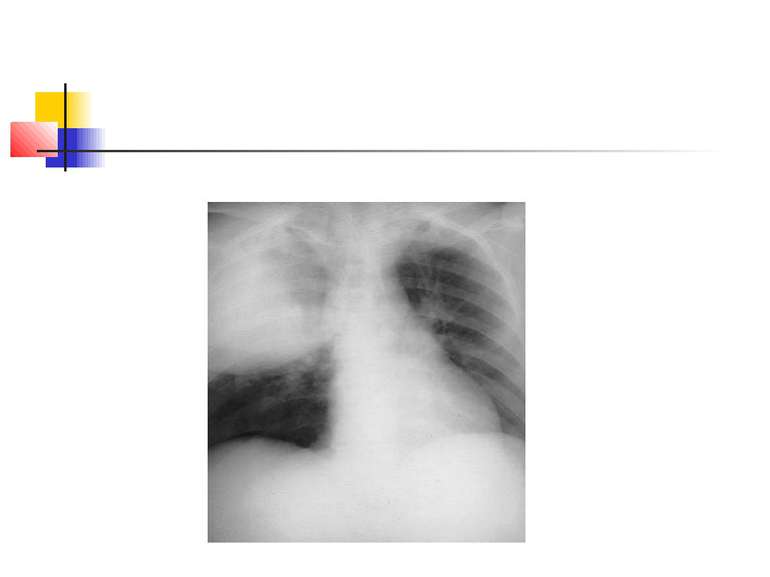
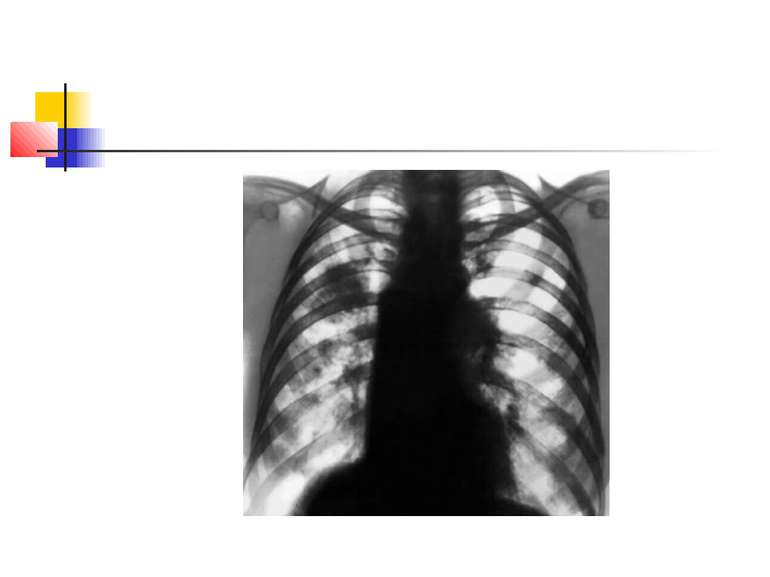
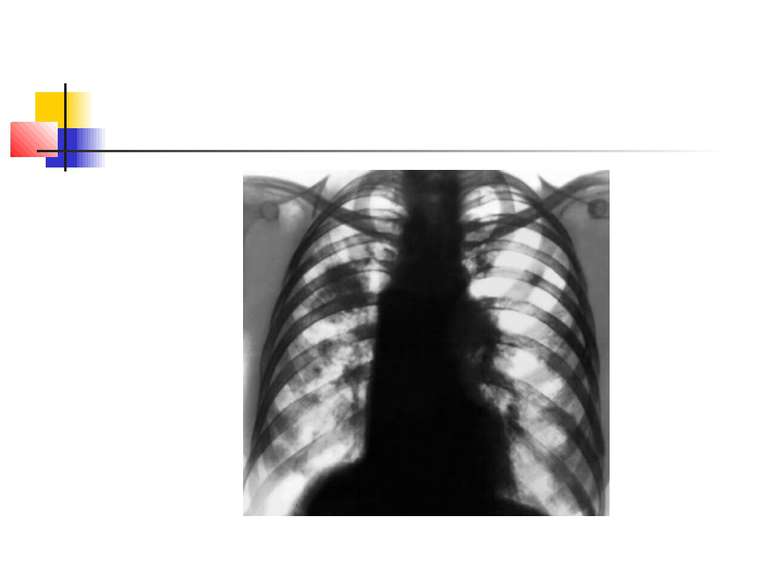
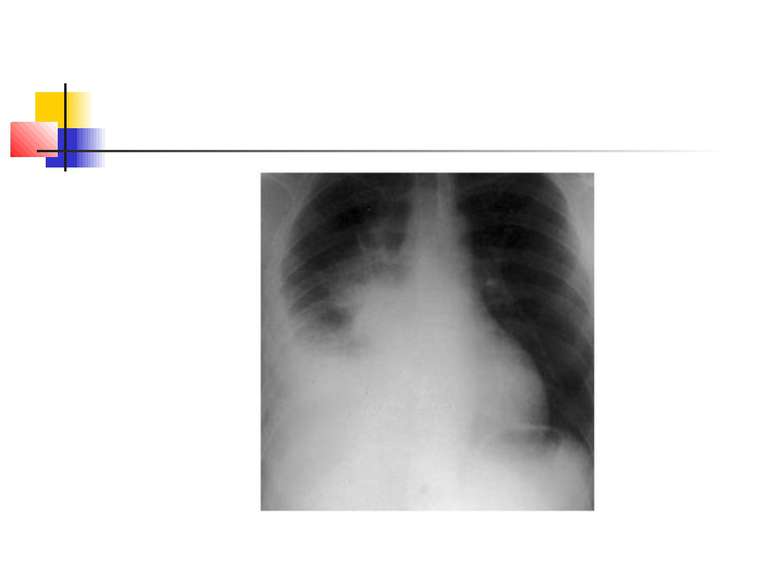
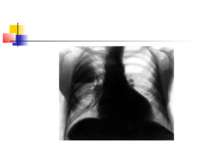
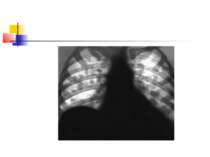
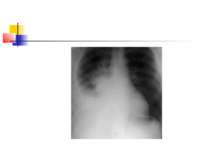
Деструктивні П., збудниками яких можуть бути, зокрема, стафілокок, стрептокок, характеризуються своєрідною рентгенологічною картиною. Вже в перші дні захворювання на тлі масивного затемнення легеневої тканини з'являються просвітлення, що свідчать про її розплавлення. Нижня межа цих просвітлень часто має горизонтальний напрям.
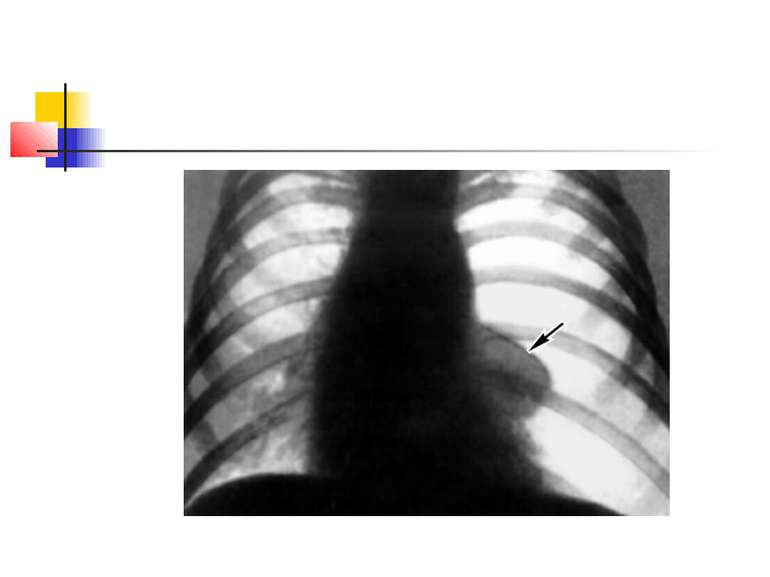
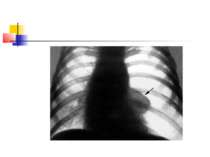
На рентгенограмі визначається вогнище(і) ущільнення легеневої тканини, в якому помітні ділянки просвітлення. При дренуванні порожнини абсцесу з бронхом рентгенологічно визначається повітряна порожнина з горизонтальним рівнем рідини (мал. 2).
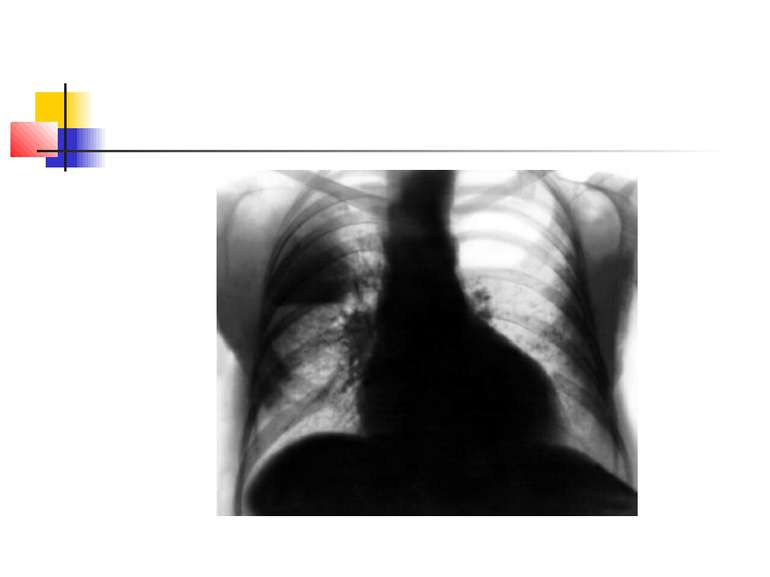
Якщо рідина, що знаходиться в порожнинах, дренується, вони очищаються і можуть прийняти округлу форму. У важких випадках порожнини зливаються між собою через розплавлення легеневої тканини, при цьому утворюються крупні, іноді гігантські, просвітлення. Результатом деструктивних П. нерідко буває грубий пневмосклероз (цироз) легені.
Стафілококова деструкція легенів звичайно характеризується наявністю декількох невеликих порожнин, що рентгенологічно визначається у вигляді неоднорідної інфільтрації з ділянками просвітлення. Для K.pneumoniae характерно формування крупного одиночного абсцесу (мал. 3).
Інша група мікроорганізмів, що викликає деструктивну пневмонію, - анаеробні бактерії. Анаероби займають провідне значення в етіології аспіраційної пневмонії, основним механізмів розвитку якої є аспірація орофарингеального секрету.
Чинники, сприяючі аспірації : Алкоголізм Eпілепсія Нейром'язові захворювання Мозковий інсульт Порушення свідомості різного генезу Захворювання ясен і зубів Захворювання стравоходу, що супроводжуються дисфагією і рефлюксом
Етіологічні чинники деструктивної і абсцедуючої пневмонії. Бактерії, що викликають некроз легеневої тканини: S. Aureus K. pneumoniae Аспірація секрету ротоглотки: Анаероби порожнини рота Streptococcus spp.
При виборі режиму антибактеріальної терапії абсцедуючої пневмонії необхідно враховувати можливу роль аеробних (S.aureus, K.pneumoniae) і анаеробних бактерій (табл. 2).
Раніше як засіб стартової терапії звичайно рекомендували бензилпеніцилін. Проте слід враховувати, що препарат не активний відносно K.pneumoniae, крім того, більшість штамів стафілококів в даний час стійко до бензилпеніциліну.
Кліндаміцин і лінкоміцин проявляють високу активність відносно стафілококів і анаеробних бактерій і часто розглядаються як засоби 1-го ряду при лікуванні абсцедуючої пневмонії. Проте останніми роками відмічене зростання стійкості анаеробів групи Bacteroides fragilis до лінкозамідів.
Крім того, лінкозаміди не активні відносно грамнегативних аеробних мікроорганізмів (K.pneumoniae і ін.). У зв'язку з цим в даний час лінкозаміди, видно, не можуть розглядатися як адекватні засоби лікування деструктивної пневмонії, принаймні в режимі монотерапії.
Найбільш збалансованою дією на аеробні і анаеробні мікроорганізми, що викликають деструктивну і абсцедуючу пневмонію, володіють інгібіторозахищені пеніциліни, які в даний час можуть розглядатися як оптимальні засоби емпіричної монотерапії.
Висока надійність амоксициліну/клавуланату як засіба стартової емпіричної терапії ускладненої пневмонії показана в чисельних клінічних дослідженнях. Застосування амоксициліну/клавуланату (по 2,4 г 3 рази на добу внутрішньовенно з подальшим застосуванням всередину) привело до одужання всіх 40 досліджених пацієнтів з некротизуючою пневмонією або абсцесом легені [14].
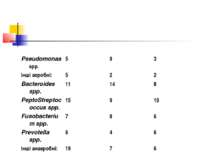
Амоксицилін/клавуланат є одним з найбільш активних антибіотиків: значення МПК90 амоксициллина/клавуланата для Bacteroides fragilis, Prevotella spp., Fusobacterium nucleatum, PeptoStreptococcus anaerobicus, P.micros, P.magna склали 4, 1, 0,25, 8, 0,5 і 0,5 мкг/мл відповідно, а відсоток чутливих штамів склав 84% для P.anaerobicus, 95% для B.fragilis і 100% для інших анаеробів [9].
Такою ж високою активністю відносно найбільш значущих аеробних і анаеробних мікроорганізмів, що викликають деструктивну пневмонію, володіють інші інгібіторзахищені b-лактами (ампіцилін/сульбактам, амоксицилін/сульбактам, тікарцилін/клавуланат, цефоперазон/сульбактам), проте клінічні дані по ефективності цих режимів терапії обмежені.
Цефалоспорини III-IV покоління володіють високою активністю проти грамнегативних бактерій, в той же час природна антистафілококова активність у препаратів III покоління не дуже висока, що може пояснювати неуспіх лікування цими антибіотиками.
Ранні фторхінолони (ципрофлоксацин, офлоксацин, пефлоксацин) разом з високою активністю проти грамнегативних бактерій характеризуються лише помірною активністю проти стафілококів і пневмококів, що разом з низькою антианаеробною активністю обмежує їх використання при ускладненій пневмонії.
Нові фторхінолони - левофлоксацин і моксифлоксацин - відрізняються істотно вищою активністю проти грампозитивних бактерій, проте антианаеробна активність у них різна: у левофлоксацина виявлена помірна активність проти деяких анаеробів
Моксифлоксацин - єдиний з фторхінолонів, що проявляє високу активність проти анаеробів, причому по активності він поступається тільки карбапенемам і інгібіторзахищеним пеніцилінам і частота стійких штамів не перевищувала 5% [18, 19].
Отже, нові фторхінолони потенційно ефективні при ускладненій пневмонії і можуть призначатися як альтернативні засоби, причому моксифлоксацин - в режимі монотерапії, левофлоксацин - в комбінації з метронідазолом.
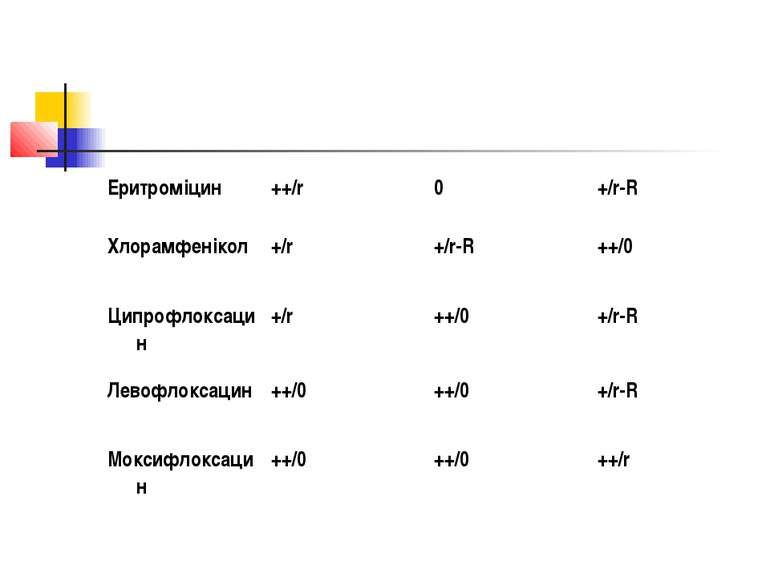
Природня активність: ++ - высока; + -помірна, 0 - відсутня. Резистентність: 0 - відсутня; r - незначна (до 5%); r-R – помірна (5-10%) або варіабельна; R - висока (>30%).
Рекомендації з антибактеріальної терапії Наибільш надійні Амоксицилін/клавуланат Іміпенем Левофлоксацин + метронідазол Меропенем Моксифлоксацин Тикарцилін/клавуланат Цефепім + клиндаміцин Ертапенем
Альтернативні схеми Амоксицилін/сульбактам Ампіцилін/сульбактам Хлорамфенікол Цефотаксим + кліндамицин Цефтріаксон + клиндаміцин Ципрофлоксацин + метронідазол
Режими етіотропної терапії абсцедуючої пневмонії, выкликаної S.aureus або K.pneumoniae на добу
Слід зазначити низьку клінічну ефективність аміноглікозидних антибіотиків при деструктивній пневмонії. Це пояснюється, з одного боку, природною стійкістю анаеробних бактерій до аміноглікозидів, з іншого - активність цих препаратів значно знижується в кислому середовищі, що спостерігається в порожнині абсцесу.
У більшості сучасних рекомендацій по лікуванню деструктивної і абсцедуючої пневмонії, як засоби вибору, вказуються інгібіторозахищені b-лактами, кліндаміцин, карбапенеми або моксифлоксацин.
Кліндаміцин доцільно призначати в поєднанні з цефалоспоринами III-IV покоління, причому при ускладненій позалікарняній пневмонії цілком надійні препарати III покоління - цефтриаксон або цефотаксим, а при аспіраційній або абсцедуючій нозокоміальній пневмонії, безумовно, перевагу матиме комбінація цефепіма з кліндаміцином. Рекомендовані схеми терапії приведені табл.
Неодмінною умовою адекватного лікування абсцедуючої пневмонії є достатня тривалість антибактеріальної терапії. Звичайно рекомендується призначення антибіотиків на 3-4 тиж.і більше.
Емпієма плеври Емпієма - інфікований парапневмонічний плевральний випіт, є рідкісним, але важким ускладненням бактерійної позалікарняної пневмонії. Плевральний випіт спостерігається приблизно в 40% випадків позалікарняної пневмонії, але в більшості випадків інфікування не відбувається і випіт розрішується самостійно.
Летальність при емпіємі плеври складає, за даними різних авторів, від 2 до 50%, причому найбільш серйозний прогноз спостерігається у немолодих і імуноскомпроменсованих пацієнтів. Прогноз також значно погіршується у разі виділення резистентних штамів збудників і при відстроченому початку інтенсивної терапії і адекватної антибиотикотерапии.
Якщо абсцес легені викликають мікроорганізми, здатні приводити до деструкції і некрозу легеневої тканини, то емпієму плеври здатний викликати будь-який мікроорганізм, що проник в плевральну порожнину.
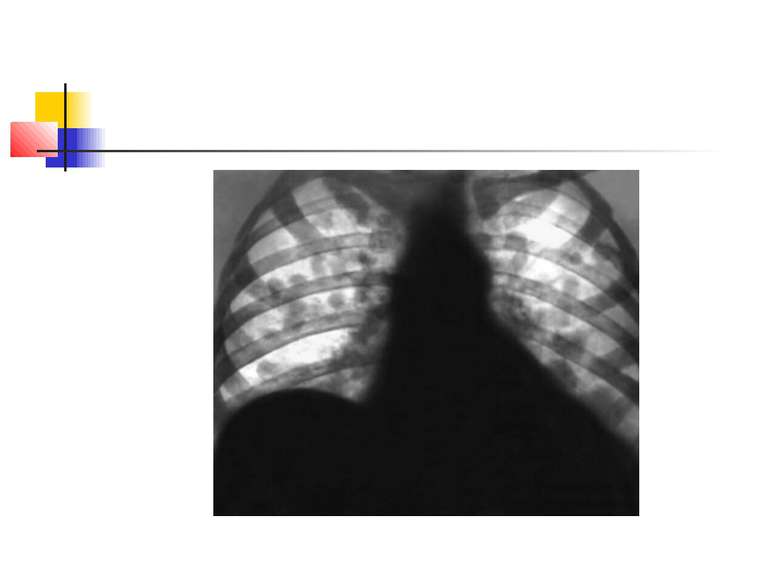
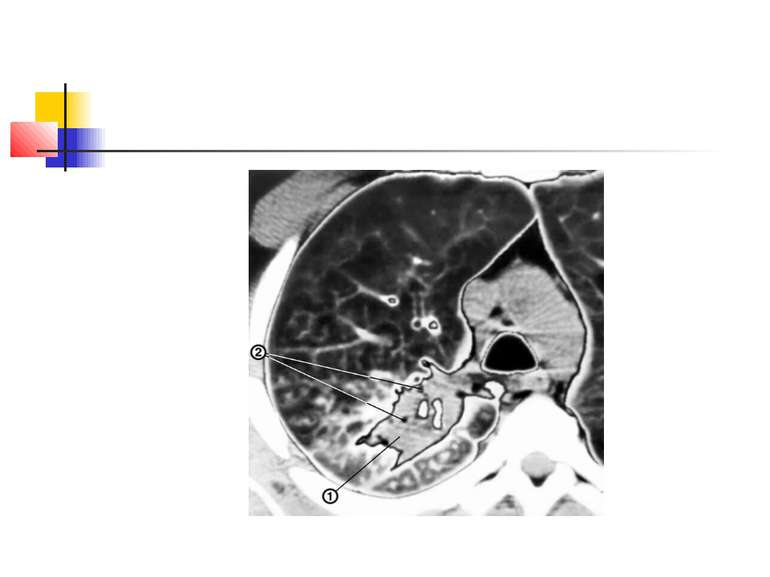
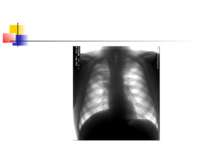
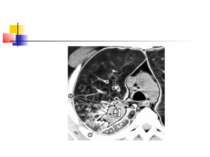
Для емпієми плеври характерна типова рентгенологічна картина (мал. 5), яка, проте, виявляється при поширенному ураженню. Чутливішим методом є комп'ютерна томографія.
Відмінними ознаками інфікованого плеврального випоту від неінфікованого ексудату є: Гнійний характер ексудату: підвищена кількість лейкоцитів (більше 15 000 в 1 мл) з переважанням нейтрофілів; вміст глюкози менше 40 г/л, при неінфікованому ексудаті - 40-60 г/л; рН
Найбільш важливими для прогнозу і визначення тактики ведення хворого є рН плеврального випоту і мікроскопія забарвленого препарату. При значеннях рН
Враховуючи серйозний прогноз при емпіємі плеври, доцільно проводити діагностичну плевральну пункцію у всіх хворих пневмонією, ускладненою значущим плевральним выпотом.
Це дослідження обов'язково при підозрі на інфікування плеврального випоту і емпієму. При проведенні плевральної пункції необхідно відібрати вміст в три пробірки: 1) для клініко-біохімічного дослідження і мікроскопії забарвленого препарату; 2) у стерильну пробірку для мікробіологічного дослідження; 3) для дослідження на мікобактерії.
Діагностична плевральна пункція 1-а пробірка Клинико-біохімічне дослідження і мікроскопія забарвленого препарату: рН Білок ЛДГ Глюкоза Лейкоцити
2-а пробірка Мікробіологічне дослідження Посів на середовища Виділення чистої культури Визначення чутливості
3-а пробірка Дослідження на мікобактерії Культуральний метод або полімеразна ланцюгова реакція
Клінічні ознаки, що дозволяють запідозрити інфікування плеврального випоту при позалікарняній пневмонії:
Збереження лихоманки >38°С або рецидив лихоманки на фоні антибіотикотерапії Поява або посилення болю в грудній клітці при диханні Посилення задишки Лейкоцитоз Збільшення зони притуплення при перкуссии Поява анемії
Антибактеріальна терапія емпієми плеври представляє значні складнощі. Слід підкреслити, що антибіотики мають визначальне значення тільки на ранніх етапах розвитку цього ускладнення, в подальшому тільки своєчасний комплексний підхід до лікування може дати позитивний ефект: дренаж + хірургічні лікування + антибіотики + фібринолітична терапія.
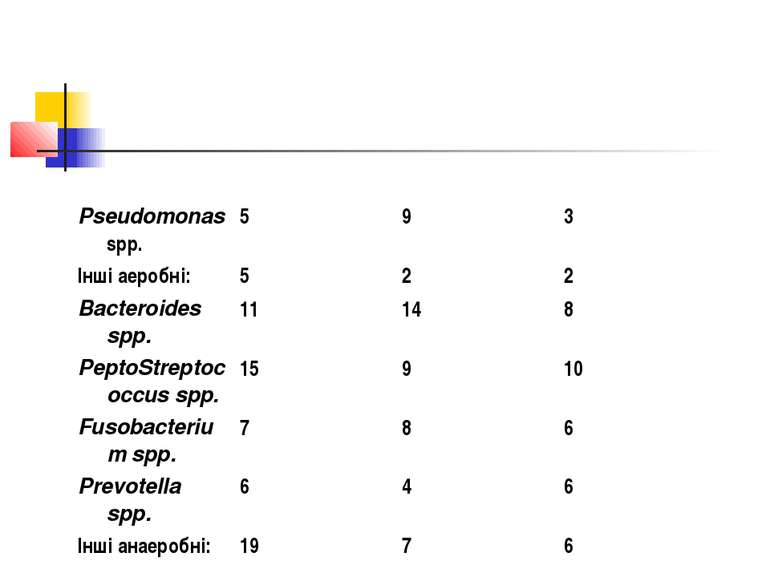
Адекватною антибактеріальна терапія емпієми може вважатися в тому випадку, якщо призначений препарат(и) володіють надійною активністю відносно всіх груп основних збудників захворювання: S.aureus + S.pneumoniae + Enterobacteriaceae + Bacteroides spp. + PeptoStreptococcus spp. + Fusobacterium spp.
З цих позицій найбільш надійні в режимі монотерапії карбапенеми і інгібіторозахищені антипсевдомонадні пеніциліни, проте рівень резистентності грамнегативних бактерій до останніх препаратів останніми роками істотно збільшився.
Потенційно високоефективні також цефалоспорини III-IV покоління і фторхінолони, проте всі вони вимагають поєднаного призначення з кліндаміцином (табл. 7). Як і при абсцесі легені, ефективність аміноглікозидних антибіотиків викликає обгрунтовані сумніви.
Слід зазначити, що переконливих даних по ефективності введення антибактеріальних препаратів в плевральну порожнину немає, і місцеве застосування антибіотиків не має переваг в порівнянні з їх системним призначенням.
Література G, Caglar M et al. Fatal necrotizing pneumonia caused by group A Streptococcus. J Paediatr Child Health 2004; 40 (1-2): 69-71. 2. Finegold SM. Lung abscess. In: Principles and Practice of infectious diseases. Ed. By G.Mandell, J.Bennett, R.Dolin. 5th Edition. Churchill Livingstone, USA. 2000; 751-5. 3. Hacimustafaoglu M, Celebi S, Sarimehmet H et al. Necrotizing pneumonia in children. Acta Paediatr 2004; 93 (9): 1172-7. 4. Bartlett JG, Gorbach SL. Theatment of aspiration pneumonia and primary lung abscess with penicillin G vs clindamycin. JAMA 1975; 234 (9): 935-7. 5. Jacobson SJ, Griffiths K, Diamond S et al. A randomized controlled trial of penicillin vs clindamycin for the treatment of aspiration pneumonia in children. Arch Pediatr Adolesc Med 1997; 151 (7): 701-4. 6. Brook I. Antimicrobial drugs in the management of anaerobic infections in children. Drugs 1983; 26 (6): 520-9. 7. Levison ME, Mangura CT, Lorber B et al. Clindamycin compared with penicillin for the treatment of anaerobic lung abscess. Ann Intern Med 1983; 98 (4): 466-71. 8. Gudiol F, Manresa F, Pallares R et al. Clindamycin vs penicillin for anaerobic lung infections. High level of penicillin failures associated with penicillin-resistant Bacteroides melaninogenicus. Arch Intern Med 1990; 150 (12): 2525-9. 9. Koeth LM, Good CE, Appelbaum PC et al. Surveillance of susceptibility patterns in 1297 European and US anaerobic and carnophilic isolates to co-amoxiclav and five other antimicrobial agents. J Antimicrob Chemother 2004; 53 (6): 1039-44. 10. Behra-Miellet J, Calvet L, Dubreuil L. Activity of linezolid against anaerobic bacteria. Int J Antimicrob Agents 2003; 22 (1): 28-34. 11. Oteo-Iglesias J, Alos JI, Gomez-Garces JL. Increase in resistance to new fluoroquinolones from 1998 to 2001 in the Bacteroides fragilis group. J Antimicrob Chemother 2002; 50 (6): 1055-7.
ГОСПІТАЛЬНА ПНЕВМОНІЯ Захворювання, що характеризується появою на рентгенограмі нових вогнищ вогнищево-інфільтративних змін в легенях через 48 годин і більше після госпіталізації в поєднанні з клінічною симптоматикою, яка підтверджує їх інфекційну природу (нова хвиля лихоманки, гнійне харкотиння або гнійне виділення із трахеобронхіального дерева, лейкоцитоз та ін.), при виключенні інфекцій, що знаходилися в інкубаційному періоді на момент надходження хворого до стаціонару.
ГОСПІТАЛЬНА ПНЕВМОНІЯ Пневмонію, що розвивається до 5го дня госпіталізації вважають ранньою, після 5го – пізньою. Вентилятор-асоційована пневмонія – це особливий тип госпітальної пневмонії, що розвивається через 48 і більше годин після проведення штучної вентиляції легень і є частим ускладненням цього виду терапії.
летальність від гп коливається від 10% до 30%, а серед хворих, які перебувають на ШВЛ, може сягати 70%.
СПЕКТР ПОТЕНЦІЙНИХ ЗБУДНИКІВ ПРИ РАННІХ І ПІЗНІХ ГОСПІТАЛЬНИХ ПНЕВМОНІЯХ Основні збудники ранніх ГП, % Основні збудники пізніх ГП, % Str. Pneumoniae 20-40 P. aeruginosa 20-50 Enterobacteriaceae 10-30 Enterobacteriaceaпродуценти (ESBL) 15-50 H.influenzae 10-30 Acinetobacter spp. 10-35 S. aureus (MSSA) 10-25 S. Aureus (MRSA) 20-30
СПЕКТР ПОТЕНЦІЙНИХ ЗБУДНИКІВ ПРИ РАННІХ І ПІЗНІХ ГОСПІТАЛЬНИХ ПНЕВМОНІЯХ (О.Я.Дзюблик, 2006). До 4% випадків ГП пов”язують із легіонельозною інфекцією. Масові спалахи “хвороби легіонерів” у госпіталях зазвичай спричинені контамінацією систем водопостачання та кондиціювання. Крім того, епідемічні спалахи можуть зумовлювати Acinetobacter spp., S. Aureus, P. Aeruginosa, Serratia spp., представники родини Enterobacteriaceae, Aspergillus spp., віруси та ін.
Модифікуючі чинники, які асоціюють з великою ймовірністю участі антибіотикорезистент-них штамів S. Pneumoniae є:
Модифікуючі чинники вік понад 65 років; терапія β-лактамами протягом останніх 3 міс; алкоголізм; імунодефіцитний стан (у тому числі лікування системними ГКС); супутні захворювання внутрішніх органів.
Модифікуючі чинники S.Aureus найчастіше виявляють у хворих із : черепно-мозковою травмою; цукровим діабетом; хронічною нирковою недостатністю; у разі тривалої катетеризації судин; після вірусної інфекції (грипу).
Модифікуючі чинники Появу грамнегативних ентеробактерій можуть зумовити: cерцево-судинні та бронхолегеневі захворювання; антибактеріальна терапія; перебування у стаціонарі або будинку престарілих.
Модифікуючі чинники Анаеробні збудники найхарактерніші у хворих у разі: аспірації вмісту шлунку (кома, черепно-мозкова травма, алкоголізм); проведення оперативних втручань на органах черевної порожнини.
Модифікуючі чинники Етіологічна значущість P.aeruginosa значно зростає у разі: перебування хворого на ШВЛ; тривалого лікування ГКС; терапія антибіотиками широкого спектру дії понад 7 днів протягом останнього місяця; виснаження; “структурних” захворювань легень (наприклад бронхоектазів, муковісцидозу).
ФАКТОРИ РИЗИКУ РОЗВИТКУ ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ (Т.О.Перцева, 2002) Зумовлені медичним впливом Зумовлені особливостями захворювання Індивідуальні особливості Перебування на ШВЛ Регургітація зі шлунку Нерухомість Тривала госпіталізація Важкість вихідного захворювання Похилий вік Неадекватна обробка рук персоналу, засобів догляду і дихальної апаратури Цукровий діабет Погане харчування Порушення правил техніки лікувальних і діагностичних маніпуляцій, хірургічні втручання Паління Трахеостомія Попередня антибактеріальна, антацидна терапія Терапія кортикостероїдами
ПАТОГЕНЕЗ ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ: порушення імунного статусу; ферментативні взаємодії мікро- і макроорганізму;
ПАТОГЕНЕЗ ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ: порушення неспецифічних захисних функцій бронхолегеневого бар’єру; фізичне ушкодження епітелію дихальних шляхів при діагностичних і лікувальних маніпуляціях; масивна інфікувальна доза збудників і/або їх підвищена вірулентність.
Основні шляхи проникнення інфекційного агента в нижні відділи дихальних шляхів: аспірація секрету ротоглотки; аспірація нестирильного вмісту стравоходу/шлунка; вдихання аерозолю, що містить мікроорганізми; гематогенне поширення з позалегеневого вогнища інфекції; безпосереднє поширення інфекції із сусідніх уражених тканин або внаслідок інфікування у разі проникних поранень грудної клітки.
Чинники ризику розвитку госпітальної пневмонії пов”язані зі станом макроорганізму (вік, ступінь тяжкості перебігу основного захворювання, наявність супутньої патології тощо );
Чинники ризику розвитку госпітальної пневмонії, які підвищують ризик колонізації ротоглотки та шлунку ( перебування у ВРІТ, застосування антибіотиків, антацидів, неадикватне виконання лікувальних і діагностичних маніпуляцій, неадикватна обробка рук персоналу та дихальної апаратури тощо).
Чинники ризику розвитку госпітальної пневмонії зумовлені рефлюксом та аспірацією стравохідного та шлункового вмісту (проведення ШВЛ, трахеостомія встановлення назогастрального зонда, тривале вимушене горизонтальне положення хворого на спині).
Чинники ризику розвитку госпітальної пневмонії, що перешкоджають нормальному відходженню мокротиння (інтубація трахеї, застосування наркотичних аналгетиків, тривала імобілізація).
ДІАГНОСТИЧНИЙ СКРИНІНГ ОБСТЕЖЕННЯ ХВОРОГО З ПІДОЗРОЮ НА ГОСПІТАЛЬНУ ПНЕВМОНІЮ (С.В.Яковлєв, 2004) Діагностичні методи Показники Рентгенологічне обстеження Рентгенографія легень в двох проекціях Мікробіологічне дослідження мокротиння Забарвлення по Граму та мікроскопія, культуральне дослідження з кількісною оцінкою виділеного збудника Гемокультура Забір крові з периферичної вени в два флакони (аероби + анаероби) Клінічний аналіз крові Гемоглобін, гематокрит, лейкоцити, формула крові, тромбоцити Біохімічний аналіз крові Сечовина, креатинін, електроліти Кислотно-лужний стан рН, РО2, РСО2
ДІАГНОСТИЧНІ КРИТЕРІЇ ГП ТЕМПЕРАТУРА ТІЛА ВИЩЕ 38,3с. БРОНХІАЛЬНА ГІПЕРСЕКРЕЦІЯ. PaO2/FiO2 (FiO2 – фракція кисню у повітрі, що видихається, в %) менше 240; Кашель, тахіпное, локальна крепітація, вологі хрипи, бронхіальне диханнч; Кількість лейкоцитів у крові менше 4*10 *9/л або більше 12*10*9/л, палочкоядерний зсув більше 10%. Гнійне мокротиння.
КРИТЕРІЇ ВАЖКОГО ПЕРЕБІГУ ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ (С.В.Яковлєв, 2006) госпіталізація у відділення реанімації та інтенсивної терапії; ШВЛ; виражена дихальна недостатність (частота дихання > 30 / хв);
КРИТЕРІЇ ВАЖКОГО ПЕРЕБІГУ ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ (С.В.Яковлєв, 2006) поліорганна недостатність; потреба у введенні вазопресорів більше чотирьох годин; діурез менше 20 мл/год або менше 80 мл / 4 год без введення діуретиків; гостра ниркова недостатність.
КРИТЕРІЇ ВАЖКОГО ПЕРЕБІГУ ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ (С.В.Яковлєв, 2006) швидка від’ємна динаміка при рентгенологічному обстеженні легень; мультилобарне ураження або абсцедування; клінічні ознаки важкого сепсису з гіпотензією (систолічний АТ < 90 мм рт.ст., діастолічний АТ < 60 мм рт.ст.);
При проведенні антибактеріальної терапії хворих на ГП використовують два проинципи: ексалації та деексалації. Перший принцип передбачає призначення антибактеріальних препаратів з вузьким спектром дії з подальшим розширенням в разі неефективності терапії ; другий – призначення антибіотиків широкого спектру дії, а після ідентифікації збудника та визначення його чутливості заміну препарату на антибіотик вузького спектру дії.
Емперічна антибактеріальна терапія хворих на “ранню” госпітальну пневмонію без чинників ризику наявності полірезистентних штамів збудників (О.Я.Дзюблик, 2006)
АНТИМІКРОБНІ ПРЕПАРАТИ ДЛЯ ЛІКУВАННЯ ХВОРИХ НА ГОСПІТАЛЬНУ ПНЕВМОНІЮ ВСТАНОВЛЕНОЇ ЕТІОЛОГІЇ (О.Я.Дзюблик, 2006)
АНТИМІКРОБНІ ПРЕПАРАТИ ДЛЯ ЛІКУВАННЯ ХВОРИХ НА ГОСПІТАЛЬНУ ПНЕВМОНІЮ ВСТАНОВЛЕНОЇ ЕТІОЛОГІЇ (О.Я.Дзюблик, 2006)
АНТИМІКРОБНІ ПРЕПАРАТИ ДЛЯ ЛІКУВАННЯ ХВОРИХ НА ГОСПІТАЛЬНУ ПНЕВМОНІЮ ВСТАНОВЛЕНОЇ ЕТІОЛОГІЇ (О.Я.Дзюблик, 2006)
АНТИМІКРОБНІ ПРЕПАРАТИ ДЛЯ ЛІКУВАННЯ ХВОРИХ НА ГОСПІТАЛЬНУ ПНЕВМОНІЮ ВСТАНОВЛЕНОЇ ЕТІОЛОГІЇ Традиційна тривалість антибіотикотерапії хворих на ГП складає 14-21 день. Збільшення тривалості призводить до суперінфекції полірезистентними збудниками (P.aeruginosa,Enterobacteriaceae spp.). При ВАП значне клінічне поліпшення спостерігається протягом перших 6 діб, а збільшення її тривалості до 14 днів призводить до колонізації P.aeruginosa та Enterobacteriaceae spp.
ЛІКУВАННЯ ВАП В реанімаційних відділеннях багатопрофільних лікарень кожен третій хворий, а при черепно-мозкових травмах – кожен другий, потребують респіраторної підтримки. При цьому значно зростає ризик ВАП, що характеризується високою летальністю. Відповідно до рекомендацій Американського торакального товариства та Товариства інфекційних захворювань (2005) схема емпіричної терапії ВАП поряд з використанням відомих антибактеріальних засобів передбачає використання лінезоліду.
ЛІКУВАННЯ ВАП Використання Зивоксу – єдиного з представників цього класу антибіотиків, виправдано при нозокоміальній пневмонії, інфекції шкіри та м′яких тканин, ентерококових інфекціях, викликаних резистентними до ванкоміцину штамами E. Faecalis та E.faecium.
ЛІКУВАННЯ ВАП В останній час розширені покази до використання Зивоксу: він знаходить примінення при бактеріемії в хворих з імуносупрессивними станами, абдомінальними інфекціями, нейтропенічною лихоманкою, антибіотикасоційованою діареєю. Зивокс активний супроти всіх клінічнозначущих грампозитивних збудників, в т.ч. метицилін- та ванкоміцинрезистентних інфекціях.
Шляхи введення антибіотиків Ефективним вважається призначення β-лактамних антибіотиків методом постійної внутрішньовенної інфузії. Напочатку лікування більшості хворих на ГП антибіотики призначаються внутрішньовенно. Надалі в пацієнтів із клінічною ефективністю терапії та без порушень функції травного тракту слід перейти на пероральне застосування препаратів.
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Навчання персоналу правилам догляду за хворими з порушенною свідомістю й бульбарними розладами; за пацієнтами, які одержують респіраторну підтримку, небулайзерну терапію чи ентеральне харчування.
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Переривання шляхів інфікування, що включає: використання одноразового стерильного матеріалу, який контактує з дихальними шляхами пацієнта; щоденну стерилізацію небулайзера; зміну зволоджувача при його контамінації;
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ своєчасне видалення конденсату з дихального контуру; використання стерильного розчину для небулайзерної терапії, зволодження повітря та ін.;
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ стерилізацію багаторазового дихального контуру перед його використанням для нового пацієнта; ретельну аспірацію секрету з надманжеткового простору з промиванням катетеру лише стерильним розчином; зміну ємності для забору аспірату перед використанням у іншого пацієнта.
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Запобігання переносу бактерій медичним персоналом: вірна організація процесу обробки рук;
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ зміна рукавичок до початку роботи з новим хворим; виявлення та санація носіїв MRSA серед персоналу лікувальної установи; ізоляція пацієнтів з інфекційними захворюваннями й організація допомоги у ВРІТ за принципом “один пацієнт – одна медична сестра”. Ця тактика особливо виправдана при інфекціях, спричинених полірезистентними штамами бактерій, особливо MRSA.
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Обмеження використання супутніх лікрських засобів, що зумовлюють підвищення ризику ендогенного інфікування.
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Ризик інфікування нижніх дихальних шляхів мікрофлорою ротоглотки й травного тракту збільшується при порушенні свідомості, пригніченні кашльового рефлексу, підвищенні рН шлунку. Раціональне використання снодійних і седативних засобів, наркотичних аналгетиків, міорелаксантів, антацидів значно знижує частоту ГП за рахунок обмеження транслокації мікрофлори в дихальні шляхи.
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Епідеміологічний контроль полягає в спостереженні за пацієнтами групи ризику розвитку нозокоміальної інфекції;обліку поширеності цих інфекцій; аналізі етіологічної структури збудників; характеру й рівня антибіотикорезистентності.
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Селективна деконтамінація ротоглотки й травного тракту. Класична схема селектитвної деконтамінації (СДК) травного тракту базується на поєднанні ентерального призначення антибіотиків, що не абсорбуються, з амфотерицином В, обробки ротоглотки 2% пастою, що містить ці препарати, а також парентерального введення антибіотиків широкого спектру дії.
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ СДК рекомендована окремій категорії хірургічних хворих із високим ризиком розвитку ВАП, але потенційно зворотним основним патологічним процесом (наприклад з політравмою, ізольованою черепно-мозковою травмою, абдомінальним сепсисом). Використання СДК як обов′язкового стандарту не виправдано з економічної точки зору та з позицій епідеміологічних наслідків.
ПРОФІЛАКТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ Профілактичне призначення антибактеріальних препаратів. На сьогодні не існує аргументованих доказів ефективності призначення антибактеріальних засобів із метою профілактики ГП у пацієнтів з факторами ризику, в т.ч. у тих, хто перебуває на ШВЛ. У зв′язку з відсутністю доказів, отриманих у контрольованих дослідженнях недоцільно використовувати в терапії хворих на ГП імуномодулятори, інгібітори протеаз, синтетичні ендорфіни, актовегін, цитохром, імуноглобуліни.
ТИПОВІ ПОМИЛКИ ВЕДЕННЯ ХВОРИХ НА ГОСПІТАЛЬНУ ПНЕВМОНІЮ (О.Я.Дзюблик, 2006) ПОМИЛКА КОМЕНТАР Призначення препаратів для ерадикації етіологічно незначущих мікроорганізмів S.epidermaticus i Enterococcus spp. Не є збудниками ГП Призначення препаратів з антианаеробною активністю Роль анаеробів у розвитку ГП не визначена
ТИПОВІ ПОМИЛКИ ВЕДЕННЯ ХВОРИХ НА ГОСПІТАЛЬНУ ПНЕВМОНІЮ (О.Я.Дзюблик, 2006) Під час вибору режиму дозування препарату Призначення ципрофлоксацину в низьких дозах Ципрофлоксацин слід призначати в дозах не менше ніж 800-1200 мг/добу Низька доза антибіотику у випадку ГП, спричиненої P.aeruginosa Призначати рекомендований режим дозування антибіотика
ТИПОВІ ПОМИЛКИ ВЕДЕННЯ ХВОРИХ НА ГОСПІТАЛЬНУ ПНЕВМОНІЮ (О.Я.Дзюблик, 2006) Під час визначення тривалості терапії Невиправдено часта зміна антибіотиків у процесі лікуванняя Показами для зміни лікування є: відсутність ефективності протягом 72 годин; розвиток серйозних побічних ефектів; зміна збудника ГП Продовження антибіотикотерапії до нормалізації клініко-рентгенологічних і лабораторних ознак ГП Основний критерій відміни антибіотиків – зворотний розвиток комплексу клінічних симптомів, який передбачає регрес ознак дихальної недостатності
АСПІРАЦІЙНІ ПНЕВМОНІЇ (можуть бути як внутрішньогоспітальні, так і негоспітальні) пов’язані з аеробними й анаеробними сапрофітними мікроорганізмами, а також їх комбінацією з іншими аеробними мікроорганізмами (грамнегативними ентеробактеріями, Staphylococcos aureus, Hemophilus influenzae). Ці збудники викликають важкий перебіг пневмонії з раннім виникненням деструкції легеневової тканини (абсцес, гангренозний абсцес).
АСПІРАЦІЙНІ ПНЕВМОНІЇ Високий ризик розвитку аспіраційної пневмонії існує у хворих на хронічний алкоголізм, наркоманів, при цукровому діабеті, неврологічних захворюваннях.
Лікування Враховуючи сучасні дані про чутливість анаеробів, препаратами вибору для лікування інфекції із підтвердженою/передбачуваною наявністю анаеробів є: карбапенеми (іміпінем, меропенем, ертапенем), нітроімідазоли (метронідазол, орнідазол), інгібіторзахищені бета-лактами (амоксицилін/клавуланат, амоксицилін/сульбактам, цефаперазон/сульбактам). Перспективними препаратами для монотерапії є фторхінолони IV покоління (гатифлоксацин).
Вогнищеві кандидозні П., як правило, зливні, займають одну або дві долі.Дебют захворювання поступовий. Лихоманка може бути гектичною, субфебрильною або неправильного типу, зберігається тривало. Мокрота мізерна, в'язка, іноді з домішками крові.
Грибкові пневмонії Первинні грибкові П. зустрічаються рідко. Частіше їх викликають грибки Candida і Aspergilius. Ураження легенів грибками Candida може бути вогнищевим або інтерстиціальним.
Пневмонії, викликані грибками, в т.ч. кандидоз легені, відрізняються від бактерійних тривалішою течією і можливістю утворення інфекційних гранульом.
Фізикальні зміни різноманітні, іноді відсутні. Перебіг пневмонії рецидивуючий з міграцією пневмонічних фокусів. Захворювання супроводжується обструктивним синдромом, ускладнюється серозним або геморагічним плевритом.
Аспергільозна пневмонія починається гостро, іноді з перших днів виявляється абсцедування. Характерні висока лихоманка, біль в боці, кашель з кров'яною мокротою. Стан хворого дуже важкий, відмічається схуднення, анемія.
Оскільки мікози є інфекційними хворобами, основним є їх етіотропне лікування. Елімінація збудника приводить до зникнення всіх симптомів.
Протигрибкові препарати за хімічним складом можна поділити на такі основні групи: • Похідні азолів: – імідазолу (кетоконазол, клотримазол, еконазол, міконазол, біфоназол); – триазолу (флуконазол, ітраконазол, терконазол). • Похідні аліламінів (нафтифін, тербінафін). • Протигрибкові антибіотики (ністатин, грізеофульвін, амфотерицин В, натаміцин). • Похідні міристаміну (мірамістин). • Похідні карбамотіоату (толциклат, толнафтат). • Похідні ундециленової кислоти (мікосептин). • 5-фторцитозин (флуцитозин). • Морфоліни (аморфолін).
Пневмоцистна пневмонія є типовою опортуністичною інфекцією. Препаратом першої лінії терапії при ній вважається бактрим, альтернативними препаратами – пентамідин, кліндаміцин в комбінації з прімаквіном, дапсон в комбінації з тиметопримом, атоваквон і триметриксат в комбінації з фоліновою кослотою. В той же час до теперішнього часу немає достатніх відомостей про ефективність і перевагу цих препаратів.
Групою вчених з Данії, Великобританії і Італії проведений систематичний огляд окремих доклінічних випадків і досліджень в цій області. Всього було проаналізовано 1188 випадків терапії пневмоцистної пневмонії у 1122 ВІЛ-ІНФІКОВАНИХ ХВОРИХ.
В більшості випадків при лікуванні мала місце заміна бактрима на внутрішньовенний пентамідин. Іншими послідовно використаними препаратами були пентамідин > бактрим, дапсон > пентамідин, пентамідин > клиндаміцин/ примаквін, бактрим > атоваквон та інші
Позитивна відповідь на терапію другої лінії найчастіше наголошувалася при заміні первинного препарату на бактрим і на кліндаміцин/ примаквін (у 73 і 68% випадків відповідно).
Значно рідше успіх досягався при заміні первинного препарату на пентамідин (44% випадків). Вірогідність позитивного терапевтичного ефекту для бактрима склала 2,1, для клиндаміцину/примаквину – 2,7, для пентамідину – 0,8 і для атоваквону – 1,2.
Було встановлено, що комбінація кліндамицину і примаквіну значно ефективніше за пентамідин при терапії, що вимагає зміни препарату. Бактрим залишається препаратом вибору в лікуванні пневмоцистної пневмонії у при його первинному і при подальшому призначенні, окрім випадків його непереносимості пацієнтом.
Діагностика, терапія і вакцинопрофілактика пневмоній у дітей Важливим вважається поділ пневмоній у дітей на нелікарняні (тобто такі, що виникають у звичайних умовах життя дитини) та внутрішньолікарняні. Відрізняються від них і пневмонії немовлят .
Діагностика, терапія і вакцинопрофілактика пневмоній у дітей До останнього часу, до появи "атипової" пневмонії при SARS, розрізняли типові й атипові пневмонії. До перших, викликаних"типовою" кокковою або грамвід′ємною (у т.ч. кишковою) флорою, відносили пневмонії з вогнищеми, гомогенного виду змінами або інфільтратоми на рентгенограмі. Інші, викликані "атиповими збудниками" (микоплазмою і хламідіями), проявляються негомогенними, без чітких меж, інфільтратами. Ці розходження важливі для діагностики, які б терміни для них у майбутньому не використовували.
Діагностика, терапія і вакцинопрофілактика пневмоній у дітей Діагностика пневмонії у дітей утруднена відносною рідкістю класичних патогномонічних ознак, що описуються у підручниках. Лихоманка, задишка, кашель, хрипи в легенях з великою частотою зустрічаються і при інших ГРІ. Запідозрити пневмонію допомагає наявність хоча б однієї з ознак, що мають високу специфічність і чутливість( 95% ): температура вище 38,0° тривалістю до 3 днів; задишка (>60 у 1 хв у дітей до 2 міс., >50 у віці 2-12 міс. і >40 у дітей 1-5 років) при відсутності ознак бронхіальної обструкції; локальні хрипи і/або укорочення перкуторного звуку; асиметрія вологих хрипів.
Діагностика, терапія і вакцинопрофілактика пневмоній у дітей Ці ознаки використовуються ВООЗ у програмах з діагностики та лікування ГРВІ.
Діагностика, терапія і вакцинопрофілактика пневмоній у дітей Важливим вважається поділ пневмоній у дітей на нелікарняні (тобто такі, що виникають у звичайних умовах життя дитини) та внутрішньолікарняні. Відрізняються від них і пневмонії немовлят .
Діагностика, терапія і вакцинопрофілактика пневмоній у дітей До останнього часу, до появи "атипової" пневмонії при SARS, розрізняли типові й атипові пневмонії. До перших, викликаних"типовою" кокковою або грамвід′ємною (у т.ч. кишковою) флорою, відносили пневмонії з вогнищеми, гомогенного виду змінами або інфільтратоми на рентгенограмі. Інші, викликані "атиповими збудниками" (микоплазмою і хламідіями), проявляються негомогенними, без чітких меж, інфільтратами. Ці розходження важливі для діагностики, які б терміни для них у майбутньому не використовували.
Діагностика, терапія і вакцинопрофілактика пневмоній у дітей Діагностика пневмонії у дітей утруднена відносною рідкістю класичних патогномонічних ознак, що описуються у підручниках. Лихоманка, задишка, кашель, хрипи в легенях з великою частотою зустрічаються і при інших ГРІ. Запідозрити пневмонію допомагає наявність хоча б однієї з ознак, що мають високу специфічність і чутливість( 95% ): температура вище 38,0° тривалістю до 3 днів; задишка (>60 у 1 хв у дітей до 2 міс., >50 у віці 2-12 міс. і >40 у дітей 1-5 років) при відсутності ознак бронхіальної обструкції; локальні хрипи і/або укорочення перкуторного звуку; асиметрія вологих хрипів.
Діагностика, терапія і вакцинопрофілактика пневмоній у дітей Ці ознаки використовуються ВООЗ у програмах з діагностики та лікування ГРВІ.
Нелікарняні пневмонії. Пневмонії, викликані пневмококами і Haemophilus influenzae типу b, зустрічаються в 10%, звичайно в результаті контакту з хворим на ГРВІ, старшим сібсом або дорослим членом родини.
Нелікарняні пневмонії. У дітей 1-6 місяців переважають атипові форми (20% і більше), викликані Chl. trachomatis, якими вони інфікуються перинатально. У недоношених, як можливий етіопатоген, розглядається Pneumocystis carinii. Часто пневмонії можна пов′взати із звичною аспірацією їжі,а у 5-10% - з першою маніфестацією муковісцидозу або первинного імунодефіциту. Серед збудників переважає грамвід′ємна кишкова флора, стафілококи, рідше - Moraxella catarrhalis.
Нелікарняні пневмонії У дітей віком від 6 міс. до 6 років домінують пневмококи (біля половини усіх нелікарняних і біля 90% ускладнених пневмоній), рідше - H. influenzae типу b. Стафілококи виявляються рідко. Безкапсульні H. influenzae виявляються в пунктатах легень досить часто, звичайно в поєдннанні з пневмококами, однак їхня роль як самостійного збудника пневмонії до кінця не з′ясована.
Нелікарняні пневмонії Атипові пневмонії, викликані M. pneumoniae, виявляються лише у 10-15% хворих, а Chl. pneumoniae - ще рідше . У дітей віком від 7 до 15 років 35-40% пневмоній викликають пневмококи, рідко - піогенні стрептококи. H. influenzae типу b практично не спостерігається. Частка атипових пневмоній перевищує 50% - з них M. pneumoniae (20-60%) і Chl. pneumoniae (6-24%) .
Госпітальні пневмонії В їх етіології відіграє роль як госпітальна флора, звичайно резистентна до антибіотиків, так і аутофлора хворого, стійкість якої залежить від попереднього антибактеріального лікування . Інфікування Pseudomonas aeruginosa, Serratia sp., анаеробами відбувається при маніпуляціях (катетеризації, бронхоскопії, торакоцентезі).
Чутливість збудників пневмонії до антибіотиків На відміну від багатьох країн, де 20-60% штамів пневмококів набули стійкість до пеніцилінів і цефалоспоринів, 30% до макролідів, а H. influenzae - до ампициллину, в країнах Східної Європи до 95% штамів зберігають чутливість, що дозволяє широко використовувати їх при нелікарняних пневмоніях. Мікоплазми і хламідії залишаються чутливими до макролідів і доксицикліну.
Перші згадки про грип були відмічені багато століть назад - ще в 412 році до н.е. опис грипо-подібного захворювання був зроблений Гіппократом. Також грипо-подібні спалахи були відмічені в 1173 році. Перша задокументована пандемія грипу, що понесла багато життів, трапилася в 1580 році.
Ті ж, хто не помер в перші дні, часто вмирали від ускладнень, викликаних грипом, наприклад, пневмонії. Незвичайною особливістю "іспанки" було те, що вона часто вражала молодих людей (звичайно від грипу в першу чергу страждають діти і немолоді особи).
Сумно відома "Іспанка", викликана вірусом H1N1 відбулася в 1918-1920 рр. Це найсильніша з відомих пандемій, що понесла за найскромнішими підрахунками більше 20 млн. життів. Від "іспанки" серйозно постраждало 20-40% населення земної кулі. Смерть наступала украй швидко. Людина могла бути ще абсолютно здоровою ранком, до полудня захворіти і померти в ночі.
Збудник захворювання, вірус грипу, був відкритий Richard Shope в 1931 році. Вірус грипу А вперше був ідентифікований англійськими вірусологами Smith, Andrews і Laidlaw (National Institute for Medical Research, Лондон) в 1933 році. Трьома роками пізніше Francis виділив вірус грипу В.
У 1940 році було зроблене важливе відкриття - вірус грипу може бути культивований на курячих ембріонах. Завдяки цьому з'явилися нові можливості для вивчення вірусу грипу.
У 1957-1958 рр. трапилася пандемія, яка одержала назву "Азіатський грип", викликана вірусом H2N2. Пандемія почалася в лютому 1957 року на Далекому Сході і швидко розповсюдилася по всьому світу. Тільки в США під час цієї пандемії померло більше 70000 чоловік.
У 1968-1969 рр. відбувся середній по тяжкості "Гонконгзький грип", викликаний вірусом H3N2. Пандемія почалася в Гонконзі на початку 1968 року. Найчастіше від вірусу страждали літні люди старше за 65 літній вік. Всього число загиблих від цієї пандемії склало 33800 чоловік.
У 1977-1978 рр. відбулася відносно легка по ступеню тяжкості пандемія, названа "російським" грипом. Вірус грипу (H1N1), що викликав цю пандемію вже викликав епідемію в 50-х рр. Тому в першу чергу постраждали особи, що народилися після 1950 р.
Вірус грипу (Mixovirus influenzae) належить до сімейства ортоміксовірусів. Він має сферичну структуру і розмір 80-120 нанометрів.
Лабораторна діагностика респіраторних вирусів Экспресс-методы Классические вирусологические методы Серологические методы МФА Выделение вируса на куриных эмбрионах и идентификация в РТГА РТГА ИФА Выделение вируса в культуре клеток и Идентификация в РТГА ИФА ( IgM , Ig G) ИХА (простые/быстрые тесты) РНГА ПЦР-диагностика РСК РНГА РН
Серцевина вірусу містить одноланцюгову негативну РНК, що складається з 8 фрагментів, які кодують 10 вірусних білків. Фрагменти РНК мають загальну білкову оболонку, яка об'єднує їх, утворюючи нуклеопротеїд.
Зовні вірус покритий ліпідною оболонкою. Саме ліпіди відповідають за ту важку інтоксикацію, яка вражає людину під час хвороби.
На поверхні вірусу знаходяться виступи (глікопротеїни) - гемаглютинін (названий по здатності аглютинувати еритроцити) і нейраминідаза (фермент).
Гемаглютинін забезпечує здатність вірусу приєднуватися до клітини. Нейраминідаза відповідає, по-перше, за здатність вірусної частинки проникати в клітину-господаря; по-друге, за здатність вірусних частинок виходити з клітини після розмноження.
Нуклеопротеїд (також званий S-антигеном) постійний по своїй структурі і визначає тип вірусу (А, В або С). Поверхневі антигени (гемаглютинин і нейраминидаза - V-антигени), навпаки, мінливі і визначають різні штами одного типу вірусу.
Вірус грипу А як правило викликає захворювання середньої або сильної тяжкості. Вражає як людину, так і деяких тварин (кінь, свиня, тхір, птахи). Саме віруси грипу А відповідальні за появу пандемій і важких епідемій.
Відома безліч підтипів вірусу типу А, які класифікуються по поверхневих антигенах - гемаглютиніну і нейраминідазі: відомо 16 типів гемаглютиніну і 9 типів нейраминідази. Вірус має видоспецифичність: тобто як правило, вірус птахів не може вражати свиню або людину, і навпаки.
Вірус грипу В Як і вірус грипу А, здатний змінювати свою антигенну структуру. Проте ці процеси виражені менш чітко, чим при грипі типу А.
Віруси типу В не викликають пандемії і звичайно є причиною локальних спалахів і епідемій, що іноді охоплюють одну або декілька країн. Спалахи грипу типу В можуть співпадати з такими грипу типу А або передувати йому. Віруси грипу В циркулюють тільки в людській популяції (частіше викликаючи захворювання у дітей).
Вірус грипу С достатньо мало вивчений. Відомо, що на відміну від вірусів А і В, він містить тільки 7 фрагментів нуклеїнової кислоти і один поверхневий антиген. Інфікує тільки людину. Симптоми хвороби звичайно дуже легкі, або не виявляються взагалі. Він не викликає епідемій і не приводить до серйозних наслідків.
Є причиною спорадичних захворювань, частіше у дітей. Антигенна структура не схильна до таких змін, як у вірусів типу А. Захворювання, викликані вірусом грипу С, часто співпадають з епідемією грипу типу А. Клінічна картина така ж, як при легких і помірно важких формах грипу А.
Специфічність вірусів відносно господарів є властивістю вірусів грипу, що має принципове значення. Ця властивість обумовлена розпізнаванням молекулами гемаглютинину вірусу специфічних рецепторів галактози на клітинах господаря. Скріплення галактози цими рецепторами відрізняється у людини і у птахів. От чому неможливе зараження людини вірусом грипу птахів.
Проте спалах пташиного грипу в Гонконзі в 1997 (коли було відмічене зараження людини від птахів) підтвердив, що в житті бувають виключення з правил. Передбачається, що водоплавні птахи виступають в ролі резервуарів вірусів, оскільки в них виявлені всі відомі серотипы гемаглютинину і нейраминидазы.
Вірус грипу найбільш стійкий при низьких температурах - він збережується при температурі 4° С протягом 2-3 тижнів; прогрівання при температурі 50-60° С викликає інактивацію вірусу протягом декількох хвилин, дія дезинфікуючих розчинів - миттєво.
Міжнародна система кодування вірусів грипу За багато років з'явилася безліч варіантів вірусів як типу А, так і типу В. У зв'язку з цим виникла необхідність їх систематизації з тим, щоб можна було відрізняти один від одного. Була розроблена міжнародна система кодування, завдяки якому кожен варіант одержав свій код, наприклад А/Бангкок/1/79(H3N2):
позначення типу вірусу (А, В або С) = А; географічне місце виділення вірусу = Бангкок порядковий номер виділеного в даному році і в даній лабораторії вируса= 1 рік виділення = (19)79 позначення антигеного підтипу = H3N2 Якщо вірус був виділений у тварини (а не у людини), то після вказівки типу вірусу указується скорочена назва тварини.
Через високу реактогенність цільновиріонних і живих вакцин (здатність викликати важкі фебрильні реакції), вони не рекомендуються для застосування у маленьких дітей. **Інактивовані субодиничні і розщеплені вакцини можуть застосовуватися в будь-яких вікових категоріях від 6 місячного віку. У зв'язку з низькою частотою побічних реакцій і високою імуногенністю, ці вакцини рекомендуються для застосування у всіх вікових групах
Спосіб введення Вакцину вводять внутрішньом'язово або глибоко підшкірно. При внутрішньом'язовому введенні дорослим і підліткам вакцина вводиться в дельтовидний м'яз. Маленьким дітям вакцина вводиться в передньолатеральну верхню частину стегна.
Слід зазначити, що керівництво по імунізації не рекомендує введення вакцин в сідничний м'яз із-за небезпеки травматизації нервових стовбурів і судин. Також з ін'єкцією в сідницю зв'язують зниження рівня імунної відповіді із-за можливості попадання вакцини в глибокі жирові тканини при аномальному їх розташуванні.
Сумісне введення з іншими вакцинами Вакцина проти грипу може спільно використовуватися разом з будь-якими іншими вакцинами. При цьому важливо, щоб вакцини вводилися одночасно в різні ділянки тіла.
Інструкція про застосування ІНФЛУВАК® (INFLUVAC®) міжнародна та хімічна назва: суспензія для ін’єкцій (вакцина проти грипу, поверхневий антиген, інактивована) основні фізико–хімічні властивості: стерильна, прозора водна суспензія поверхневих антигенів вірусу грипу в сольовому розчині з фосфатним буфером;
Склад Інфлуваку® 2007/2008 відповідає рекомендаціям ВООЗ і рішенню Європейського Союзу стосовно складу вакцин проти грипу для сезону 2007/2008 у Північній півкулі.
Одна доза вакцини (0,5 мл) сезону 2007/2008 містить: гемаглютинін вірусних штамів A/Wisconsin/67/2005(H3N2)-подібний (A/Wisconsin/67/2005 NYMCX-161-В рекомб.) 15 мкг A/Solomon Islands/3/2006(H1N1)-подібний (A/Solomon Islands/3/2006 IVR-145 рекомб.) 15 мкг B/Malaysia/2506/2004-подібний (B/Malaysia/2506/2004) 15 мкг нейрамінідазу усіх вірусів,
ІМУНОЛОГІЧНІ І БІОЛОГІЧНІ ВЛАСТИВОСТІ ІМУНОЛОГІЧНІ І БІОЛОГІЧНІ ВЛАСТИВОСТІ: Інфлувак® виробляється з вірусів, що вирощують на курячих ембріонах. Віруси інактивують формальдегідом, після чого деякі з вірусних протеїнів (антигени гемаглютинін і нейрамінідазу) вилучають для створення вакцини. Ці протеїни самостійно неспроможні викликати захворювання
Як і інші вакцини проти грипу, Інфлувак® призводить до утворення в організмі антитіл проти вірусу. Завдяки цьому при контакті з живим вірусом грипу організм спроможний захищати себе, тому що антитіла нейтралізують атакуючий вірус, який потрапляє в організм.
Інкубаційний період грипу становить декілька днів, тож, якщо контакт з вірусом трапився незадовго до щеплення, або одразу після нього, захворювання може статися. Вакцина не захищає від інших респіраторних інфекцій, деякі з котрих можуть мати подібні до грипу симптоми
Серологічний захист звичайно досягається через 2-3 тижні. Тривалість поствакцинального імунітету проти гомологічних штамів або штамів, близьких до штамів вакцини, коливається від 6 до 12 місяців.
Віруси грипу постійно змінюються, тому склад вакцини різних років також може бути різним. Для забезпечення належного захисту проти грипу треба повторювати щеплення кожного року перед початком епідемічного сезону.
ПОКАЗАННЯ ДЛЯ ЗАСТОСУВАННЯ Профілактика грипу; особливо у категорії пацієнтів, що належать до групи підвищеного ризику у зв’язку із можливими ускладненнями. Застосування Інфлуваку ® повинно базуватися на офіційних рекомендаціях.
Вакцинація особливо рекомендована наступним категоріям пацієнтів, в залежності від національних вимог щодо імунізації: - Особам віком ≥ 65 років, незалежно від стану їх здоров’я. - Дорослим та дітям з хронічними захворюваннями дихальної або серцево-судинної систем , включаючи астму.
Дорослим та дітям з хронічними метаболічними захворюваннями, як, наприклад, цукровий діабет. - Дорослим та дітям із хронічними захворюваннями нирок. - Дорослим та дітям із імунодефіцитними станами, що розвинулися внаслідок захворювання або терапії препаратами, що пригнічують імунітет (наприклад, цитостатиками, кортикостероїдами) , променевої терапії
Дітям та підліткам (від 6 місяців до 18 років), що отримують довготривале лікування препаратами , що містять ацетилсаліцилову кислоту, і тому можуть бути віднесені до групи ризику щодо розвитку синдрому Рея на фоні інфікування вірусом грипу.
СПОСІБ ЗАСТОСУВАННЯ І ДОЗИ: Вакцину вводять внутрішньом'язово або глибоко підшкірно. Перед введенням вакцину слід нагріти до кімнатної температури. Безпосередньо перед ін'єкцією шприц треба струсити, зняти захисну кришку з голки і випустити повітря, утримуючи шприц у вертикальному положенні і повільно натискуючи на поршень.
ПОБІЧНІ РЕАКЦІЇ, ЩО СПОСТЕРІГАЛИСЯ ПІД ЧАС ПРОВЕДЕННЯ КЛІНІЧНИХ ДОСЛІДЖЕНЬ головний біль, пітливість, міальгія, артральгія, лихоманка, погане самопочуття, озноб, втома, такі місцеві реакції у ділянці ін’єкції, як почервоніння, набряклість, біль, крововилив, ущільнення. Ці реакції зазвичай зникають через 1-2 дні без лікування.
ПРОТИПОКАЗАННЯ Гіперчутливість до активних речовин та будь-яких інших неактивних компонентів вакцини, курячих яєць, яєчного курячого білку (вміст овальбуміну у Інфлуваку® не перевищує 1 мкг на дозу), формальдегіду, цетилтриметиламонію броміду, полісорбату 80 або гентаміцину. Вакцинація повинна бути відстрочена у пацієнтів з підвищеною температурою або гострим інфекційним захворюванням.
Взаємодія з іншими лікарськими засобами. Інфлувак® можна призначати одночасно з іншими вакцинами, але рекомендовано вводити їх в різні кінцівки. Необхідно звертати увагу на можливе підвищення інтенсивності побічних реакцій.
Після вакцинації проти грипу спостерігалися помилково позитивні реакції при проведенні серологічних тестів з використанням методу ELISA для визначення антитіл проти HIV1, вірусу гепатиту С і особливо HTLV1. Методика Western Blot підтверджує помилковість результатів. Транзиторні помилково позитивні реакції можуть бути наслідком відповіді IgM на вакцину.
Інфлувак® не впливає на здатність керувати транспортними засобами і працювати з машинами і механізмами.
Оптимальним часом для проведення вакцинації проти грипу в Північній півкулі є осінній період - з вересня по листопад.
Епідемії грипу в Північній півкулі доводяться як правило, на період між листопадом і березнем; Час вироблення антитіл займає біля 2-4-х тижнів;
Високий титр антитіл, викликаний щепленням, тримається декілька місяців і починає падати через 6 місяців після вакцинації. Тому дуже завчасна вакцинація не рекомендується (титр антитіл може впасти до моменту почала епідемії).
Якщо з якихось причин вакцинація не була зроблена вчасно, то її можна зробити і після початку епідемії грипу. Широко поширено помилкову думку, що після початку епідемії вакцинація протипоказана.
Це має відношення до живих протигрипозних вакцин. Інактивовані вакцини рекомендуються до застосування впродовж всієї епідемії (CDC, Атланта). Проте, якщо щеплення було зроблене тоді, коли людина була вже інфікована вірусом грипу (але клінічні прояви ще не почалися), то вакцина може виявитися неефективною.
Резолюція IXВсеукраїнської науково-практичної конференції з актуальних питань алергології, клінічної та лабораторної імунології (25-26 квітня 2007).
Вважати вакцинацію проти грипу необхідним засобом для попереджнння епідемії грипу та виникненя пандемічного штаму грипу (Наказ МОЗ України №48 від 03.02.2006). Повідомити медичну спільноту про неналежний рівень вакцинації в нашій країні – Україна на 47 місці серед 56 країн Європи (вакцинується лише 8,5% населення). У 2006-2007 рр. кількість вакцинованих скоротилась удвічі і становила 421.000 осіб.
В Україні зареєстровані сучасні протигрипозні вакцини, серед яких найбільш вивчена, безпечна та ефективна субодинична вакцина в одноразовому шприці Інфлувак, виробництва Солвей Фармацеутікалз БВ, Нідерланди. Вакцина дозволена до застосування у дітей з 6-місячного віку, у 2-му та 3-му триместрах вагітності та в період лактації.
Профілактика лікарськими препаратами Для профілактики грипу на сьогодні існує широкий вибір лікарських засобів. Проте слід зазначити, що ефективність профілактики подібними засобами не має достатньої ефективністі, до того ж переважна більшість препаратів ефективно тільки відносно вірусу грипу А (але не В). На додаток до цього, багато лікарських засобів мають широкий перелік протипоказань і можуть викликати побічні реакції.
Противірусні препарати є препаратами другої лінії для профілактики грипу після вакцинації з наступних причин:
біологічні причини: вакцини індукують утворення антитіл як найбільш ефективні і натуральні антивірусні субстанції;
медичні причини: для гарантованої профілактики грипу протягом епідемії противірусні препарати повинні даватися щодня протягом як мінімум 6 тижнів з ризиком розвитку побічних ефектів; економічні: вартість однієї дози вакцини і шеститижневого прийому дорогого препарату.
Профілактика лікарськими препаратами показана в наступних випадках: Як доповнення до пізньої вакцинації осіб з груп ризику в перші 2 тижні після вакцинації (на період вироблення антитіл);
Профілактика лікарськими препаратами показана в наступних випадках: Для дітей, які вакцинуються вперше - прийом препаратів показаний протягом 6 тижнів після першої вакцинації (остаточне вироблення антитіл закінчується до 2 тижнів після другої вакцинації); Для осіб з імунодефіцитом, які на вакцинацію можуть дати недостатню імунну відповідь. В цьому випадку хворим показана вакцинація, плюс додатковий прийом таких препаратів, як ремантадин (амантадин) або інгібітори нейраминидазы
Для осіб, яким вакцинація проти грипу протипоказана (найчастіше вакцинація протипоказана особам з алергією на курячі яйця). Проте, необхідно мати на увазі, що такі протипоказання трапляються украй рідко (менш, чим 1 на 10000 чоловік);
Для немолодих осіб, для яких ефективність вакцинації знижується і досягає 50-70%, як доповнення до вакцинації; Для невакцинованих осіб, що знаходяться у контакті з хворими родичами і сусідами;
Коли є загроза пандемії (в цьому випадку показаний прийом інгібіторів нейраминідази); У випадку, якщо вакцинний штам не співпав з епідемічним; Для тих, хто з яких-небудь причин не був провакцинирований вчасно.
Вакцинопрофілактика Щеплення проти кору, кошляку і грипу є важливою ланкою профілактики найбільш важкого ускладнення цих захворювань - пневмонії. Інша, поки що мало використовувана в Україні можливість, це вакцинація проти інфекції, викликаної H. influenzae типу b. За даними Південної Америки, масова вакцинація знижує захворюваність на пневмонію майже на 22-26%.
Вакцинопрофілактика В Росії ліцензована пневмококова 23-валентна вакцина ”Пневмо - 23”. Її ефективність у зниженні захворюваності на пневмококову пневмонію доведена для організованих колективів (армія), а також для хворих груп ризику: - при функціональній аспленії,спленектомованих та онкогематологічних хворих; - ВІЛ-інфікованих;
Вакцинопрофілактика - на хронічні захворювання серцево-судинної і дихальної систем; - на діабет;
Вакцинопрофілактика з нефротичним синдромом; -у пацієнтів, що отримують імуносупресивну та гормональну терапію, а також у осіб віком старше 60-65 років, незалежно від інших факторів ризику.
Вакцинопрофілактика Для профілактики пневмококової інфекції у дітей до 2 років створені полівалентні кон′юговані з білком пневмококові вакцини. Використання подібної 7-валентної вакцини знизило захворюваність важкими формами інфекції, включаючи пневмонію, на 80-90% .
Вакцинопрофілактика Застосування кон′югованої вакцини введено в Національний календар щеплень США, Австрії і Великої Британії. Однак використання її у більшості інших країн стримується через високу вартість (250 євро за повну серію з 4 щеплень).
ІНФЛУВАК® (INFLUVAC®) ЗАГАЛЬНА ХАРАКТЕРИСТИКА: міжнародна та хімічна назва: суспензія для ін’єкцій (вакцина проти грипу, поверхневий антиген, інактивована) основні фізико–хімічні властивості: стерильна, прозора водна суспензія поверхневих антигенів вірусу грипу в сольовому розчині з фосфатним буфером;
СКЛАД: Інфлувак® є тривалентною субодиничною інактивованою вакциною проти грипу, до складу якої входять ізольовані поверхневі антигени вірусів грипу типів А і В.
Склад Інфлуваку® 2007/2008 відповідає рекомендаціям ВООЗ і рішенню Європейського Союзу стосовно складу вакцин проти грипу для сезону 2007/2008 у Північній півкулі.
Одна доза вакцини (0,5 мл) сезону 2007/2008 містить: гемаглютинін вірусних штамів A/Wisconsin/67/2005(H3N2)-подібний (A/Wisconsin/67/2005 NYMCX-161-В рекомб.) 15 мкг A/Solomon Islands/3/2006(H1N1)-подібний (A/Solomon Islands/3/2006 IVR-145 рекомб.) 15 мкг B/Malaysia/2506/2004-подібний (B/Malaysia/2506/2004) 15 мкг нейрамінідазу усіх вірусів,
Серологічний захист звичайно досягається через 2-3 тижні. Тривалість поствакцинального імунітету проти гомологічних штамів або штамів, близьких до штамів вакцини, коливається від 6 до 12 місяців.
Віруси грипу постійно змінюються, тому склад вакцини різних років також може бути різним. Для забезпечення належного захисту проти грипу треба повторювати щеплення кожного року перед початком епідемічного сезону.
Вакцинація особливо рекомендована наступним категоріям пацієнтів, в залежності від національних вимог щодо імунізації: Особам віком ≥ 65 років, незалежно від стану їх здоров’я. Дорослим та дітям з хронічними захворюваннями дихальної або серцево-судинної систем , включаючи астму.
Дорослим та дітям з хронічними метаболічними захворюваннями, як, наприклад, цукровий діает Дорослим та дітям із хронічними захворюваннями нирок.
Дорослим та дітям із імунодефіцитними станами, що розвинулися внаслідок захворювання або терапії препаратами, що пригнічують імунітет (наприклад, цитостатиками, кортикостероїдами) , променевої терапії. Дітям та підліткам (від 6 місяців до 18 років), що отримують довготривале лікування препаратами , що містять ацетилсаліцилову кислоту, і тому можуть бути віднесені до групи ризику щодо розвитку синдрому Рея на фоні інфікування вірусом грипу.
СПОСІБ ЗАСТОСУВАННЯ І ДОЗИ: Вакцину вводять внутрішньом'язово або глибоко підшкірно. Перед введенням вакцину слід нагріти до кімнатної температури. Безпосередньо перед ін'єкцією шприц треба струсити, зняти захисну кришку з голки і випустити повітря, утримуючи шприц у вертикальному положенні і повільно натискуючи на поршень
ПОБІЧНІ РЕАКЦІЇ, ЩО СПОСТЕРІГАЛИСЯ ПІД ЧАС ПРОВЕДЕННЯ КЛІНІЧНИХ ДОСЛІДЖЕНЬ: Безпечність тривалентної інактивованої вакцини проти грипу оцінена у відкритих, неконтрольованих клінічних дослідженнях, що проводяться щорічно за вимогою із включенням не менше 50 пацієнтів віком від 18-60 років та не менше 50 пацієнтів похилого віку від 61 року та більше. Оцінка безпечності вакцини проводиться протягом перших 3 днів після вакцинації
Під час проведення клінічних досліджень у деяких пацієнтів спостерігалися наступні побічні ефекти: головний біль, пітливість, міальгія, артральгія, лихоманка, погане самопочуття, озноб, втома, такі місцеві реакції у ділянці ін’єкції, як почервоніння, набряклість, біль, крововилив, ущільнення. Ці реакції зазвичай зникають через 1-2 дні без лікування.
Обмежені дані щодо вакцинації вагітних не вказують на те, що щеплення може мати будь-які небажані наслідки для дитини або матері. Можливість застосування вакцини може бути розглянута, починаючи з другого триместру вагітності. Вагітним жінкам із захворюваннями, які можуть збільшити ризик ускладнень після грипу, рекомендовано проводити щеплення незалежно від терміну вагітності. Інфлувак® можна застосовувати без обмежень у період лактації.
Захворювання легень у вагітних є особливою проблемою. "Вагітна дихає за двох", тому загрозою для плоду є гіпоксія, яка є наслідком ураження легень. Не менш важливою є проблема призначення необхідних фармакологічних препаратів, врахову- ючи ризик та можливість несприятливого впливу на плід.
Переохолодження є провокуючим фактором. Епідемія гри-_ пу сприяє частішому виникненню пневмоній. Однак наявність вірусних пневмоній визнають не всі фахівці. Вважають, що віру-_ си є кондукторами для приєднання бактеріальної та мікоплаз-_ меної флори
Перебіг пневмонії у вагітних частішебільш важкий у зв'яз-_ ку зі зменшенням дихальної поверхні легень, високим стоянням діафрагми навантаженням на серцево-судинну систему
До фізіологічних непульмональних змін, які можуть впливати на розвиток та пе-_ ребіг пневмоній, відносять збільшення швидкості клубочкової фільтрації
Однак перебіг може бути стертим, за відсутності лихоман-_ ки, виражених явищ інтоксикації, патологічних змін у крові. По-_ чаток зазвичай повільний.
Однак може спостерігатись гострий початок хвороби із появи ознобу, лихоманки послаблюючого типу (чергування періодів підвищення та зниження температури_
Хворі скаржаться на кашель із невеликою кількістю слизо-_ во-гнійного мокротиння, загальну слабкість, головний біль. Ди-_ хання помірно прискорене (до 28–30 за хвилину). Зберігається легеневий перкуторний звук чи виявляється притуплення на об-_ меженій ділянці легень.
При аускультації визначається везику-_ лярне дихання із дрібнопухирчастими хрипами, іноді — сухими. Хрипи є непостійними, можуть зникати при глибокому диханні чи після кашлю. Можуть спостерігатися шум тертя плеври та бронхіальне дихання.
Обов'язковими є наступні методи діагностики пневмо нії рентгенографія органів грудної клітини у двох проекціях, яку виконують за найменшої підозри на наявність пневмонії; мікроскопічне дослідження мокротиння (зібраного натще та перед початком антибактеріальної терапії), пофарбованого за Грамом; мікробіологічне культуральне дослідження мокротиння, плеврального випоту, крові; клінічний аналіз крові для виявлення лейкоцитозу та здвигу до незрілих форм.
Діагноз пневмонії є визначеним за наявності у хворої рент-_ генологічно підтвердженої вогнищевої інфільтрації легеневої тканини (її поява або прогресування існуючої) та не менше 2 клінічних ознак із нижченаведених
38° C; — кашель із виділенням мокротиння (при фарбуванні за Грамом вміст нейтрофілів > 25 та епітеліальних клітин < 10 у полі зору при малому збільшенні); —фізикальні ознаки (притуплений або тупий перкуторний
звук, ослаблене або жорстке бронхіальне дихання, фокус дзвінких дрібнопухирцевих хрипів та/або крепітації); лейкоцитоз та/або паличкоядерний зсув; виявлення етіологічно значущого збудника при прове_ денні культурального дослідження.
Слід зауважити, що виконання рентгенограми органів груд_ ної клітки на 3–5 добу захворювання збільшує ризик небажа_ них ускладнень як для вагітної, так і для плоду у зв'язку із зат_ римкою призначення адекватної терапії.
Основні збудники пневмонії у вагітних Перебіг захворювання Збудники Неважкий перебіг S. pneumoniae, M. pneumoniae, C. pneumoniae, H. influenzae Важкий перебіг S. pneumoniae, атипові мікроорганізми, H. іnfluenzae, грамнегативні мікроорганізми Важкі супутні захворювання S. pneumoniae, S. aureus, грамнегативні
Токсичні ефекти антибактеріальних лікарських засобів Термін вагітності Препарати, які здійснюють пошкоджуючу дію на плід Ранні строки (аборт, тератогенна дія) стрептоміцин, сульфонаміди, тетрациклін, рифампіцин Ембріогенез тетрациклін (деформація кісток, зубів);
Токсичні ефекти антибактеріальних лікарських засобів стрептоміцин (ототоксичність), аминоглікозиди (нефротоксичність), левоміцетин (анемія) Пізні строки вагітності, лактація сульфонаміди (ядерна жовтяниця, гемоліз); левоміцетин (анемія); тетрациклін (деформація кісток, зубів); аміноглікозиди (ототоксичність)
Наявність одного або декількох із перерахованих нижче показників свідчить про тяжкий перебіг пневмонії та підвищує ризик розвитку летального кінця: частота дихальних рухів ≥30 за 1 хв.; наявність супутніх захворювань (хронічне обструктивне захворювання легень, бронхіальна астма, цукровий діабет, хронічне захворювання печінки, алкоголізм); порушення свідомості; систолічний артеріальний тиск 38,3 або
Наявність одного або декількох із перерахованих нижче показників свідчить про тяжкий перебіг пневмонії та підвищує ризик розвитку летального кінця: рівень гемоглобину 130 мкмоль/л, pH артеріальнії крові
Антибіотики, що використовуються для лікування пневмонії, активно проникають через плаценту та можуть спричиняти ембріотоксичний ефект, який властивий практично усім представникам цієї групи.
У разі неважких бактеріальних пневмоній, які мають нас-_ тупні прояви: гнійне мокротиння, біль в грудній клітці, слід від-_ давати перевагу лікуванню амінопеніцилінами (амоксицилі-_ ном).
При підозрі на пневмонію, спричинену внутрішньоклітинни-_ ми збудниками, за наявності серед клінічних проявів непродук-_ тивного кашлю, виражених симптомів інтоксикації та задишки, доцільно призначати препарати групи макролідів (азитроміцин, спіраміцин).
За наявності тяжкого перебігу або факторів ризику (алко-_ голізм, цукровий діабет, муковісцидоз, бронхоектатична хво_ роба) препаратами вибору є "захищені" амінопеніциліни (амок-_ сицилін/клавуланова кислота) чи цефалоспорини ІІІ покоління (цефтріаксон) [
Висновки 1. Пневмонія у вагітних не є абсолютним показом для пере_ ривання вагітності. 2. Вагітні хворі на пневмонію потребують госпіталізації та нагляду в умовах стаціонару. 3. Препаратами вибору можуть бути амінопеніциліни (амоксицилін), макроліди (азитроміцин, спіраміцин), "захи_ щені" амінопеніциліни (амоксицилін / клавуланова кислота), цефалоспорини ІІІ покоління (цефтріаксон).
Хронічне легеневе серце Професор кафедри терапії і сімейної медицини Тернопільського державного медичного університету Звершхановський Фелікс Андрійович
Актуальність проблеми хронічного легеневого серця ( ХЛС ) як важкого ускладнення хронічних обструктивних захворювань легень ( ХОЗЛ ) зумовлена неухильним збільшенням захворюваності та смертності від ХОЗЛ. Зокрема, захворюваність на ХОЗЛ за останнє десятиріччя в країнах Північної Європи склала 4–6 %.
Закономірність пошкодження серця при тривалих захворюваннях легень описана в 1838 році Б. Лаенеком. Термін ХЛС запропоновано П. Уайтом в 1935 році. До того часу легеневе серце розглядалося в рамках легенево-серцевої недостатності.
За визначенням Комітету експертів ВООЗ (1961), легеневе серце (cor pulmonale) — це гіпертрофія правого шлуночка на тлі захворювань, перебіг яких супроводжується порушенням структури чи функції легеневої тканини, за винятком випадків, коли зміни в легенях самі є результатом первинного ураження лівих відділів серця чи природжених вад серця або великих кровоносних судин.
Основою для визначення ХЛС є гіпертрофія правого шлуночка, зумовлена підвищенням легенево-судинного опору та розвитком легеневої гіпертензії (ЛГ).
Даний постулат розвинув Б.Є. Вотчал (1962) і запропонував таке визначення: легеневе серце — це патологічний стан, який характеризується гіпертрофією і (або) дилатацією правого шлуночка серця в результаті легеневої гіпертензії, зумовленої первинними захворюваннями бронхолегеневого апарату, судин легень або торакодіафрагмальними порушеннями [1, 3].
ЛЕГЕНЕВА АРТЕРІАЛЬНА ГІПЕРТЕНЗІЯ (ЛАГ) трактується як хвороба малих легеневих артерій, що характеризується судинною проліферацією та ремоделюванням. ЛАГ призводить до прогресуючого збільшення легеневого судинного опору та в результаті – до правошлуночкової недостатності та смерті. ЛАГ - це підвищення середнього тиску у легеневій артерії більше 25 мм рт. ст. в стані спокою або 30 мм рт. ст. при фізичному навантаженні
У 1865 році німецький дослідник Юліус Клоб (Julius Klob) звітував про знахідки при аутопсії пацієнта, що мав прогресуючі набряки, задишку та ціаноз, що в результаті призвело до його смерті у віці 59 років. Замість серцевої патології, Клоб знайшов виражене звуження дрібних гілок легеневої артерії, що були вражені атеросклерозом[3].
історія У 1891 році видатний німецький лікар Ернст фон Ромберґ (Ernst von Romberg) описав схожу клінічну картину у чоловіка 24 років. При аутопсії пацієнта окрім склерозу легеневих судин було виявлено виражену гіпертрофію правого шлуночку серця[4].
історія У 1897 році Віктор Ейзенменгер (Victor Eisenmenger) описав пацієнтку 32-х років, що з дитинства мала симптоми задишки та ціанозу. Згодом у пацієнтки розвинулась гостра серцева недостатність та масивна легенева кровотеча, що в результаті призвело до її загибелі. При аутопсії померлої виявлено великий вентрикулосептальний дефект та декстрапозицію аорти
історія До найчастіших причин розвитку синдрому ХЛС належать хронічний обструктивний бронхіт (ХОБ), бронхіальна астма (БА) та емфізема легень (ЕЛ). Так, за даними М.М. Бережницького та співавторів [2], бронхопульмональна форма ХЛС спостерігається в 92–96 % випадків, серед них перше місце займають ХОБ і БА (84–86 %), менш поширеною причиною ХЛС є туберкульоз легень (10–11 %).
історія У 1901 році Професор Медицини Університету Буенос-Айреса, Аргентина, Абель Аєрза (Abel Ayerza) вперше прочитав лекцію студентам з приводу синдрому, що включав в себе такі симтоми, як хронічний ціаноз, задишку та поліцитемію. Всі ці симптоми були асоційовані зі склерозом легеневих артерій.
Крім того, гіпертрофію правого шлуночка спричиняють захворювання серцевих судин (первинна легенева гіпертензія, тромбоемболія легеневої артерії, вузликовий поліартеріїт, а також раптова обтурація легеневих судин і резекція легені).
Історія Пізніше, один із його студентів Ф. Арріллага (F. Arrillaga) назвав цей синдром — «Синдром Аєрза».[6] Пізніше, цей синдром асоціювали з терміном Первинна ЛГ, який в подальшому класифікували в Ідіопатичну та Сімейну ЛГ
Історія У 1983 році американські лікарі С. Річ (Rich S) та В. Лем (Lam W) вперше виконали балонну передсердну атріосептостомію у пацієнта з ЛГ, у якого медикаментозне лікування виявилось неефективним.[7]
Легенева артеріальна гіпертензія, пов’язана з захворюваннями легень, гіпоксією або їх поєднанням: хронічні обструктивні захворювання легень; інтерстиціальна хвороба легень; апное у сні; альвеолярні гіповентиляційні порушення; гірська хвороба; дефекти розвитку.
Етіологія Мутація гена, що кодує скелет морфогенетичного протеїнового рецептору типу 2 (англ. BMPR2 – bone morphogenetic protein receptor type II), який знаходиться в хромосомі 2q33, виявляється майже у 50 % хворих на Сімейну ЛГ. Також вона виявлена у хворих на ЛГ, асоційовану з медикаментами (фенфлурамін). Насьогодні відомо понад 70 різновидів мутацій гену BMPR2.[8], [9]
Етіологія Також причинами ЛГ можуть бути ВІЛ-інфекція, склеродерма та інші аутоімунні захворювання, цироз печінки та портальна гіпертензія, фіброзуючий медіастиніт, вроджені вади серця, тромбоемболія легеневих артерій, прийом медикаментів та інші. У випадках, коли причину розвитку ЛГ не вдається встановити, тоді йде мова про Ідіопатичну ЛГ.
Також, порушують процеси вентиляції і зумовлюють розвиток легеневої гіпертензії й легеневого серця ботулізм, міастенія, поліомієліт, масивні плевральні шварти, клапанний пневмоторакс, кіфосколіоз (кіфосколіотичне легеневе серце), ожиріння (синдром Піквіка).
Залежно від стану компенсації (відсутність або наявність ознак застою у великому колі кровообігу) розрізняють компенсовану і декомпенсовану форми ХЛС. Існує три групи захворювань, які приводять до розвитку ХЛС [3].
1. Захворювання, які первинно уражають бронхи і паренхіму легень: хронічний обструктивний бронхіт, емфізема легень; туберкульоз, пневмоконіоз; фіброзуючі альвеоліти; бронхоектатична хвороба; саркоїдоз, ураження легень при дифузних захворюваннях сполучної тканини; полікістоз тощо.
Схожі презентації
Категорії