Презентація на тему:
Презентація до уроку хімії в 8 класі Узагальнення знань з теми “Основні класи неорганічних сполук”
Завантажити презентацію
Презентація до уроку хімії в 8 класі Узагальнення знань з теми “Основні класи неорганічних сполук”
Завантажити презентаціюПрезентація по слайдам:
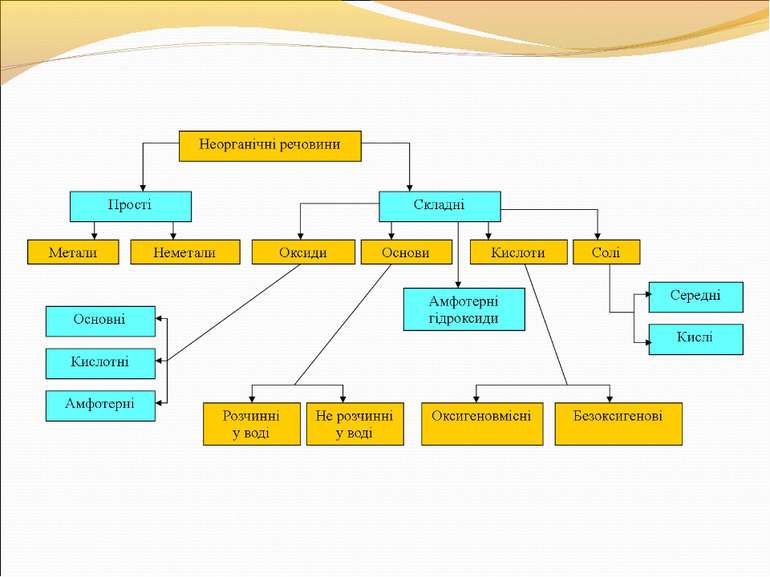
1) Простими називають речовини, які… 2) Складними називають речовини, які… 3) Оксиди – це… 4) Кислоти – це… 5) Основи – це… 6) Луги – це… 7) Основні оксиди – це… 8) Кислотні оксиди – це… 9) Індикатори – це… 10) Основи поділяються на … 11) Для кислот характерні два типи класифікації: а)… і б)… 12) Назвіть речовини: Mg(OH)2, HCl, CaO, H2S, H2O, CuSO4, Ca(NO3)2, MgCO3, AlPO4, NaOH, SO3, H3PO4, Fe(OH)3, SiO2, Ba(OH)2 13) Реакція нейтралізації – це реакція… 14) Реакція сполучення – це реакція… 15) Реакція заміщення – це реакція… 16) Реакція розкладу – це реакція… 17) Реакція обміну – це реакція…
Завдання команді 1 1) Знайди у грі «Хрестики-нолики» оксиди: CaCO3 CO2 H3PO4 HCl SO3 NaOH Fe(OH)3 N2O5 FeO 2) Чому ці речовини є оксидами? 3) До яких оксидів їх можна віднести? Чому? 4) Назвіть ці оксиди. Завдання команді 2 1) Знайди ряд, в якому тільки основні оксиди: SO3 HCl Mg(OH)2 CaCO3 FeO CO2 H2SO4 SO3 MgO 2) Чому ці оксиди називають основними? 3) Чому вони мають назву «оксиди»? 4) Назвіть їх. Завдання команді 3 1) Знайдіть оксиди CuO HCl Mg(OH)2 CaCO3 FeO CO2 H2SO4 SO3 MgO 2) Чому ці речовини є оксидами? 3) До яких оксидів їх можна відносити? 4) Яка існує класифікація оксидів? 5) Назвіть оксиди
Вода – найпоширеніша речовина на Землі. Вона займає 71% її поверхні. Без води людина не проживе більше 10 днів. Тіло людини складається на 70% з води. Вода не тільки головний компонент продуктів харчування людини. Вона миє, загартовує, лікує. Формула у неї проста: Н2О. Виявляється не все так просто. В природі зустрічається легка вода, важка і надважка. Це залежить від атомів Гідрогену, які входять до складу води. Найлегший Гідроген – протій, є тяжкий Гідроген – дейтерій, і надважкий – тритій.
Важка вода у великих дозах може викликати смерть людей і тварин, від неї в’януть квіти. Таку воду можна назвати мертвою. В талій воді міститься менше важкої води ніж у річковій чи воді з колодязя. Вода, яка утворилась з талого льоду чи снігу, деякий час має особливу структуру. Тварини і рослини, які живляться талою водою швидше ростуть і розвиваються.
Завдання (команда №1) Уявіть, що ви вирушили в навколосвітнє плавання. У вас скінчилась питна вода. Чи можна із солоної води зробити прісну? В який спосіб? Завдання (команда №2) Ви опинились на незаселеному острові, де є небагато прісної води, але вона дуже брудна: в ній плавають листя, гілочки, метелики, часточки глини… Чи зможете ви одержати чисту воду? Завдання (команда №3) Вам друг випадково всипав у питну воду замість цукру крейду. Що робити?
Мабуть, ти знаєш, що багато харчових продуктів кислі на смак. Такого смаку їм надають органічні кислоти. Кислий смак лимона зумовлений наявністю лимонної кислоти, яблука – яблучної кислоти, кислого молока – молочної кислоти. Щавель має кислий смак, бо в його листі міститься щавлева кислота. Оцет є розчином оцтової кислоти. Неорганічні кислоти також трапляються у природі у вільному стані. Наприклад, сульфідна (сірководнева) кислота Н2S є у вулканічних газах і у водах мінеральних джерел (Мацеста – Сочі на Чорноморському узбережжі Кавказу, в Україні – Немирів). Хлорид на кислота НСl входить до складу шлункового соку. Карбонатна кислота Н2СО3 – до складу природних мінеральних вод (Боржосі, Єсентуки, Нарзан на Кавказі, в Україні – Миргородська, Лужанська, Свалява, Трускавецька). Нітратна HNO3 і сульфітна H2SO3 кислоти трапляються в дощовій воді («кислотні дощі»).
Мило варили і використовували як помаду для волосся ще в Стародавньому Римі. В Україні ще сто років тому мило вміли виготовляти в домашніх умовах. З рослинної золи отримували лужні розчини і використовували їх для прання. В лужних розчинах варили сало. При цьому утворювались натрієві або калієві солі вищих жирних кислот, що отримали назву «мило». Саме тому ми кажемо «варити» мило, а не «виробляти».
Завдання команді 1 1) З наведеного переліку речовин випишіть формули кислот: ZnS, H3PO4, Na2CO3, HPO3, NaOH, CaO, HCl, CuSO4, CuO, HBr, KI, P2O5, HI, CO2, H2CO3, Mg(OH)2, H2SO3. 2) Які із наведених речовин можна отримати в результаті взаємодії металу з розчином кислоти? Напишіть відповіді рівняння реакцій: O2, ZnO, MgCl2, H2, Na2PO4. Завдання команді 2 1) Випишіть групи металів, які будуть реагувати з розчином сульфатної кислоти: а) Na, Pb, Ag б) K, Ca, Ni в) Mg, Al, Zn г) Pb, Fe, Cu 2) Здійсніть перетворення: Cu CuO CuCl2 Завдання команді 3 1) Випишіть формули кислот: Na2S, KOH, HNO3, BaCl2, Fe(OH)3, H3PO4, KHCO3, CaCl2, H2SO3 2) Маючи у своєму розпорядженні цинк, оксид купруму (ІІ) і хлоридну кислоту, одержіть одну просту і три складні речовини.
Властивості основ Основи NaOH Fe(OH)3 Cu(OH)2 KOH 1. Розкладання при нагріванні о м е г 2. Взаємодія з кислотами р к у р 3. Зміна кольору індикатора і а н й
Чи знаєш ти, що кухонна сіль NaCl – одна з найдавніших речовин? Коли і як вона стала відома людям, наука не знає. Кухонну сіль людина споживає, мабуть, стільки років, скільки їй самій. У минулому деякі народи Центральної Африки за 1 кг солі віддавали 1 кг золота. Потреба в солі дуже велика. Сучасна людина щороку споживає від 5 до 10 кг солі. Археологічні розкопки засвідчують, що в Прикарпатті видобували сіль кілька десятків тисячоліть тому. Нині головним джерелом солі є вода морів, океанів, солоних озер. На Землі запаси солі практично невичерпні.
Для попереднього замочування грубих тканин наші бабусі використовували лужні речовини. Для цього до води додавали золу рослин. Промисловим способом поташ отримували з попелу, що залишався після спалювання деревини. В ХVІ – ХVІІІ ст., головний продукт, який експортувала Росія, був поташ. Для його промислового виробництва врубували і спалювали величезні лісові масиви.
Завдання команді 1 У пронумерованих пробірках №1, 2, 3 містяться розчини лугу, кислоти і вода. Запропонуйте метод розпізнавання речовин. Завдання команді 2 З оксиду кальцію одержіть кальцій гідроксид і доведіть, що ця речовина – луг. Завдання команді 3 Проведіть реакцію нейтралізації з наявних реактивів і доведіть, що реакція відбулась. Реактиви: HCl, Ca(OH)2, фенолфталеїн.
Завдання команді 1 Обчисліть об’єм водню, який виділиться в результаті взаємодії 3г алюмінію з хлороводневою кислотою (н.у.) Завдання команді 2 Обчисліть кількість речовини водню, який виділиться в результаті взаємодії цинку масою 3г з сульфатною кислотою. Завдання команді 3 У склянку з водою опустили шматочок літію масою 28г. обчисліть об’єм водню, який виділився (н.у.)
Схожі презентації
Категорії