Презентація на тему:
Основи: поняття, склад, назви, класифікація, використання
Завантажити презентацію
Основи: поняття, склад, назви, класифікація, використання
Завантажити презентаціюПрезентація по слайдам:
Тема. Основи: поняття,склад і назви, класифікація, використання. Розділ: Складні неорганічні речовини.
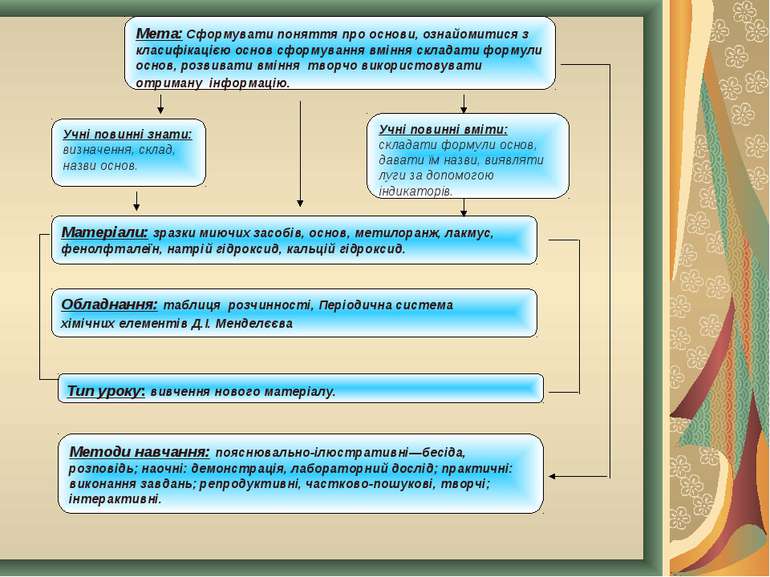
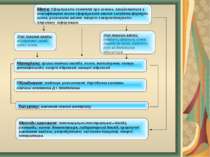
Мета: Cформувати поняття про основи, ознайомитися з класифікацією основ сформування вміння складати формули основ, розвивати вміння творчо використовувати отриману інформацію. Учні повинні знати: визначення, склад, назви основ. Учні повинні вміти: складати формули основ, давати їм назви, виявляти луги за допомогою індикаторів. Матеріали: зразки миючих засобів, основ, метилоранж, лакмус, фенолфталеїн, натрій гідроксид, кальцій гідроксид. Обладнання: таблиця розчинності, Періодична система хімічних елементів Д.І. Менделєєва Тип уроку: вивчення нового матеріалу. Методи навчання: пояснювально-ілюстративні—бесіда, розповідь; наочні: демонстрація, лабораторний дослід; практичні: виконання завдань; репродуктивні, частково-пошукові, творчі; інтерактивні.
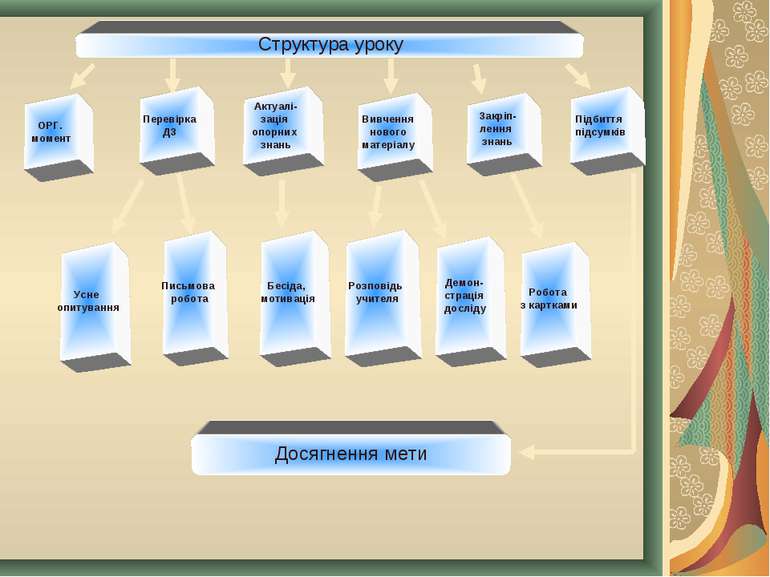
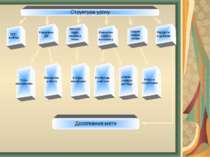
ОРГ. момент Перевірка ДЗ Актуалі- зація опорних знань Вивчення нового матеріалу Усне опитування Письмова робота Розповідь учителя Закріп- лення знань Підбиття підсумків Структура уроку Демон- страція досліду Робота з картками Бесіда, мотивація Досягнення мети
Хід уроку I. Організаційний етап Привітання, перевірка готовності учнів до уроку. II. Перевірка домашнього завдання Перевірка виконання письмових завдань проводиться усно. За необхідності проводиться додатковий хімічний диктант на знання формул кислот для всього класу або перевірочна робота на картках для окремих учнів.
III. Актуалізація опорних знань Які елементи - металічні чи неметалічні - входять до складу кислот ?
Кислоти входять до складу деяких миючих засобів. Але є миючі засоби (наприклад, для чищення поверхні кухонних плит) до складу яких входять не менш небезпечні їдкі речовини, ніж кислоти. На етикетках таких засобів написано, що до їх складу входять, наприклад, їдкий натр, їдке калі. Ці речовини є протилежними за своїми властивостями до кислот. Як ви думаєте, до якого класу неорганічних сполук вони можуть належати?
1.Поняття про основи, їх склад і назви Основи є хімічними протилежностями кислот. Вони також складають також великий клас сполук. Неорганічні основи ще називають гідроксидами, тому що вони складаються з двох частин: атомів металічних елементів і гідроксигруп ОН. Наприклад, NaOH, Ca(OH) , Al(OH)з . IV. Вивчення нового матеріалу Al(OH)з NaOH Ca(OH)
Основи - складні речовини, що складаються з атома металічного елемента і однієї або декількох гідроксигруп ОН. Гідроксигрупа є одновалентною, тому число гідроксигруп у складі основи дорівнює властивості металічного елемента. Назви гідроксидам давати досить просто: назва складається з двох слів: перше - назва металічного елемента, а друге - слово «гідроксид». Якщо металічний елемент може виявляти декілька валентностей, то в назві також вказується його валентність римськими цифрами в дужках. Наприклад: I NaOH-натрій гідроксид; II Ca(OH) -кальцій гідроксид; 2
Завдання для закріплення Заповніть таблицю. Формула Назва Колір Агрегатний стан NaOH KOH LіOH
2. Фізичні властивості основ. Основи поділяються на розчинні та не розчинні у воді. Розчинні основи називають лугами. Луги – тверді речовини білого кольору, без запаху, милкі на дотик, добре розчинні у воді та спирті. При розчиненні лугів у воді виділяється велика кількість теплоти і розчин розігрівається. Тверді гідроксиди Натрію і Калію настільки гідроксичні (поглинають газувату воду з повітря), що на повітрі розпливаються. На відміну від всіх лугів, кальцій гідроксид(гашене вапно) малорозчинний у воді. Його насичений розчин називають вапняною водою, а суспензію у воді вапняним молоком. Нерозчинні гідроксиди – за звичайних умов тверді речовини різного забарвлення, без запаху, не проводять електричний струм і не притягуються магнітом, звісно, у воді не розчиняються.
Демонстрація Учитель демонструє ознаки основ: Cu(OH)2–блакитного кольору - Fe(OH)3 - бурого - Ni(OH)2 - блідо-зеленого - Cr(OH)3 сіро-зеленого кольору -
Гідроксид Натрію і Калію при нагріванні плавляться і киплять без розкладання. На відміну від натрій гідроксиду і калій гідроксиду гідроксиди лужно-земельних металів піл час нагрівання розкладаються на оксид металічного елемента та воду. Гідроксиди (основи) Розчинні у воді (луги) Нерозчинні у воді LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH) , Sr(OH) , Ba(OH) 2 2 2 Al(OH) , Fe(OH) , Cr(OH) 3 2 3 тощо
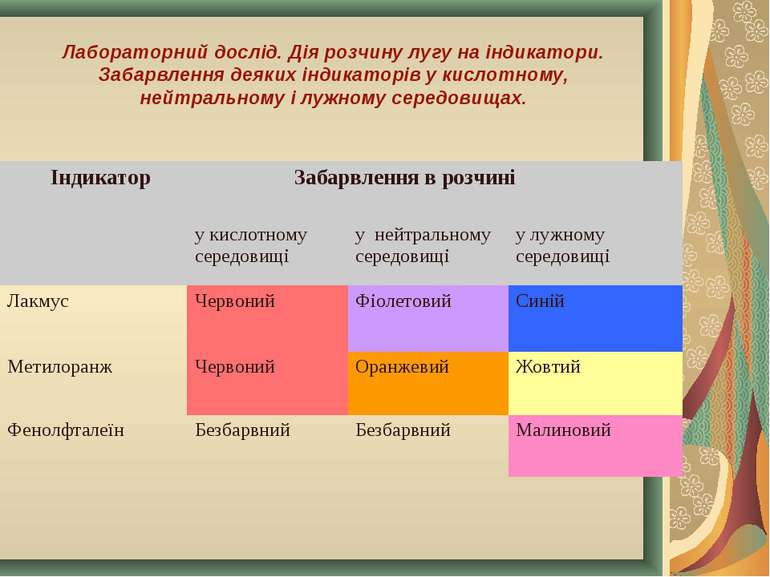
Лабораторний дослід. Дія розчину лугу на індикатори. Забарвлення деяких індикаторів у кислотному, нейтральному і лужному середовищах. Індикатор Забарвлення в розчині у кислотному середовищі у нейтральному середовищі у лужному середовищі Лакмус Червоний Фіолетовий Синій Метилоранж Червоний Оранжевий Жовтий Фенолфталеїн Безбарвний Безбарвний Малиновий
4. Використання основ На практиці здебільше використовуються тільки луги, в першу чергу натрій гідроксид та кальцій гідроксид. Кальцій гідроксид має технічну назву «негашене вапно». Його використовують здебільше у будівництві для приготування різних будівельних сумішей: штукатурка, шпаклівка тощо. Вапняним молоком (суспензія кальцій гідроксиду у воді) навесні фарбують низ стовбурів дерев, щоб зберегти від комах. Також кальцій гідроксид використовують у цукровій промисловості, для виготовлення зубних паст. Натрій гідроксид використовується при виробництві мила, миючих засобів, ліків, у шкіряній промисловості, для очищення нафти тощо.
5. Правила техніки безпеки під час роботи з лугами. Луги є їдкими речовинами: вони роз’їдають шкіру, деревину , папір, спричиняють серйозні опіки шкіри та слизових оболонок. Недарма натрій гідроксид називають їдким натром, а калій гідроксид – їдким калі. Вовняна тканина, занурена в концентрований розчин натрій гідроксиду, набухає й перетворюється на драглеподібну масу. Якщо розчин лугу що потрапив на руку , не змити водою, шкіру починає щипати, і незабаром утворюється виразка. При роботі з лугами потрібно берегти очі, тому рекомендується надягати захисні окуляри.
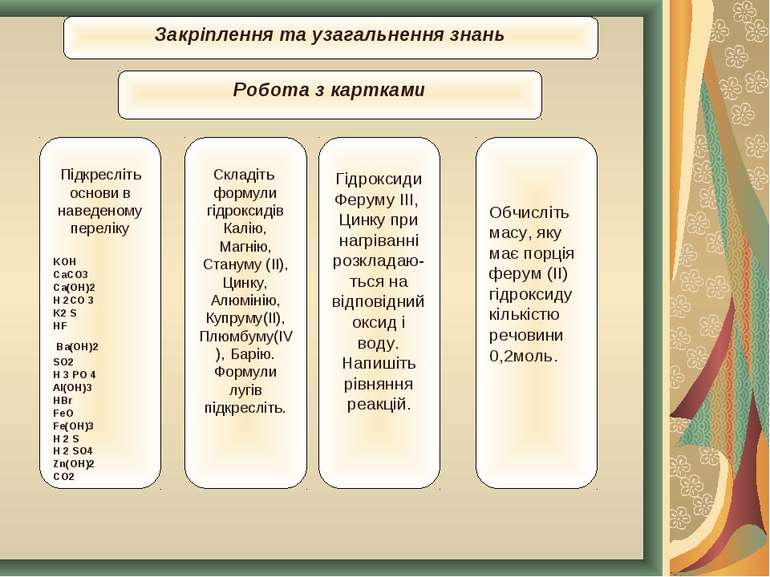
Закріплення та узагальнення знань Підкресліть основи в наведеному переліку KOH CaCO3 Ca(OH)2 H 2CO 3 K2 S HF Ba(OH)2 SO2 H 3 PO 4 Al(OH)3 HBr FeO Fe(OH)3 H 2 S H 2 SO4 Zn(OH)2 CO2 Складіть формули гідроксидів Калію, Магнію, Стануму (II), Цинку, Алюмінію, Купруму(II), Плюмбуму(IV), Барію. Формули лугів підкресліть. Гідроксиди Феруму ІІІ, Цинку при нагріванні розкладаю-ться на відповідний оксид і воду. Напишіть рівняння реакцій. Обчисліть масу, яку має порція ферум (ІІ) гідроксиду кількістю речовини 0,2моль. Робота з картками
VI. Домашнє завдання Вивчити параграф підручника VII. Підбиття підсумків уроку Учитель просить учнів висловитися з приводу досягнення цілей уроку. Для підведення підсумків цього уроку можна використати інтерактивну технологію колективно-групового навчання «Незакінчене речення». Учитель пропонує учням продовжити речення: «Найважливішим відкриттям на цьому уроці для мене було….».
Схожі презентації
Категорії