Презентація на тему:
Ненасичені
Завантажити презентацію
Ненасичені
Завантажити презентаціюПрезентація по слайдам:
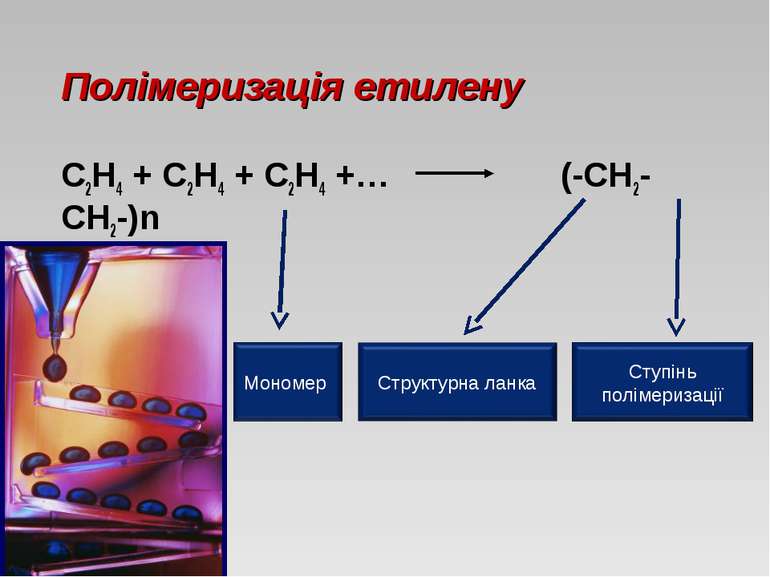
Алкени - ациклічні вуглеводні, в молекулі яких крім одинарних зв'язків міститься один подвійний зв'язок між атомами вуглецю. Загальна формула: СnH2n
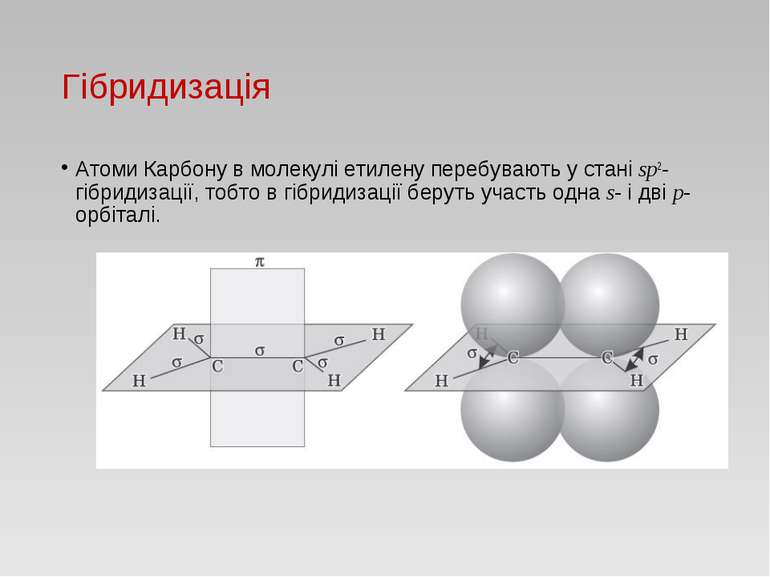
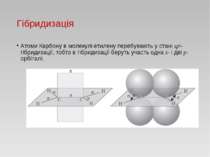
Гібридизація Атоми Карбону в молекулі етилену перебувають у стані sp2-гібридизації, тобто в гібридизації беруть участь одна s- і дві p-орбіталі.
Види ізомерії: 1. Ізомерія карбонового скелета. 2. Ізомерія положення C = C кратних зв’язків — вид ізомерії, за якого змінюється положення кратного зв’язку в головному ланцюзі. 3. Міжкласова, або ізомерія різних гомологічних рядів. 4. Просторова (стереоізомерія) Структурна і просторова ізомерія алкенів
Фізичні властивості алкенів Алкени погано розчиняються у воді, а добре в органічних розчинниках. Алкіни краще розчиняються у воді та мають специфічний аромат Зі збільшенням молекулярної маси з'єднань температури кипіння і плавлення закономірно підвищуються. Агрегатний стан: С2Н4 – С4Н8 - гази С5Н10 – С18Н36 - рідини з С19Н38 - тверді речовини
Хімічні властивості ненасичених вуглеводнів Як і насичені вуглеводні, ненасичені горять, тобто повністю окиснюються. Головна особливість ненасичених вуглеводнів – схильність до реакції приєднання. Якісні реакції на виявлення ненасичених вуглеводнів – взаємодія з бромною водою або з розчином калій перманганату.
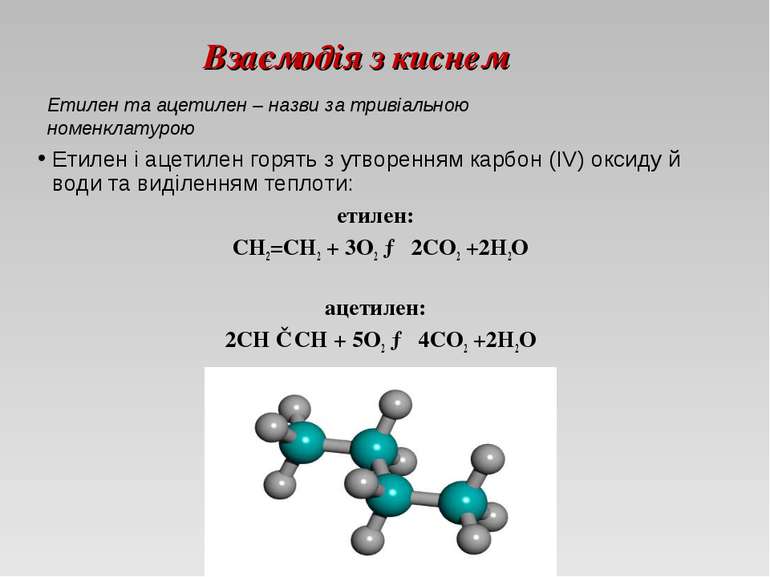
Взаємодія з киснем Етилен і ацетилен горять з утворенням карбон (IV) оксиду й води та виділенням теплоти: етилен: СН2=CH2 + 3О2 → 2CO2 +2H2O ацетилен: 2СН ≡ CH + 5О2 → 4CO2 +2H2O Етилен та ацетилен – назви за тривіальною номенклатурою
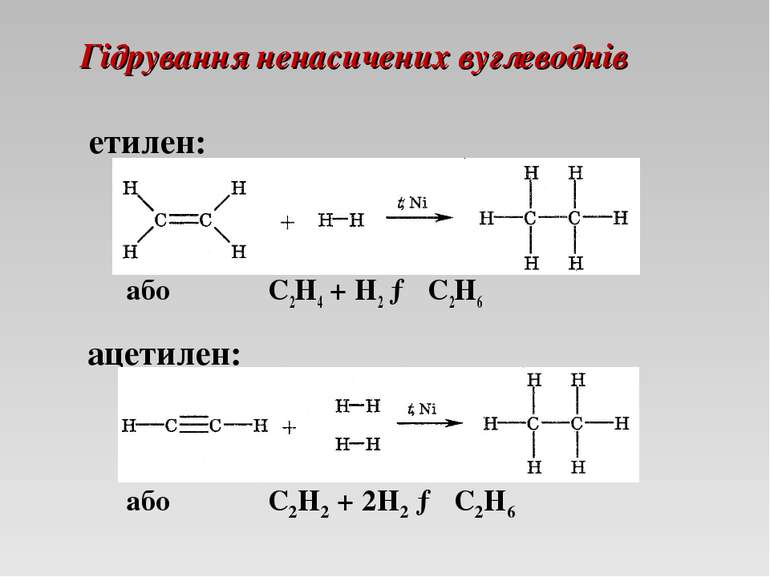
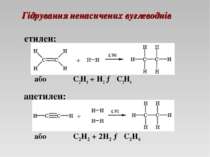
Реакція гідрування Реакцію приєднання атомів Гідрогену за рахунок розриву кратних зв'язків називають реакцією гідрування. І етилен, і ацетилен реагують із воднем при нагріванні в присутності нікелевого каталізатора. У результаті гідрування ненасичених вуглеводнів утворюються насичені вуглеводні.
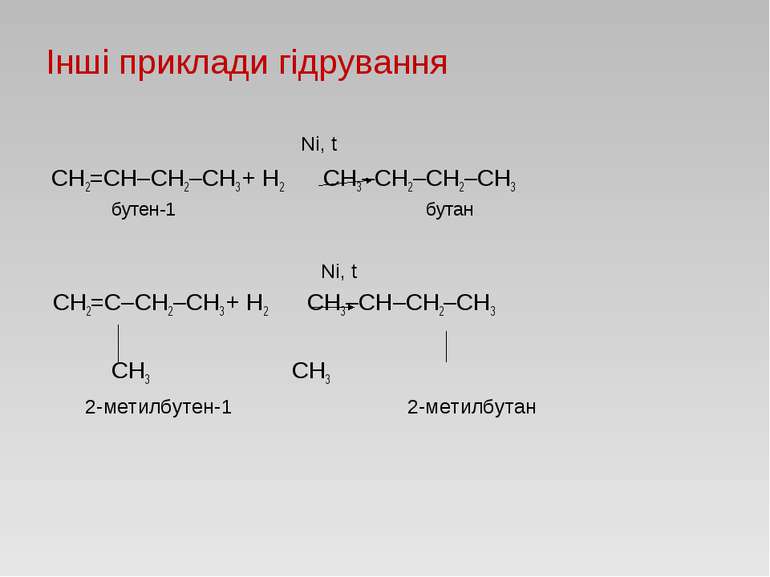
Гідрування ненасичених вуглеводнів або С2Н4 + H2 → C2H6 етилен: ацетилен: або С2Н2 + 2H2 → C2H6
Галогенування ненасичених вуглеводнів За аналогічною схемою ненасичені вуглеводні приєднують молекули галогенів (хлору або брому): етилен: С2Н4 + Br2 → C2H4Br2 ацетилен: С2Н2 + 2Br2 → C2H2Br4
Якісні реакції Реакція з калій перманганатом є характерною для всіх ненасичених сполук і використовується як якісна реакція для виявлення кратного зв'язку в молекулі. Реакція з бромною водою також використовується для виявлення у молекулі кратного зв'язку.
Гідрогенгалогенування Російський хімік-органік. В реакціях приєднання полярних молекул до несиметричних алкенів, водень приеднуеться до більш гідрогенізованого атому карбону при подвійному звязку . Правило Морковнікова
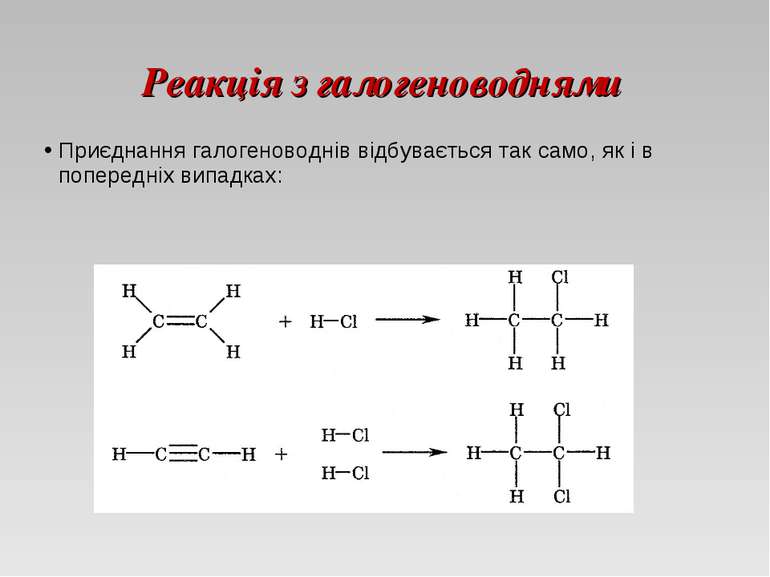
Реакція з галогеноводнями Приєднання галогеноводнів відбувається так само, як і в попередніх випадках:
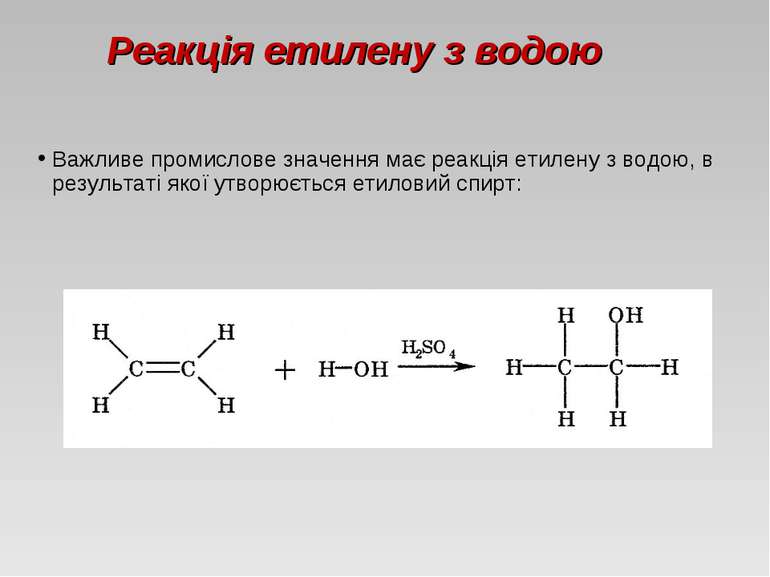
Реакція етилену з водою Важливе промислове значення має реакція етилену з водою, в результаті якої утворюється етиловий спирт:
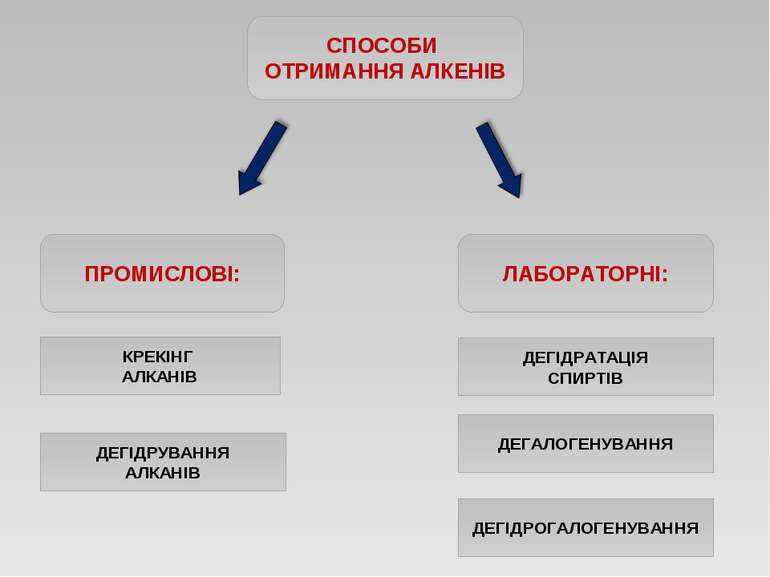
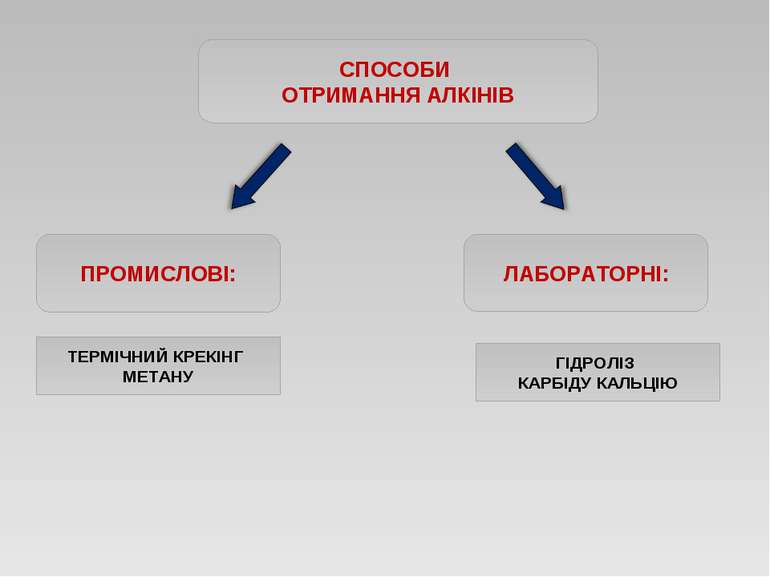
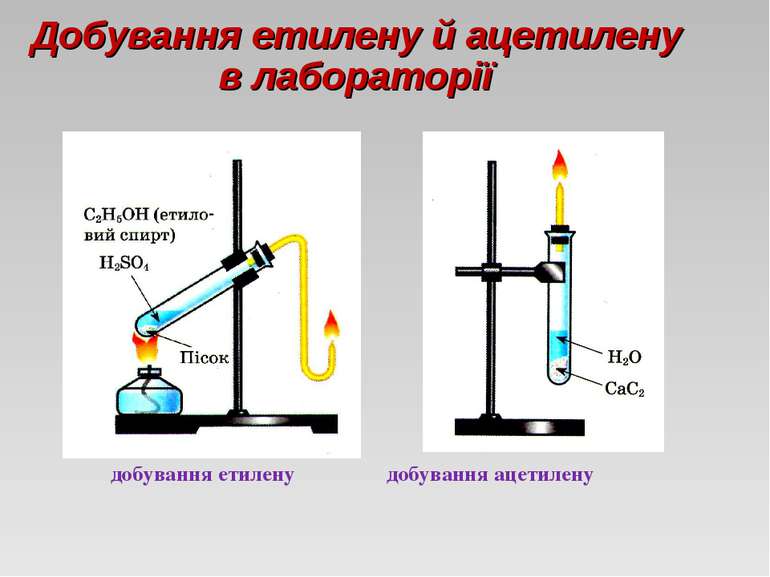
Добування етилену та ацетилену в лабораторії Етилен добувають нагріванням етилового спирту з концентрованою сульфатною кислотою: H2SO4 CH3-CH2OH —→ CH2=CH2 + H2O Ацетилен добувають, додаючи воду до кальцій карбіду : CaC2 + 2H2O → Ca(OH)2 +C2H2↑
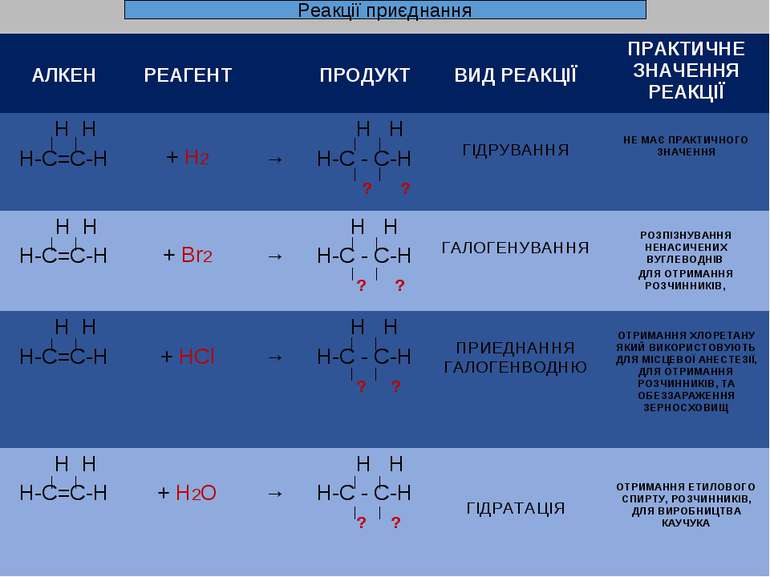
Реакції приєднання АЛКЕН РЕАГЕНТ ПРОДУКТ ВИД РЕАКЦІЇ ПРАКТИЧНЕ ЗНАЧЕННЯ РЕАКЦІЇ Н Н Н-С=С-Н + Н2 → Н Н Н-С - С-Н ? ? ГІДРУВАННЯ НЕ МАЄ ПРАКТИЧНОГО ЗНАЧЕННЯ Н Н Н-С=С-Н + Br2 → Н Н Н-С - С-Н ? ? ГАЛОГЕНУВАННЯ РОЗПІЗНУВАННЯ НЕНАСИЧЕНИХ ВУГЛЕВОДНІВ ДЛЯ ОТРИМАННЯ РОЗЧИННИКІВ, Н Н Н-С=С-Н + HCl → Н Н Н-С - С-Н ? ? ПРИЕДНАННЯ ГАЛОГЕНВОДНЮ ОТРИМАННЯ ХЛОРЕТАНУ ЯКИЙ ВИКОРИСТОВУЮТЬ ДЛЯ МІСЦЕВОЇ АНЕСТЕЗІЇ, ДЛЯ ОТРИМАННЯ РОЗЧИННИКІВ, ТА ОБЕЗЗАРАЖЕННЯ ЗЕРНОСХОВИЩ Н Н Н-С=С-Н + H2O → Н Н Н-С - С-Н ? ? ГІДРАТАЦІЯ ОТРИМАННЯ ЕТИЛОВОГО СПИРТУ, РОЗЧИННИКІВ, ДЛЯ ВИРОБНИЦТВА КАУЧУКА
Схожі презентації
Категорії