Презентація на тему:
Лужні метали
Завантажити презентацію
Лужні метали
Завантажити презентаціюПрезентація по слайдам:
Мета уроку: дати відомості про лужні метали як прості речовини; формувати вміння учнів характеризувати хімічні елементи за їх місцем у періодичній системі, на основі будови атомів пояснювати фізичні та хімічні властивості лужних металів, прогнозувати їх застосування, дотримуватись правил техніки безпеки під час проведення лабораторних дослідів; узагальнювати та робити висновки; розвивати пізнавальну активність учнів; виховувати почуття взаємодопомоги та взаємопідтримки.
Очікувані результати: учень: називає сполуки металічних елементів за сучасною українською номенклатурою; складає формули оксидів, гідроксидів та солей лужних елементів; характеризує хімічні властивості лужних металів; складає рівняння відповідних реакцій; робить висновок про залежність властивостей металів від будови їх атомів.
Актуалізація опорних знань Запитання: Охарактеризуйте місцезнаходження металічних елементів у періодичній системі хімічних елементів Д.І. Менделєєва. Які особливості будови їх атомів? Як особливості будови атомів металічних елементів впливають на їх фізичні властивості? Як особливості будови атомів металічних елементів впливають на їх хімічні властивості?
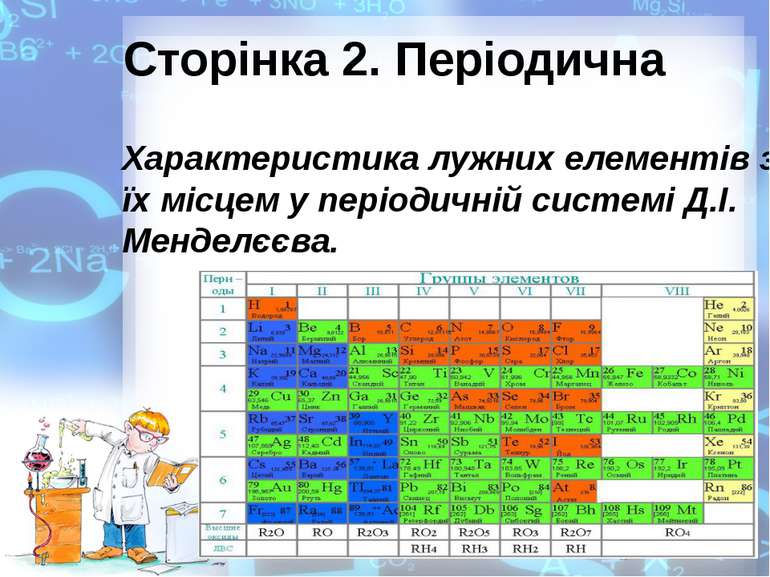
Сторінка 2. Періодична Характеристика лужних елементів за їх місцем у періодичній системі Д.І. Менделєєва.
Самостійна робота Завдання. Охарактеризуйте (за планом) елементи за їх місцем у періодичній системі Д.І. Менделєєва. Ряд 1: Lі, Fr. Ряд 2: Na, Сs. Ряд 3: К, Rb.
План характеристики елемента за його місцем у періодичній системі Д.І. Менделєєва 1. Порядковий номер елемента, його назва. 2. Номер періоду, групи; назва підгрупи, де знаходиться елемент. 3. Будова атома: а) заряд ядра; б) кількість електронів, кількість енергетичних рівнів і розподіл електронів на них; в) кількість електронів зовнішнього енергетичного рівня та його завершеність. Металічний чи неметалічний елемент. Формула вищого оксиду і валентність у ньому. Характер вищого оксиду та гідроксиду. Порівняння металічних властивостей із властивостями елементів, що стоять поряд у періоді та групі.
Сторінка 4. Хімічна Взаємодія з простими речовинами: 1. Взаємодія з киснем. Lі + O2 = Lі2O (літій оксид); 2Nа + О2 = Nа2O2 (натрій пероксид). 2. Взаємодія з галогенами (F2, С12, Вr2,I2). 2Lі + Сl2 = 2LiСl (літій хлорид); 2Nа + Вr2 = 2NаВr (натрій бромід). 3. Взаємодія з сіркою. 2Nа + S = Nа2S (натрій сульфід).
Взаємодія з воднем. 2Nа + Н2 = 2NаН (натрій гідрид). Взаємодія зі складними речовинами: 5. Взаємодія з водою. 2Nа + 2Н2О =2NаОН + Н2↑. 6. Взаємодія з кислотами з вибухом. 2Na + 2НСl→ 2NаСl + Н2↑.
Самостійна робота. Завдання. Напишіть рівняння хімічних реакцій, що характеризують хімічні властивості такого лужного металу, як калій. Дайте відповіді на запитання: 1. Який газ виділяється? 2. Чому фенолфталеїн змінив колір? 3. Який висновок можна зробити на основі цього досліду?
Сторінка 5. Геологічна Поширеність лужних металів у природі. Завдання. Випишіть формули та назви сполук Натрію і Калію. Сполуки Калію КС1 — сильвін; КС1∙NаС1 — сильвініт; КС1∙МgС12∙6Н2O — карналіт. Сполуки Натрію NаС1 — кам'яна сіль або галіт; Na2SO4∙10H2O — глауберова сіль; NаNО3, — чилійська селітра.
Сторінка 6. Біологічна Лужні елементи є в організмі людини. Так, Натрій і Калій належать до макроелементів, а Літій, Рубідій і Цезій — до мікроелементів. Перші беруть участь в обміні речовин, а фізіологічна й біохімічна роль Літію, Рубідію, Цезію є ще малоз'ясованою.
Сторінка 7. Практична Металічний натрій — найбільш поширений метал.Він використовується у металургії як відновник, як теплоносій у ядерних реакторах сумісно з калієм, а також для добування натрій пероксиду (Nа2О2). Рубідій та цезій застосовують для виготовлення фотоелементів.
• металічний калій: — у металотермії та органічних синтезах для одержання сплавів з натрієм та іншими металами; для вимірювання величини поглинання рентгенівського випромінювання за допомогою калієвої пластинки; для одержання супероксиду, який використовують у підводних човнах для очищення повітря: 4КО2 + 2СО2 = 2К2СО3 + 3О2↑.
V. Узагальнення та систематизація знань Хімічна гра «Пінг-понг» Запитання: 1. Чому елементи першої групи головної підгрупи називаються лужними? Який із лужних металів є найм'якшим? Яка кількість електронів на зовнішньому енергетичному рівні елементів першої групи головної підгрупи? Назвіть хімічний елемент, атоми якого мають електронну формулу 1s22s1.
Розв’яжіть задачу Внаслідок взаємодії з водою одновалентного металу масою 19,5 г виділяється водень об’ємом 5,6 л (н.у.). визначити цей метал.
Прийом «Хімічна естафета» Завдання. Здійсніть перетворення: Na →Na202 →Na2C03 — NaCl; Li→Li20→LiOH→ LiCl; К →КОН→ K2S04.
VІ. Домашнє завдання VІІ. Рефлексивно-оціночний етап. Підсумок уроку. Метод «Мікрофон» Поділіться своїми враженнями. Сьогодні я дізнався… Я здивувався, що… Мені сподобалося…
Схожі презентації
Категорії