Презентація на тему:
кристалічна градка
Завантажити презентацію
кристалічна градка
Завантажити презентаціюПрезентація по слайдам:
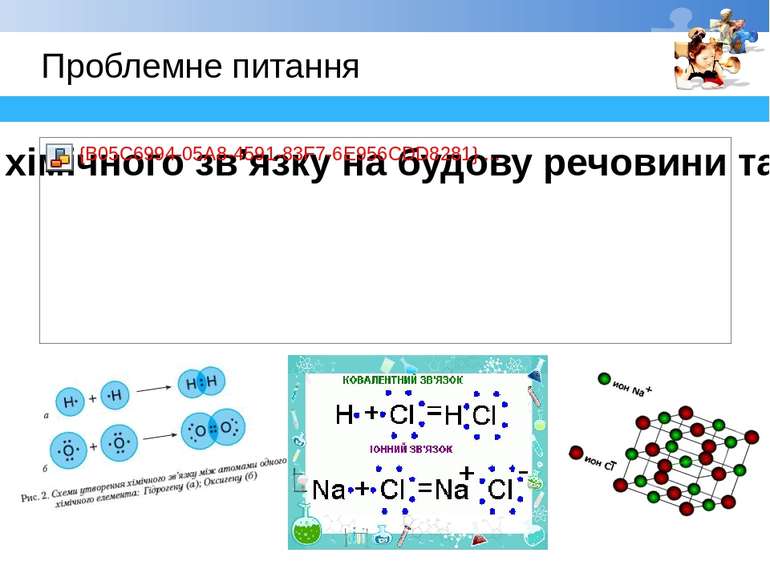
Як ти розумієш зміст поняття «хімічний зв'язок»? Запитання 1 Які типи хімічного зв'язку ви знаєте? Запитання 2 Які структурні частинки атома беруть участь в утворенні хімічного зв’язку? Запитання 3 Йонний зв’язок зазвичай утворюється між атомами Запитання 4 Запитання 5 Згадай У чому полягає відмінність йонних, атомних і молекулярних кристалічних ґраток?
З роси, з морів, річок і плес Вода як перейде у пару, Одразу ж лине до небес. Щоб утворити в небі хмари. І впасти з хмар на ниви Як сніг, як град, як злива. Знов перейти у пару І повернутись в хмару, І впасти з хмар на ниви Як сніг, як град, як злива. Цей шлях, що вона робить, І зветься колообіг.
Видите камень вон тот, придорожный? Камень как камень…Обычный… Возможно. Как бы о нем поточнее узнать? Надо науку на помощь призвать. Как пишется «камень», научит Грамматика. Размеры и форму найдет Математика. Физика массу отыщет и вес. Минералогия взглянет на срез. «Это кремень», – скажет ребятам, – И называют его силикатом. Археология скажет: «Находка! Справа на камне видна обработка!» «Жил в этой местности древний народ…» – Дальше История слово берет. Камень в овраге лежит придорожном… Камень простой? Или, может быть, сложный? О камне ты все ли узнал, Человек? Наука поможет! Не каменный век!
Залежність фізичних властивостей речовини від типів кристалічних ґраток Кристалічні ґратки L/O/G/O
Будова твердих речовин Підказка: Чорний Іванко у дерев'яній сорочці, Де носом поведе там замітку кладе.
Властивості речовин в твердому стані залежать від типу кристалічної гратки (перш за все від того, які частки знаходяться в її вузлах), що, в свою чергу, обумовлено типом хімічного зв'язку в даній речовині.
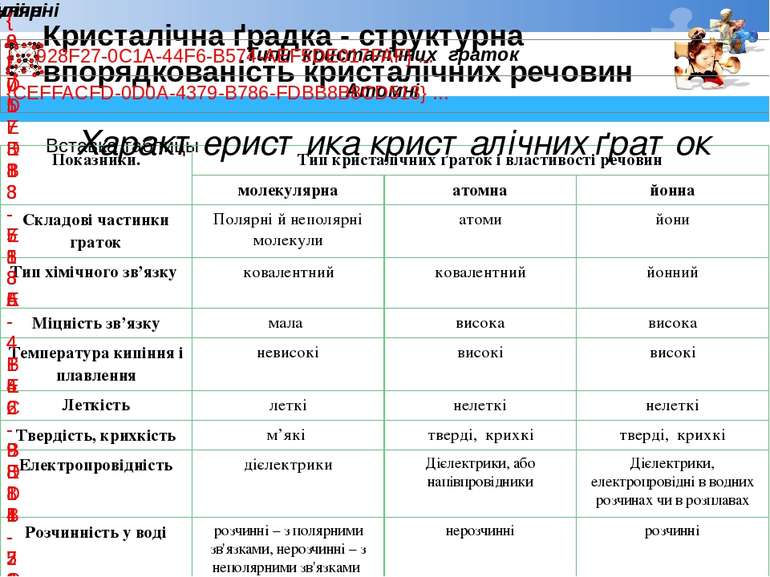
Кристалічна ґрадка - структурна впорядкованість кристалічних речовин Характеристика кристалічних ґраток Показники. Типкристалічнихґратоківластивостіречовин молекулярна атомна йонна Складовічастинкиграток Полярні й неполярні молекули атоми йони Тип хімічного зв’язку ковалентний ковалентний йонний Міцність зв’язку мала висока висока Температура кипіння і плавлення невисокі високі високі Леткість леткі нелеткі нелеткі Твердість, крихкість м’які тверді, крихкі тверді, крихкі Електропровідність дієлектрики Дієлектрики, або напівпровідники Дієлектрики, електропровідні в водних розчинах чи в розплавах Розчинність у воді розчинні – з полярними зв'язками, нерозчинні – з неполярними зв'язками нерозчинні розчинні
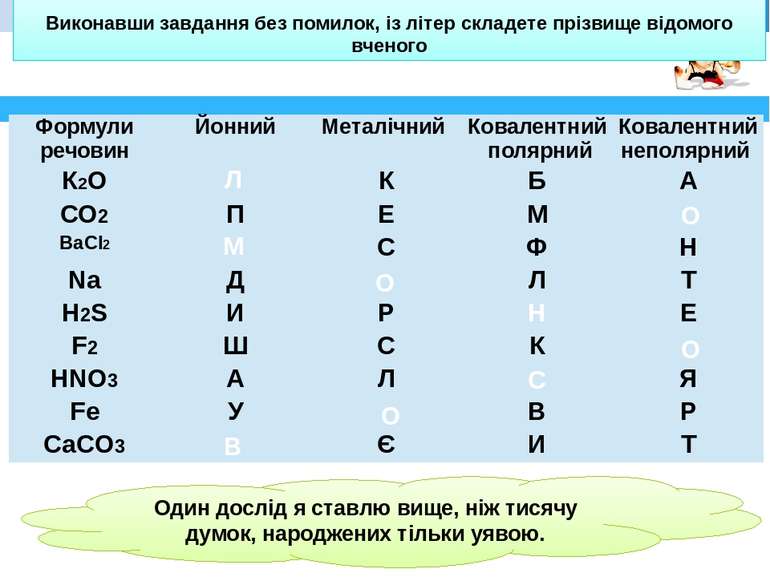
Виконавши завдання без помилок, із літер складете прізвище відомого вченого Л О М О Н О С О В Один дослід я ставлю вище, ніж тисячу думок, народжених тільки уявою. Формули речовин Йонний Металічний Ковалентний полярний Ковалентний неполярний К2О К Б А СО2 П Е М ВаСІ2 С Ф Н Na Д Л Т H2S И Р Е F2 Ш С К HNO3 А Л Я Fe У В Р CaCO3 Є И Т
Речовини: алмаз, кухонна сіль, метал, вода. алмаз Ковалентний неполярний атомна атоми Нелеткі,тверді, крихкі нерозчинні, Т пл. високі Речовина Вид хімічного зв’язку Тип кристалічних ґраток Структурні частинки Фізичні властивості
А. Надзвичайно тверді, нелеткі, тугоплавкі, не розчиняються в жодному розчиннику Б.Крихкі, леткі, розчиняються у воді Г.Тверді , крихкі, деякі розчиняються у воді В.Тверді, пластичні, не розчиняються у воді Установіть відповідність між речовинами та їхніми характеристиками.
Є такий афоризм: Практика без теорії сліпа, теорія без практики мертва. Кожна гіпотеза тільки тоді стає теорією, коли вона перевірена практикою.
Інструкція до лабораторної роботи Мета: дослідити властивості речовин з різними типами кристалічних граток. Обладнання: штатив з пробірками, склянка з водою, спиртівка, тримач, зразки речовин ( кухонна сіль – NaCl , цукор – С12Н22О11, силіцій(IV)оксид). Хід роботи Поділіть видану вам речовину на дві пробірки. У першу пробірку долийте води. Спостерігайте, чи розчиняється речовина у воді. Другу пробірку затисніть тримачем і нагрійте в полум’ї спиртівки. Спостерігайте, чи розплавляється речовина. На основі спостережень зробіть висновок про будову речовини. Назвіть тип кристалічної гратки.
Причиново-наслідкові зв’язки між будовою та властивостями речовин Будова атома Типхімічногозв’язку Тип кристалічної гратки Фізичні властивості
Гра “Вірю – не вірю” Йонний зв’язок виникає між йонами Йони – це нейтральні частинки Йони – це заряджені частинки Ковалентний зв’язок буває двох типів – полярний і неполярний Ковалентний полярний зв’язок утворюється між атомами з однаковою електронегативністю Ковалентний неполярний зв’язок утворюється між атомами одного і того ж неметалу Ковалентний неполярний зв’язок утворюється між атомами з різною електронегативністю NaCl – сполука з йонним зв’язком О2 – сполука з ковалентним полярним зв’язком HCl –сполука з йонним зв’язком
Карбонат кальцію (CaCO3) має йонну кристалічну решітку, тому, можна з певність спрогнозувати повне розчинення цієї речовини в кислоті. «Одного разу, під час бенкету Клеопатра заявила, що вип'є десять мільйонів сестерцій(93 млн.гр.) Вона вийняла з вуха сергу з перлиною, рівної якої не було в усьому світі, і кинула її в чашу, де та вмить розчинилася. На очах здивованої публіки красуня залпом випила це питво». - Який напій випила Клеопатра? - Що сталося з перлиною?
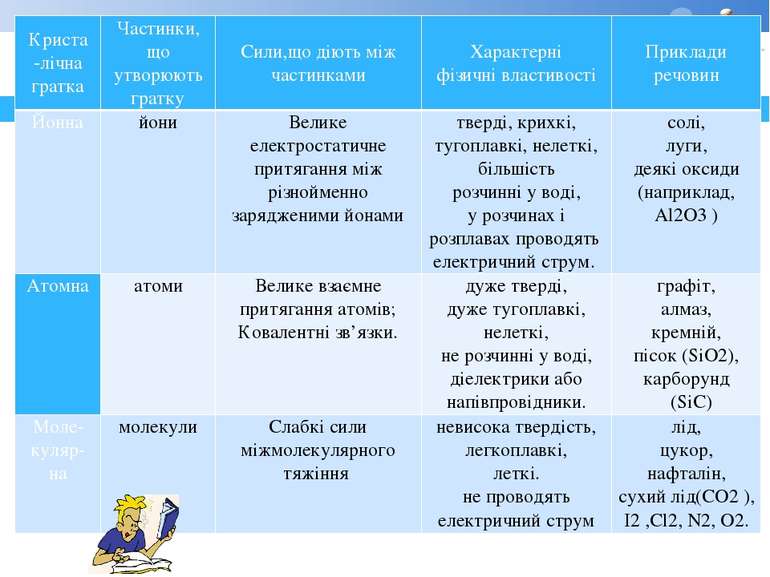
Криста-лічнагратка Частинки, що утворюють гратку Сили,що діють між частинками Характерні фізичні властивості Приклади речовин Йонна йони Велике електростатичне притягання між різнойменно зарядженимийонами тверді, крихкі, тугоплавкі, нелеткі, більшість розчинні у воді, у розчинах і розплавах проводять електричний струм. солі, луги, деякі оксиди (наприклад, Al2О3) Атомна атоми Велике взаємне притягання атомів; Ковалентні зв’язки. дуже тверді, дуже тугоплавкі, нелеткі, не розчинні у воді, діелектрики або напівпровідники. графіт, алмаз, кремній, пісок (SіО2), карборунд (SіС) Моле- куляр- на молекули Слабкі сили міжмолекулярного тяжіння невисока твердість, легкоплавкі, леткі. не проводять електричний струм лід, цукор, нафталін, сухий лід(СО2), I2 ,Cl2,N2,О2.
Схожі презентації
Категорії