Презентація на тему:
Кристалічна градка
Завантажити презентацію
Кристалічна градка
Завантажити презентаціюПрезентація по слайдам:
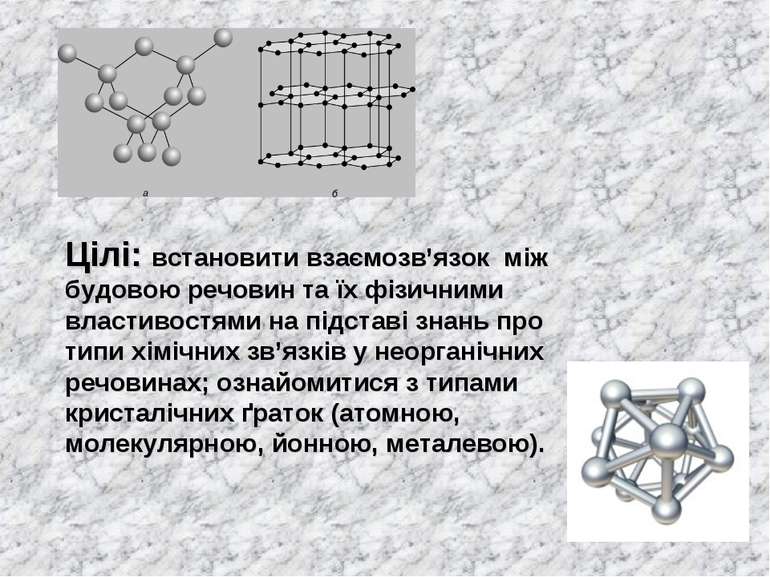
Цілі: встановити взаємозв’язок між будовою речовин та їх фізичними властивостями на підставі знань про типи хімічних зв’язків у неорганічних речовинах; ознайомитися з типами кристалічних ґраток (атомною, молекулярною, йонною, металевою).
«Одного разу, під час бенкету Клеопатра заявила, що вип'є десять мільйонів сестерцій(93 млн.гр.) Вона вийняла з вуха сергу з перлиною, рівної якої не було в усьому світі, і кинула її в чашу, де та вмить розчинилася. На очах здивованої публіки красуня залпом випила це питво». - Який напій випила Клеопатра? - Що сталося з перлиною?
Будова твердих речовин Аморфна Кристалічна Структурні частинки речовини розміщуються безладно Приклад: глина Структурні частинки речовини розміщуються впорядковано Приклад: кухонна сіль
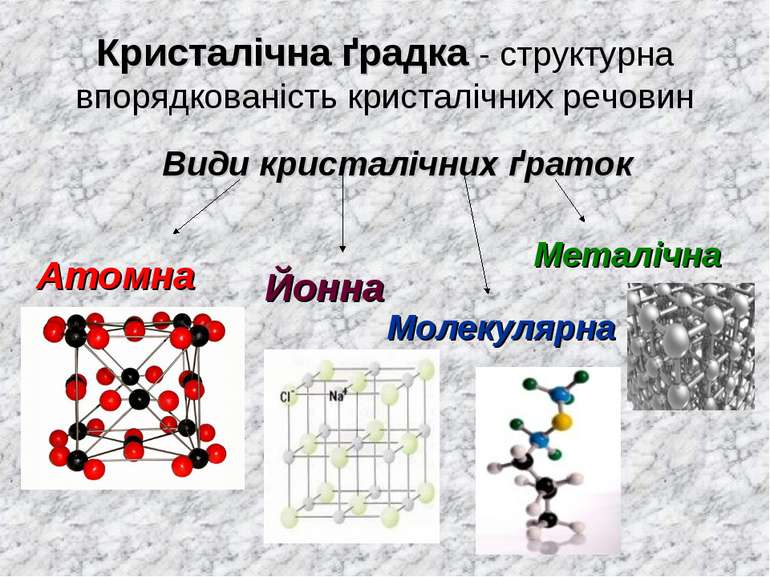
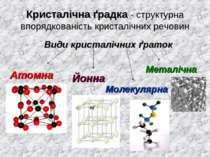
Кристалічна ґрадка - структурна впорядкованість кристалічних речовин Види кристалічних ґраток Атомна Йонна Молекулярна Металічна
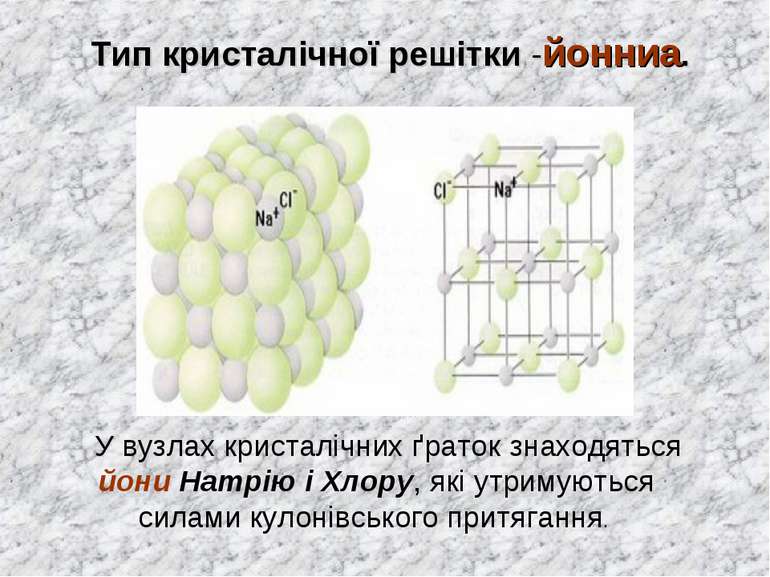
Тип кристалічної решітки -йонниа. У вузлах кристалічних ґраток знаходяться йони Натрію і Хлору, які утримуються силами кулонівського притягання.
Натрій хлорид (NaCl) – твердий, кристалічний, тугоплавкий, добре розчинний у воді. Хімічний зв’язок - йонний, у вузлах кристалічних ґраток знаходяться йони Натрію і Хлору, які утримуються силами кулонівського притягання. Такий тип кристалічних решіток називається йонний.
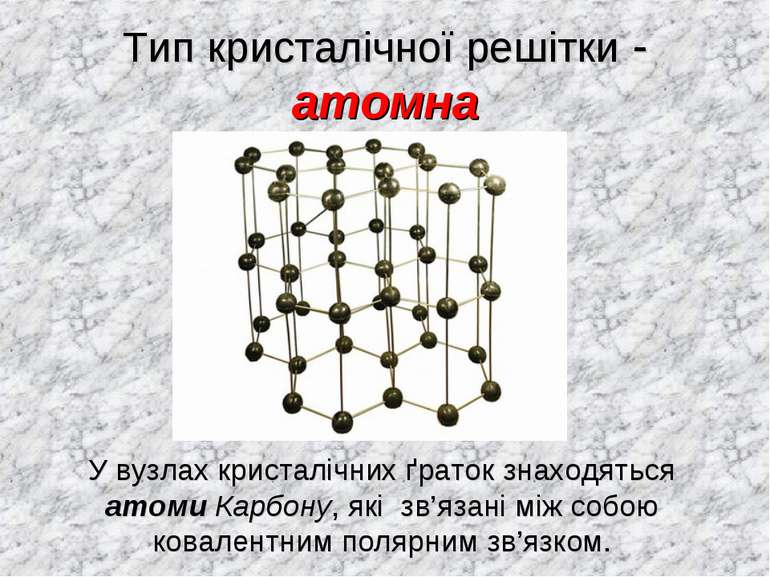
Тип кристалічної решітки - атомна У вузлах кристалічних ґраток знаходяться атоми Карбону, які зв’язані між собою ковалентним полярним зв’язком.
Графіт (C )- тверда речовина, нерозчинна у воді. Хімічний зв'язок - ковалентний неполярний. Тип кристалічної решітки - атомна, у вузлах кристалічних ґраток знаходяться атоми Карбону, зв’язані між собою ковалентним полярним зв’язком.
Тип кристалічної решітки – молекулярна У вузлах кристалічних ґраток знаходяться молекули вуглекислого газу. Зв'язок між ними - міжмолекулярна взаємодія.
Карбон (IV) оксид (CO2) - за н.у. газ, низькі температури плавлення, розчинний у воді. Хімічний зв’язок - ковалентний полярний. Тип кристалічної решітки – молекулярна, в вузлах кристалічних ґраток знаходяться молекули вуглекислого газу. Зв'язок між ними – міжмолекулярна взаємодія.
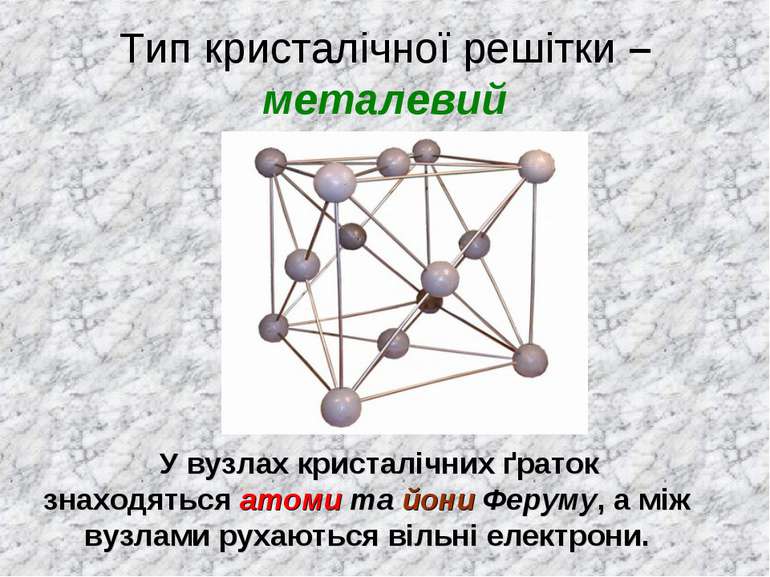
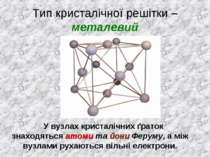
Тип кристалічної решітки – металевий У вузлах кристалічних ґраток знаходяться атоми та йони Феруму, а між вузлами рухаються вільні електрони.
Залізо – високі температури плавлення, нерозчинне у воді. Хімічний зв'язок - металічний Тип кристалічної решітки – металевий, у вузлах кристалічних ґраток знаходяться атоми та йони Феруму, а між вузлами рухаються вільні електрони.
Інструкція з визначення типу кристалічної гратки 1. Проста речовина – визначити метал чи неметал: Ме – мають металічну кристалічну гратку; неМе – мають молекулярну кристалічну гратку; винятки – деякі неМе мають атомну кристалічну гратку
2. Складна речовина – визначити клас речовини: неМехОу – молекулярну кристалічну гратку; P2O5 МехОу – йонну кристалічну гратку; Al2O3 Ме(ОН)х – йонну кристалічну гратку; Cu(OH)2 НхAn – йонну кристалічну гратку; H2SO4 MeхAnу – йонну кристалічну гратку. Na2SO3
Завдання 1 За зразками кристалічних ґраток, з’ясувати, яку речовину ви отримали, довести це: Речовини: графіт, алмаз, кухонна сіль, метал, вода.
Завдання 2 Виправити помилки: Атомна кристалічна градка: Cl2, Fe , N2 H2O, C Молекулярна кристалічна градка: H2O, KCl, O2, CO2, Au Металічна кристалічна градка: Cu, Na, Cl, Fe, Al, H2, SiO2 Йонна кристалічна градка: NaCl, CaCl2,Br2, NaBr, S
Карбонат кальцію (CaCO3) має йонну кристалічну решітку, тому, можна з певність спрогнозувати повне розчинення цієї речовини в кислоті.
Домашнє завдання 1) Вивчити § підручника, опрацювати конспект. 2) Створити просторові моделі різних кристалічних ґраток; знайти цікаві данні про використання цих речовин у побуті.
Схожі презентації
Категорії