Презентація на тему:
"Корозія металів"
Завантажити презентацію
"Корозія металів"
Завантажити презентаціюПрезентація по слайдам:
КОРОЗІЯ - мимовільне руйнування металів і сплавів в результаті хімічної або електрохімічної взаємодії їх з довкіллям.
ВПЛИВ КОРОЗІЇ: Викликає серйозні екологічні наслідки: витік нафти, газу, інших хімічних продуктів. Недопустима у багатьох галузях промисловості : авіаційної, хімічного, нафтового і атомного машинобудування. Негативно впливає на життя і здоров'я людей.
ЧИННИКИ, ЩО ВИКЛИКАЮТЬ КОРОЗІЮ кисень і волога атмосфери; вуглекислий і сірчистий гази, що містяться в атмосфері; морська вода; ґрунтові води.
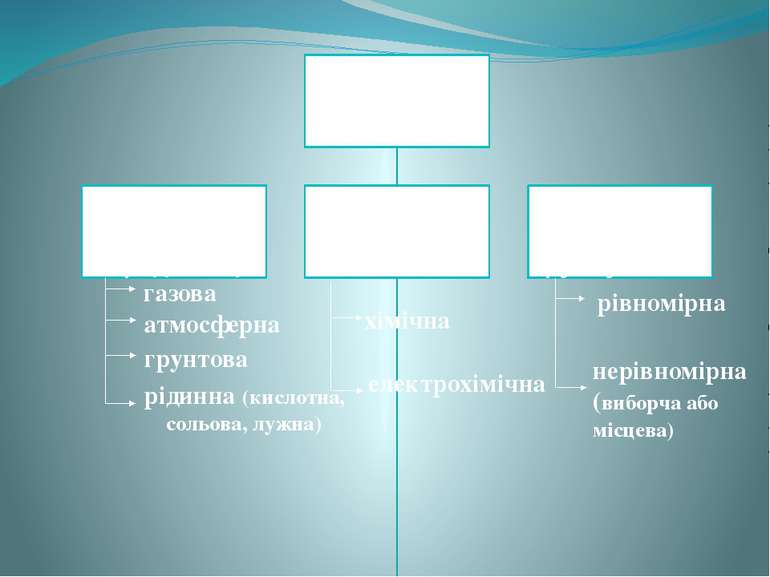
газова атмосферна грунтова рідинна (кислотна, сольова, лужна) хімічна електрохімічна рівномірна нерівномірна (виборча або місцева)
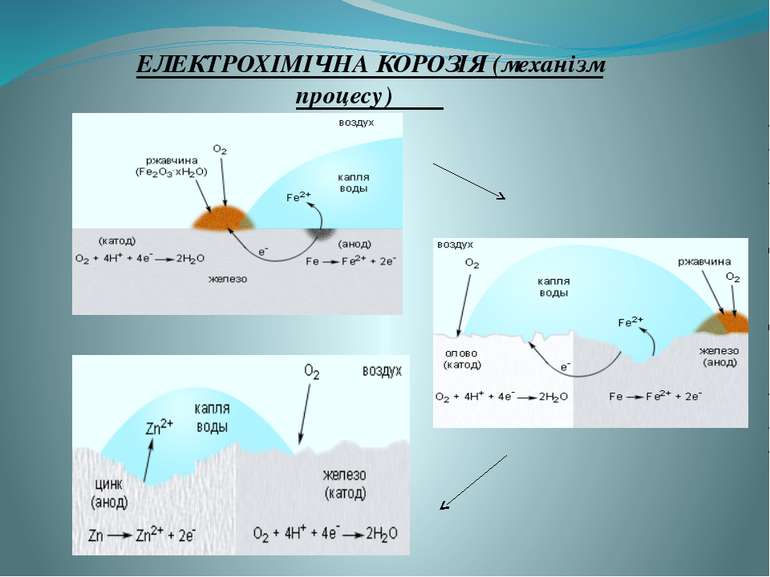
Існує два види корозії: хімічна і електрохімічна. Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей. Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування. ВИДИ КОРОЗІЇ
ХІМІЧНА КОРОЗІЯ Відбувається в середовищах, які не проводять електричного струму. Вона обумовлюється дією на метали неелектролітів (спирту, бензину, мінеральних масел тощо) і сухих газів (кисню, оксидів азоту, хлору, хлороводню, сірководню і ін.) при високій температурі (так звана газова корозія). У результаті взаємодії металів із зовнішнім середовищем їх поверхня вкривається тонким шаром (плівкою) різних хімічних сполук (продуктів корозії): оксидів, хлоридів, сульфідів і т. д. Інколи цей шар такий щільний, що крізь нього не може проникати агресивне середовище. В таких випадках з часом швидкість корозії зменшується, а то й зовсім припиняється.
ХІМІЧНА КОРОЗІЯ Наприклад, алюміній в атмосфері повітря кородує значно повільніше від заліза, хоч за своїми хімічними властивостями він активніший від заліза. Це пояснюється тим, що поверхня алюмінію вкривається суцільною, досить щільною і міцною оксидною плівкою, яка ізолює метал від доступу кисню, а оксидна плівка заліза, навпаки, є крихкою і ламкою, містить багато пор і тріщин, через що кисень повітря крізь неї легко проникає до поверхні заліза, і тим обумовлюється безперервне його руйнування.
УМОВИ, ЯКІ СПРИЯЮТЬ ЕЛЕКТРОХІМІЧНІЙ КОРОЗІЇ Положення металу у ряді активності металів: чим вони далі розташовані один від одного, тим швидше відбувається корозія. Чистота металу : домішки прискорюють корозію. Нерівності поверхні металу, тріщини. Грунтові води, морська вода, середовище електроліту. Підвищення температури. Дія мікроорганізмів(гриби, бактерії і лишайники впливають на метал з високою корозійною стійкістю
ЕЛЕКТРОХІМЧНА КОРОЗІЯ Вона більш поширена і завдає значно більшої шкоди, ніж хімічна. Вона виникає при контакті двох металів у середовищі водних розчинів електролітів. На відміну від хімічної електрохімічна корозія супроводжується переміщенням валентних електронів з одної ділянки металу на іншу, тобто виникненням місцевих електричних струмів внаслідок утворення на кородуючій поверхні так званих гальванічних пар. Подвійний електричний шар на границі метал —електроліт
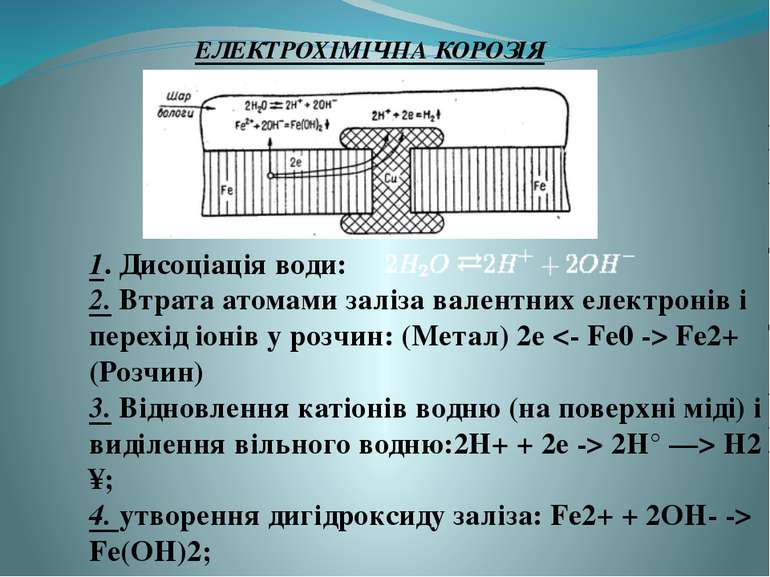
ЕЛЕКТРОХІМІЧНА КОРОЗІЯ 1. Дисоціація води: 2. Втрата атомами заліза валентних електронів і перехід іонів у розчин: (Метал) 2е Fe2+ (Розчин) 3. Відновлення катіонів водню (на поверхні міді) і виділення вільного водню:2Н+ + 2е -> 2Н° —> Н2 ↑; 4. утворення дигідроксиду заліза: Fe2+ + 2OH- -> Fe(OH)2;
ЕЛЕКТРОХІМІЧНА КОРОЗІЯ 5. окиснення двовалентного заліза до тривалентного розчиненим киснем повітря: 6. Fe(OH)2 + O2 + 2H2O -> 4Fe(OH)3; часткова втрата води тригідроксидом заліза і перетворення його в гідроксид-оксид заліза:
СПОСОБИ ЗАХИСТУ ВІД КОРОЗІЇ Нанесення захисних покриттів (лаки, фарби, емалі); Покриття іншим металом(позолота, сріблення, хромування, цинкування); Створення і використання антикорозійних сплавів Введення в середу інгібіторів, що знижують агресивність середовища; Протекторний захист
Схожі презентації
Категорії