Презентація на тему:
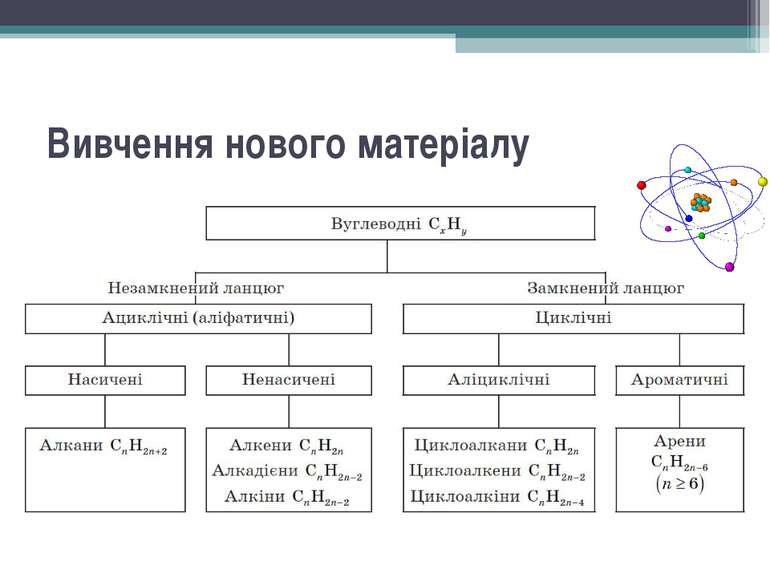
Класифікація вуглеводнів. Утворення ковалентних карбонкарбонових зв’язків у органічних сполуках. Види гібридизації електронних орбіталей атома Карбону
Завантажити презентацію
Класифікація вуглеводнів. Утворення ковалентних карбонкарбонових зв’язків у органічних сполуках. Види гібридизації електронних орбіталей атома Карбону
Завантажити презентаціюПрезентація по слайдам:
Класифікація вуглеводнів. Утворення ковалентних карбонкарбонових зв’язків у органічних сполуках. Види гібридизації електронних орбіталей атома Карбону
Фронтальна робота за запитаннями Поясніть, чому в органічних сполуках атом Карбону проявляє валентність IV. З якими особливостями будови атома Карбону пов’язане різноманіття органічних сполук?
Гібридизація орбіталей sp3 -гібридизація. Одна s-орбіталь і три p-орбіталі перетворюються на чотири однакові «гібридні» орбіталі, кут між осями яких дорівнює 109° 28′. Молекули, у яких здійснюється sp3 -гібридизація, мають тетраедричну геометрію (CH4, NH3 ).
Гібридизація орбіталей sp2 -гібридизація. Одна s-орбіталь і дві p-орбіталі перетворюються на три однакові «гібридні» орбіталі, кут між осями яких дорівнює 120°. Якщо орбіталі перекриваються поза лінією, що з’єднує ядра, то утворюється π-зв’язок. Три sp2 -орбіталі можуть утворювати три σ-зв’язки (BF3, AlCl3 ). Ще один зв’язок (π-зв’язок) може утворитися, якщо на p-орбіталі, яка не бере участі в гібридизації, міститься електрон (етилен C2H4 ).
Гібридизація орбіталей sp-гібридизація. Одна s-орбіталь і одна p-орбіталь перетворюються на дві однакові «гібридні» орбіталі, кут між осями яких дорівнює 180°. Дві sp-орбіталі можуть утворювати два σ-зв’язки (BeH2, ZnCl2 ). Ще два p-зв’язки можуть утворитися, якщо на двох p-орбіталях, які не беруть участі в гібридизації, знаходяться електрони (ацетилен C2H2 ).
Узагальнення вчителя Карбон — особливий елемент. Жоден інший хімічний елемент не здатний утворювати таке різноманіття сполук. Причина цього полягає в тому, що атоми Карбону здатні:
Узагальнення вчителя 1) з’єднуватися один з одним у ланцюги різної будови — відкриті (нерозгалужені, розгалужені), замкнуті; 2) утворювати не лише прості (одинарні), але й кратні (подвійні, потрійні) зв’язки: H3C−CH3 H2C=CH2 H−C≡C−H 3) утворювати міцні зв’язки майже з будь-яким іншим елементом.
Домашнє завдання Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Схожі презентації
Категорії