Презентація на тему:
"Аміак"
Завантажити презентацію
"Аміак"
Завантажити презентаціюПрезентація по слайдам:
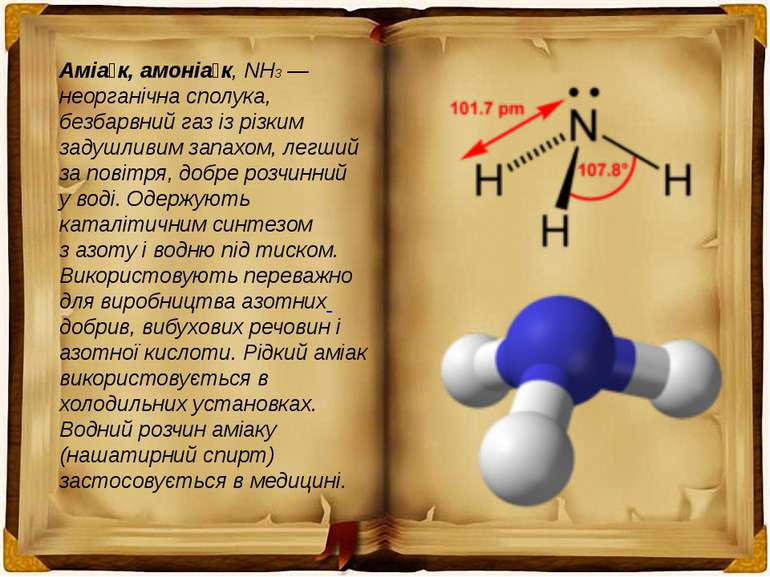
Аміа к, амоніа к, NH3 — неорганічна сполука, безбарвний газ із різким задушливим запахом, легший за повітря, добре розчинний у воді. Одержують каталітичним синтезом з азоту і водню під тиском. Використовують переважно для виробництва азотних добрив, вибухових речовин і азотної кислоти. Рідкий аміак використовується в холодильних установках. Водний розчин аміаку (нашатирний спирт) застосовується в медицині.
Властивості Молекулярна формула NH3 Молярна маса 17,0306 г/моль Зовнішнійвигляд Безбарвнийгазізрізкимтасильнимзапахом Густина 0,6942 Тпл −77,73 °С(195,42 К) Ткип −33,34 °C (239,81К) Розчинність (вода) 89,9 г/100 млпри 0 °C Кислотність (pKa) 38 Основність (pKb) 4,75 (reaction with H2O)
Небезпеки 1 3 0 Класифікація ЄС Головні небезпеки Небезпечнігази,кородуючий,їдкий NFPA 704 Температураспалаху 172 Температура самозаймання 651 °C
Молекули аміаку утворюються за допомогою ковалентних зв'язків. Електронна і структурна формули молекули аміаку такі:
Зв'язки N — Н в молекулі аміаку полярні, оскільки електронна пара зміщена до атома азоту. Тому атом азоту має негативний заряд, а атом водню — позитивний. У хімічному відношенні аміак є відновником, а сам звичайно окиснюється до вільного азоту. Так, в атмосфері кисню аміак горить за реакцією: 4NH3 + 3O2 = 2N2 + 6H2O Амоніак також легко відновлює монооксид міді до металічної міді при високій температурі за реакцією: 3CuO + 2NH3 = 3Cu + N2 + 3H2O
При розчиненні аміаку в воді частина його молекул взаємодіє з водневими іонами води з утворенням складного катіона амонію NH+4. Разом з тим відповідна кількість гідроксильних груп OH− води звільняється. Цей процес рівноважний. Його можна зобразити таким рівнянням:
Розчин гідроксиду амонію забарвлює лакмус у синій колір. З кислотами розчин гідроксиду амонію утворює солі, наприклад: NH4OH + HCl = NH4Cl + H2O NH4OH + HNO3 = NH4NO3 + H2O 2NH4OH + H2SO4 = (NH4)2SO4 + 2H2O
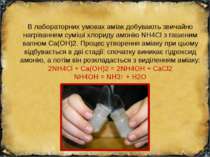
В лабораторних умовах аміак добувають звичайно нагріванням суміші хлориду амонію NH4Cl з гашеним вапном Ca(OH)2. Процес утворення аміаку при цьому відбувається в дві стадії: спочатку виникає гідроксид амонію, а потім він розкладається з виділенням аміаку: 2NH4Cl + Ca(OH)2 = 2NH4OH + CaCl2 NH4OH = NH3↑ + H2O
Амоніак — один з найважливіших продуктів сучасної хімічної промисловості. Головною галуззю його застосування є виробництво нітратної кислоти і азотних добрив. Крім того, аміак використовують для виробництва багатьох інших хімічних продуктів. Зріджений аміак і водний розчин аміаку застосовують безпосередньо як азотне добриво.
Схожі презентації
Категорії