Презентація на тему:
"Ядерна модель атома. Квантові постулати Бора"
Завантажити презентацію
"Ядерна модель атома. Квантові постулати Бора"
Завантажити презентаціюПрезентація по слайдам:
Демокрит Род близько 470- 460 до н. е. . ; помер у глибокій старості) з Абдер ( Фракія ) , давньогрецький філософ , один із засновників античної атомістики . За Демокрітом , існують тільки атоми і порожнеча. Атоми - неподільні матеріальні елементи ( геометричні тіла , « фігури » ) , вічні , незруйновані , непроникні , різняться формою , положенням в просторі , величиною; рухаються в різних напрямках , з їх « вихору» утворяться як окремі тіла , так і всі незліченні світи ; вони невидимі для людини , закінчення з них , діючи на органи чуття , викликають відчуття. Говорив про множинність світів.
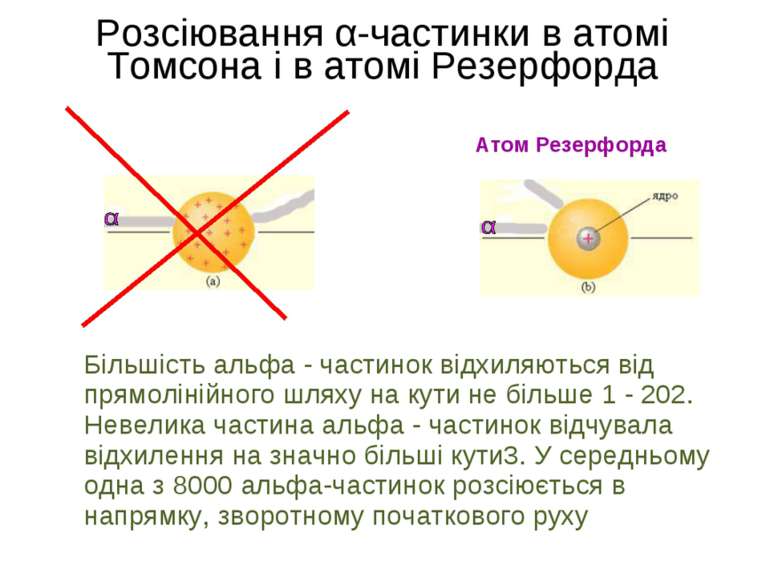
Розсіювання α-частинки в атомі Томсона і в атомі Резерфорда Атом Резерфорда ат м омсона Більшість альфа - частинок відхиляються від прямолінійного шляху на кути не більше 1 - 202. Невелика частина альфа - частинок відчувала відхилення на значно більші кути3. У середньому одна з 8000 альфа-частинок розсіюється в напрямку, зворотному початкового руху
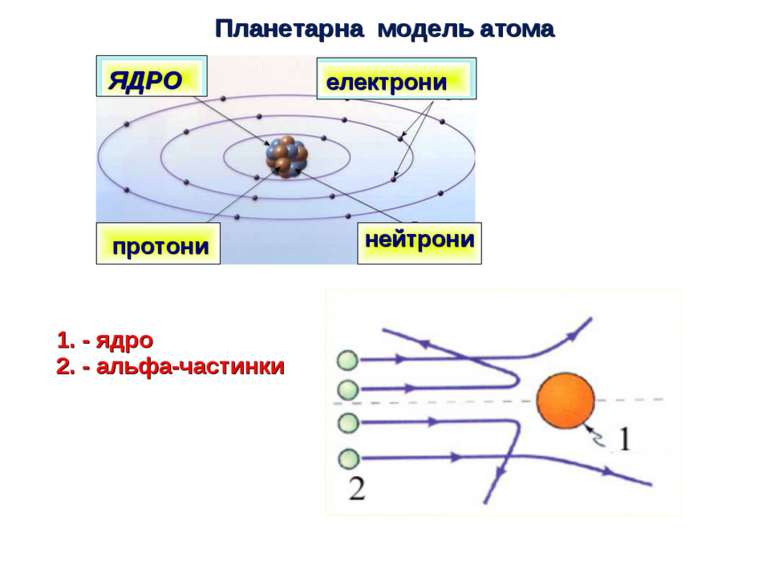
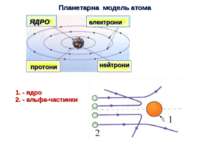
Планетарної моделі атома суперечить Закону класичної електродинаміки - електрон повинен був безупинно випромінювати електромагнітні хвилі. Такий АТОМ НЕ МОЖЕ ІСНУВАТИ !!!
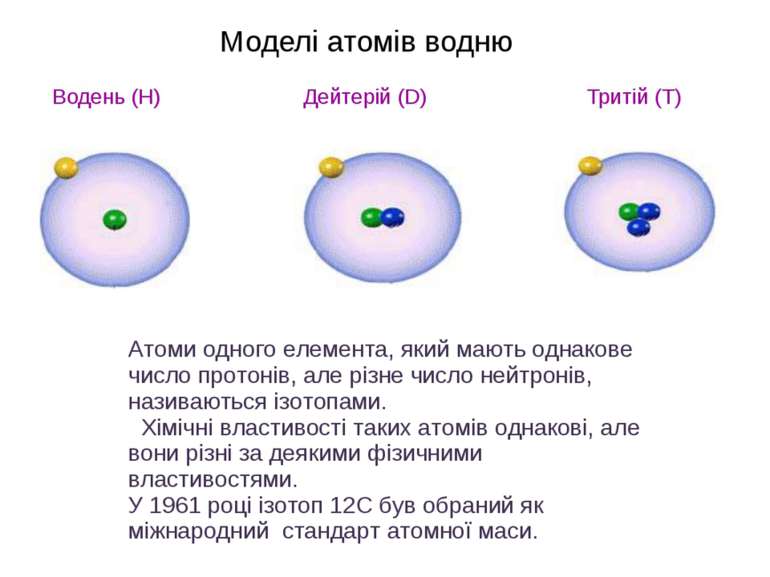
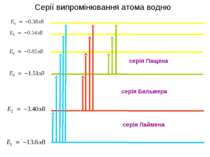
Моделі атомів водню Водень (H) Дейтерій (D) Тритій (T) Атоми одного елемента, який мають однакове число протонів, але різне число нейтронів, називаються ізотопами. Хімічні властивості таких атомів однакові, але вони різні за деякими фізичними властивостями. У 1961 році ізотоп 12С був обраний як міжнародний стандарт атомної маси.
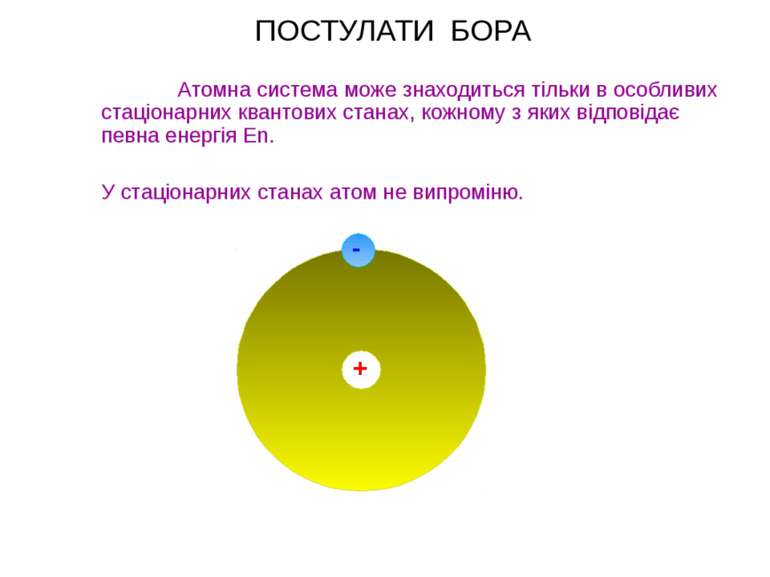
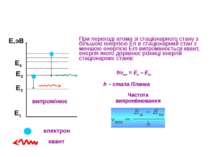
ПОСТУЛАТИ БОРА Атомна система може знаходиться тільки в особливих стаціонарних квантових станах, кожному з яких відповідає певна енергія En. У стаціонарних станах атом не випроміню. + -
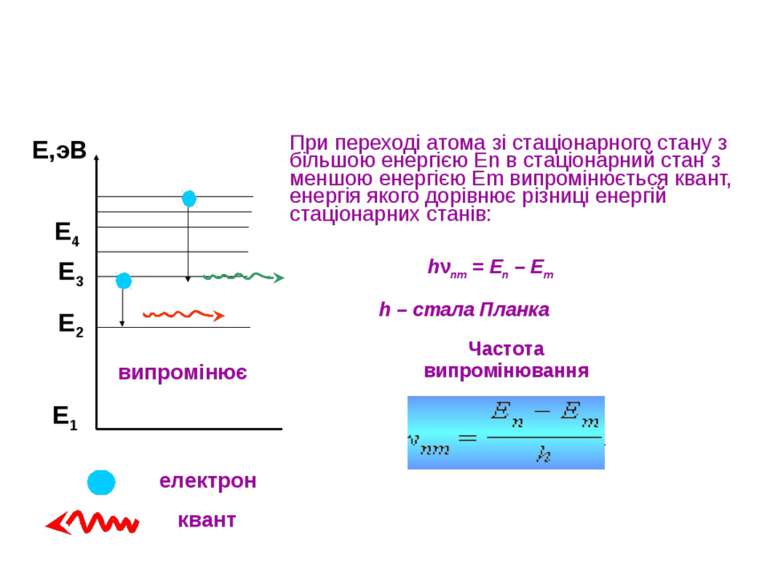
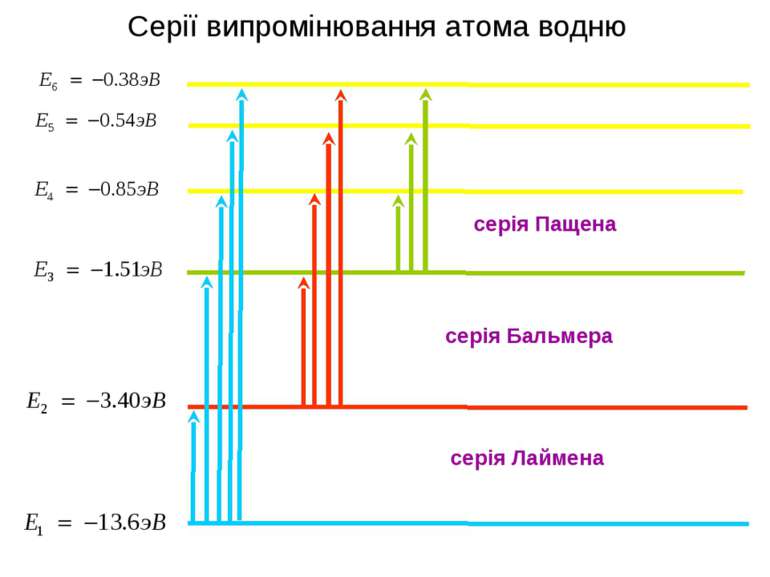
При переході атома зі стаціонарного стану з більшою енергією En в стаціонарний стан з меншою енергією Em випромінюється квант, енергія якого дорівнює різниці енергій стаціонарних станів: Е1 Е2 Е3 Е,эВ випромінює Е4 hνnm = En – Em h – стала Планка Частота випромінювання електрон квант
Недоліки Бора 1. Не змогла пояснити інтенсивність спектральних ліній. 2. Справедлива тільки для водоподібних атомів і не працює для атомів, наступних в таблиці Менделєєва. 3. Теорія Бора логічно суперечлива: вона не є ні класичною, ні квантовою. В системі двох рівнянь, що лежать в її основі, одне - рівняння руху електрона - класичне, інше - рівняння квантування орбіт - квантове.
Схожі презентації
Категорії