Презентація на тему:
ТИТРИМЕТРИЧНИЙ АНАЛІЗ
Завантажити презентацію
ТИТРИМЕТРИЧНИЙ АНАЛІЗ
Завантажити презентаціюПрезентація по слайдам:
План Титриметричний метод аналізу: суть, основні поняття та класифікація. Техніка титриметрії. Види титриметричних визначень. Розрахунки в титриметрії.
Основні поняття та їх суть: Титриметричний аналіз - Титрування - Визначувана речовина - Титрант - Стандартна речовина - Стандартизація титранту - Аліквота – Точка еквівалентності – Кінцева точка титрування -
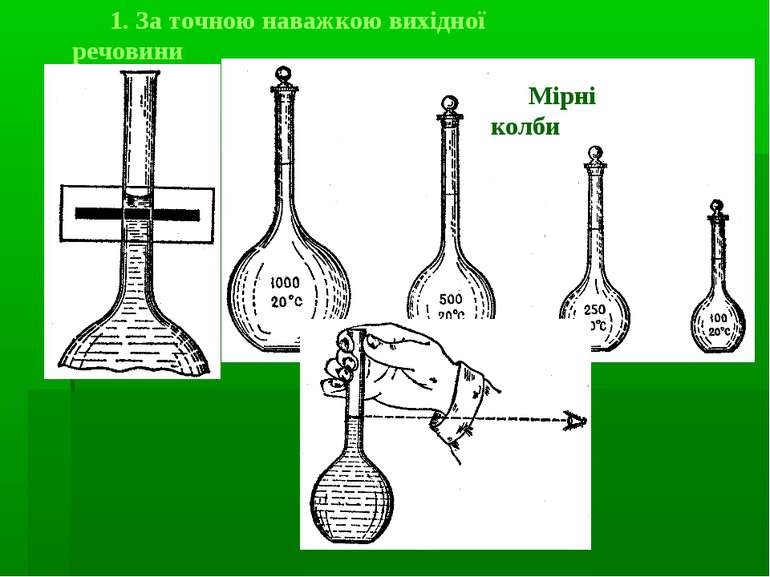
Існують різні способи приготування титрованих розчинів: за точною наважкою вихідної речовини (первинний стандартний розчин) за допомогою стандартної речовини або стандартного розчину (вторинний стандартний розчин) за допомогою “фіксаналу”(первинний стандартний розчин)
1. За точною наважкою стандартної речовини (первинний стандартний розчин) Знаючи масу (m) розчиненої у воді хімічно чистої речовини і об’єм (V) отриманого розчину легко розрахувати концентрацію виготовленого розчину:
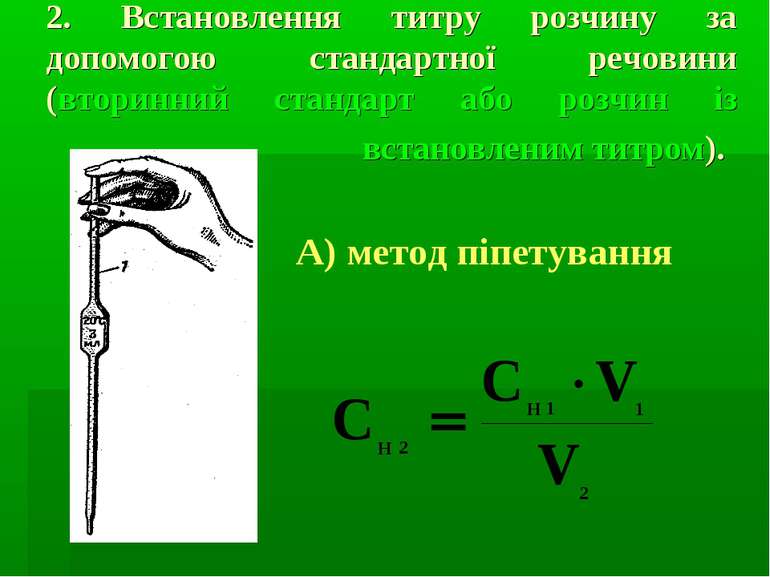
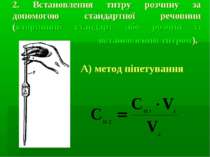
2. Встановлення титру розчину за допомогою стандартної речовини (вторинний стандарт або розчин із встановленим титром). А) метод піпетування
Б) метод окремих наважок В методі окремих наважок розрахунок молярної концентрації еквівалента титранту проводять за формулою:
Вимоги до стандартних речовин: Повинна мати кристалічну структуру і відповідати певній хімічній формулі. Хімічний склад речовини повинен відповідати формулі. Не містити сторонніх домішок більше, ніж допустимі межі для речовин кваліфікації “х. ч.”. Способи очистки стандартної речовини від супутніх домішок (кристалізація, екстракція, сублімація і т.д.) повинні бути доступними в аналітичній лабораторії. Стандартна речовина не повинна бути гігроскопічною, але мусить порівняно добре розчинятися.
Вимоги до стандартних речовин: Розчини стандартної речовини не повинні змінювати свого титру при зберіганні і зіткненні з повітрям. Стандартна речовина повинна мати якомога більшу еквівалентну масу. Чим більша еквівалентна маса речовини, тим більша точність встановлення титру розчину, так як при зважуванні речовини з більшою молекулярною масою похибка зважування виявиться незначною.
3. Виготовлення титрованих розчинів за допомогою “фіксаналу” Частіше всього в ампулі міститься 0,1 моль (0,1 еквівалента) речовини, тобто стільки скільки необхідно для приготування 0,1моль/л розчину.
Правила при приготуванні титрованих розчинів і визначенні їх титрів. Вихідна речовина, яка застосовується для виготовлення стандартного розчину повинна бути хімічно чистою. Вихідна речовина повинна легко і швидко реагувати з титрованими речовинами. Розчин вихідної речовини повинен зберігатися довший час без змін. Реакції, які проходять між вихідною і визначуваною речовиною, повинні проводитись по можливості методами прямого титрування. Процес титрування повинен закінчуватися швидко і чітко. Кінцева точка титрування повинна визначатися легко і точно. Встановлювати титри бажано або методом окремих наважок або розчиненням наважки вихідної речовини у певному об’ємі.
Правила при приготуванні титрованих розчинів і визначенні їх титрів. Для попередження похибок при титруванні необхідно так вибирати об’єм аліквоти первинного стандарту чи наважку стандартної речовини, щоб об’єм вторинного стандарту, який піде на титрування був не менше 20 мл (бюретка на 25мл) або 40 мл (бюретка на 50мл). Не слід обмежуватися одним або двома паралельними визначеннями. Титрування слід проводити до тих пір поки не буде отримано щонайменше три результати, які збігаються.
Правила при приготуванні титрованих розчинів і визначенні їх титрів. Виготовлені титровані розчини повинні зберігатися в умовах, які виключають поглинання ними вологи повітря, а також випаровування. Титри не повинні змінюватися при стоянні в часі. Посуд і вимірювальні прилади, які застосовуються в титриметрії, повинні бути вимиті, прокалібровані, підготовлені до титрування повинні зберігатися в чистому місці. Точність, з якою виконують титрування, вимірювання об’ємів і наступні обрахунки, повинна відповідати точності зважування.
Класифікація титриметричних методів за типом реакції: реакції обміну протонами – кислотно-основне титрування (протолітометрія) реакції обміну електронами – окиснювально-відновне титрування (редоксиметрія) реакції утворення малодисоційованих (комплексних) частинок (комплексиметрія) реакції утворення малорозчинних електролітів осаджувальне титрування (седиметрія)
Вимоги до реакції в титриметрії Речовини, які вступають в реакцію, повинні реагувати в строго визначених кількісних співвідношеннях (кількісно) Реакція між визначуваною речовиною і стандартним розчином титранту повинна проходити швидко і практично до кінця Сторонні речовини, які присутні в досліджуваній пробі і перейшли разом з визначуваною речовиною в розчин, не повинні заважати титруванню визначуваної речовини (специфічність) т.е. повинна фіксуватись тим чи іншим способом різко й точно Реакції повинні проходити по мірі можливості при кімнатній tо Титрування не повинно супроводжуватися побічними реакціями, які спотворюють результати аналізу
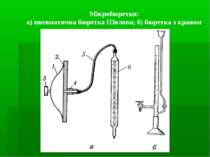
2. Техніка титриметрії Миття і висушування посуду Приготування стандартних розчинів Підготовка проби Титрування: - вимірювання об’ємів - вибір індикатора Проведення розрахунків
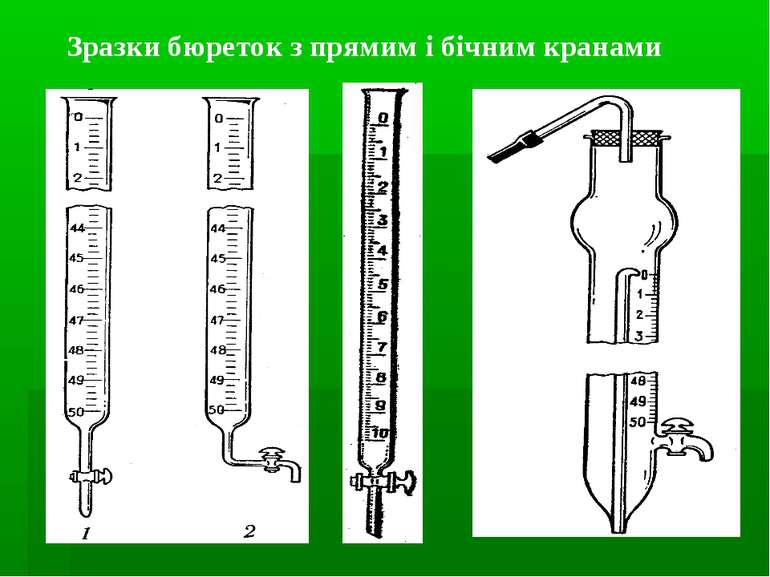
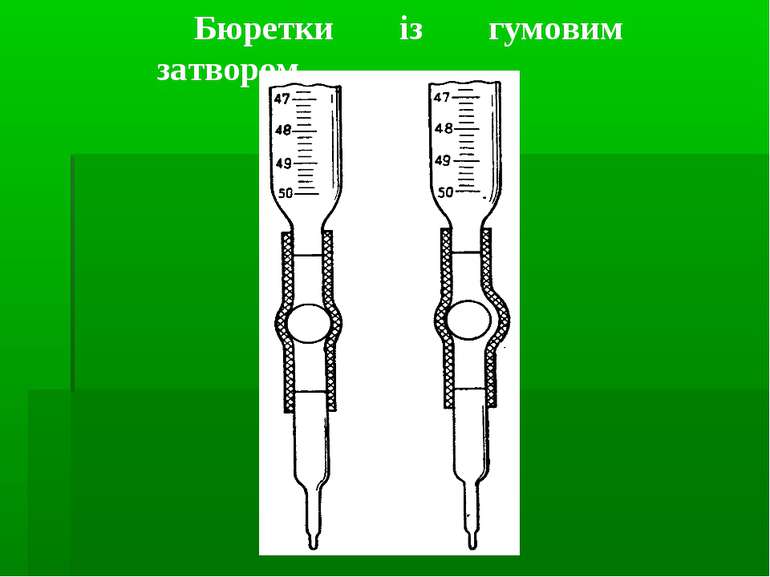
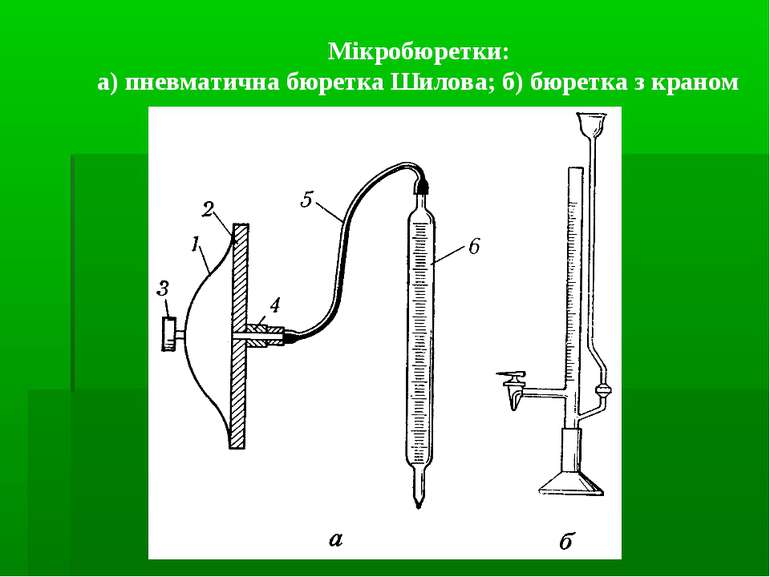
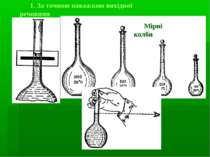
Вимірювання об’ємів: мензурки мірні циліндри мірні колби мірні піпетки (градуйовані, Мора) Бюретки Калібрування: мірних колб – метод вливання піпеток, бюреток – метод виливання
Вибір методу фіксації к.т.т.: візуально – за зміною забарвлення розчину, якщо визначувана речовина А або титрант Т забарвлені, так як в т.е. концентрація визначуваної речовини зменшується до мінімуму, а концентрація титранту починає зростати; візуально – по появі каламуті або за зміною забарвлення розчину, яке викликається утворенням продуктів реакції або індикатора, якщо А і В безбарвні; фізико-хімічними (інструментальними) методами з наступним аналізом кривих титрування, які відображають зміни, що відбуваються в процесі титрування (зміни фізико-хімічних параметрів титрованих розчинів).
3. Види титриметричних визначень за способом титрування: пряме зворотнє (за залишком) непряме (замісникове) реверсивне
Вимоги до реакцій у прямому титруванні: Взаємодія титрованої речовини із реагентом в умовах проведення аналізу повинна бути специфічною. Реакція повинна протікати стехіометрично, тобто відповідно до певного рівняння. Реакція повинна проходити швидко, тобто стан рівноваги після додавання чергової порції титр акта повинен досягатися майже миттєво. Константа рівноваги повинна бути достатньо високою, реакція повинна проходити до кінця, щоб похибки, які виникають від неповного протікання реакції не перевищили допустимі величини. Можливість підбору індикатора для фіксації т.е. А + Т = продукт
Зворотнє титрування застосовують тоді, коли: мала швидкість прямої реакції відсутній відповідний індикатор можлива втрата визначуваної речовини, внаслідок її леткості (летючості) А + Тнадлишок = продукт1 + Тзалишок Тзалишок + Тдодатковий = продукт2
Непряме титрування (замісникове) застосовують тоді, коли: визначувана речовина із використовуваним титрантом не взаємодіє взаємодія титранту і визначуваної речовини проходить не стехіометрично взаємодія визначуваної речовини і титранту приводить до утворення суміші декількох продуктів, кількісне співвідношення яких не є постійним А + Т1(додаткова речовина) = А1(замісник) А1(замісник) + Т = продукт
Реверсивне титрування. При реверсивному титруванні розчином визначуваної речовини титрують стандартний розчин реагенту А(в бюретці) + Т(в колбі) = продукт
4. Розрахунки в титриметрії Маса визначуваної речовини за результатами прямого чи замісникового титрування:
4. Розрахунки в титриметрії Маса визначуваної речовини за результатами зворотнього титрування:
Схожі презентації
Категорії

































































![Звуки [б][б’], позначення їх буквою «бе». Звуко-буквений аналіз слів Звуки [б][б’], позначення їх буквою «бе». Звуко-буквений аналіз слів](/images/1/880/210/img0.jpg)