Презентація на тему:
Молекулярна фізика
Завантажити презентацію
Молекулярна фізика
Завантажити презентаціюПрезентація по слайдам:
План Термодинамічний і статистичний підходи до вивчення макросистем Молекулярно-кінетична теорія Ізотермічні, ізобарні та ізохорні процеси Фазові переходи Тверді тіла
Термодинамічний і статистичний підходи до вивчення макросистем Під час дослідження фізичних властивостей речовини користуються термодинамічним і молекулярно-кінетичним або статистичним методами дослідження. Між статистичним і термодинамічним методами існують глибокі зв’язки. Сучасна фізика розвивається на базі тісного поєднання обох методів
Термодинамічний метод Термодинамічний метод за своєю структурою є феноменологічним (описовим) методом. Він є суто макроскопічним методом. Термодинаміка вивчає умови перетворення енергії з одного виду в інший і характеризує ці перетворення з кількісного боку. Термодинамічний метод дослідження ґрунтується на понятті про стан термодинамічної системи. Стан системи визначається сукупністю значень усіх величин, що характеризують її фізичні властивості і називаються термодинамічними параметрами (температура, тиск, об’єм тощо).
Молекулярно-кінетичною теорією називають вчення про будову і властивості речовини на основі уявлення про існування атомів і молекул якнайменших частинок речовини.
У основі молекулярно-кінетичної теорії лежать три основні положення: Всі речовини – рідкі, тверді і газоподібні – утворені з найдрібніших частинок – молекул, які самі складаються з атомів («елементарних молекул»). Молекули хімічної речовини можуть бути простими і складними, тобто складатися з одного або декількох атомів. Молекули і атоми є електрично нейтральними частинками. За певних умов молекули і атоми можуть набувати додатковий електричний заряд і перетворюватися на позитивні або негативні іони. Атоми і молекули знаходяться в безперервному хаотичному русі. Частинки взаємодіють одина з одною силами, що мають електричну природу. Гравітаційна взаємодія між частинками дуже мала.
Основні положення молекулярно-кінетичної теорії Три основні положення молекулярно-кінетичної теорії (МКТ) речовини сформульовано на підставі результатів спостережень і дослідів. Для кожного із трьох положень слід навести приклади експериментальних підтверджень. Потрібно розуміти, що між атомами і молекулами одночасно діють сили притягання і сили відштовхування електромагнітної природи. На основі прийнятих положень МКТ речовини та експериментальних результатів досліджень газів створено МКТ газів. Для побудови цієї теорії використано модель ідеального газу. На основі цієї моделі і законів класичної механіки виведено основне рівняння МКТ газів (p = nkT). Його називають основним, бо з нього виводяться інші газові закони, зокрема рівняння Клапейрона-Менделєєва, з якого випливають газові закони Авогадро, Бойля-Маріотта, Гей-Люссака, Дальтона, Шарля. Температура є головним поняттям розділу "Молекулярна фізика і термодинаміка" найбільш пов'язаним з іншими поняттями.
Найяскравішим експериментальним підтвердженням представлень молекулярно-кінетичної теорії про безладний рух атомів і молекул є броунівський рух. Це тепловий рух найдрібніших мікроскопічних частинок, зважених в рідині або газі. Воно було відкрито англійським ботаніком Р. Броуном в 1827 г. Броунівські частинки рухаються під впливом безладних ударів молекул. Через хаотичний тепловий рух молекул ці удари ніколи не врівноважують один одного. В результаті швидкість броунівської частинки безладно змінюється по модулю і напряму, а її траєкторія є складною зигзагоподібною кривою.
Броунівський рух в просторі Бро унівський рух — тепловий рух мікроскопічних частин, які знаходяться в газоподібному середовищі.
Дифузія - явище спонтанного проникнення молекул контактуючих речовин в міжмолекулярні проміжки кожної з них. Дифузію, що відбувається через напівпроникні перегородки, називають осмосом. Приклад дифузії в газах - виникнення запаху, у рідинах - переміщування рідин різної густини. Молекули золота і свинцю внаслідок дифузії протягом 5 років утворюють шар завтовшки 1 см. З підвищенням температури швидкість дифузії зростає. У природі дифузія сприяє живленню рослин з ґрунту. Без дифузії життя було б неможливим, адже насичення крові киснем і відведення шкідливих речовин - теж дифузія.
Ідеальний газ - це газ, в якому молекули можна вважати матеріальними точками, а силами притягання й відштовхування між молекулами можна знехтувати. У природі такого газу не існує, але близькими за властивостями можна вважати реальні розріджені гази, тиск в яких не перевищує 200 атм і які перебувають при не дуже низькій температурі, оскільки відстань за таких умов між молекулами набагато перевищує їх розміри. Нехай всередині посудини, площа стінки якої S міститься ідеальний одноманітний газ з молекулами масою m0 кожна, які хаотично рухаються зі швидкостями Ідеальний газ
Це рівняння встановлює зв'язок між тиском p ідеального газу, масою молекули m0, концентрацією молекул n, середнім значенням квадрата швидкості і середньою кінетичною енергією поступального руху молекул. Його називають основним рівнянням молекулярно-кінетичної теорії газів.
У молекулярно-кінетичній теорії кількість речовини прийнято вважати пропорційним числу частинок. Одиниця кількості речовини називається молем (моль). Моль – це кількість речовини, що містить стільки ж частинок (молекул), скільки міститься атомів в 0,012 кг вуглецю 12С. Молекула вуглецю складається з одного атома. Таким чином, в одному молі будь-якої речовини міститься одне і те ж число частинок (молекул). Це число називається сталою Авогадро NА: NА = 6,02·1023 моль–1. Стала Авогадро – одна з найважливіших сталих в молекулярно-кінетичній теорії. Кількість речовини υ визначається як відношення числа N частинок (молекул) речовини до постійної Авогадро NА:
Розглянемо випадок, коли в посудині знаходиться суміш хімічно не взаємодіючих газів, молекули яких мають різні маси. В стані рівноваги молекули різних газів матимуть однакові середні кінетичні енергії теплового руху, які визначаються тільки температурою суміші. Тиск суміші газів на стінки судини складатиметься з парціального тиску кожного газу: p = p1 + p2 + p3 + … = (n1 + n2 + n3 + …)kT. У цьому співвідношенні n1, n2, n3, … – концентрації молекул різних газів в суміші. Це співвідношення виражає експериментально встановлений на початку XIX століття закон Дальтона: тиск в суміші хімічно не взаємодіючих газів рівний сумі їх парціального тиску.
Співвідношення p = nkT, яке зв'язує тиск газу з його температурою і концентрацією молекул, одержаного для моделі ідеального газу, молекули якого взаємодіють між собою і із стінками судини тільки під час пружних зіткнень. Це співвідношення може бути записане в іншій формі, що встановлює зв'язок між макроскопічними параметрами газу – об'ємом V, тиском p, температурою T і кількістю речовини ν. Для цього потрібно використовувати рівність Де N – число молекул в посудині, NА – стала Авогадро, m – маса газу в посудині, M – молярна маса газу. У результаті одержимо: Добуток сталої Авогадро NА на k називається універсальною газовою сталою і позначається буквою R. Її чисельне значення в СІ є: R = 8,31 Дж/моль·К.
Рівняння, що встановлює зв'язок між тиском, об'ємом і температурою газу було одержано у середині XIX століття французьким фізиком Б.Клайпероном, у формі : Було вперше записане Д.І. Менделеєвим. Тому рівняння стану газу називається рівнянням Клапейрона–Менделєєва.
Газ може брати участь в різних теплових процесах, при яких можуть змінюватися всі параметри, що описують його стан (p, V і T). Якщо процес протікає достатньо повільно, то у будь-який момент система близька до свого рівноважного стану. Такі процеси називаються квазістатичними. Квазістатичні процеси можуть бути зображені на діаграмі станів (наприклад, в координатах p, V) у вигляді деякої траєкторії, кожна точка якої представляє рівноважний стан.
Ізотермічним процесом називають квазістатичний процес, що протікає при постійній температурі T. З рівняння (1.4.7) стану ідеального газу виходить, що при постійній температурі T і незмінній кількості речовини ν в судині добуток тиску p газу на його об'єм V повинен залишатися постійним: pV = const. Рівняння ізотермічного процесу було одержане з експерименту англійським фізиком Р.Бойлем (1662 р.) і незалежно французьким фізиком Е. Маріоттом (1676 р.). Тому це рівняння називають законом Бойля–Маріотта. Ізотермічний процес (T = const)
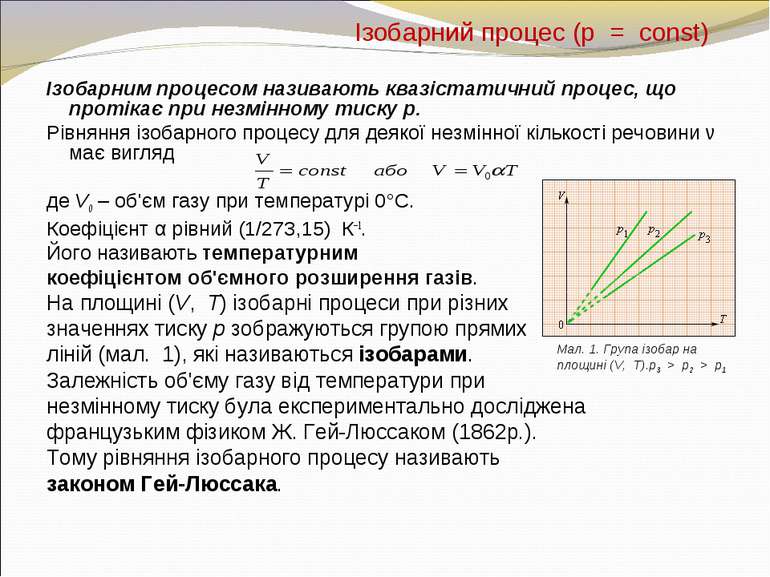
Ізобарний процес (p = const) Ізобарним процесом називають квазістатичний процес, що протікає при незмінному тиску p. Рівняння ізобарного процесу для деякої незмінної кількості речовини ν має вигляд де V0 – об'єм газу при температурі 0°С. Коефіцієнт α рівний (1/273,15) К–1. Його називають температурним коефіцієнтом об'ємного розширення газів. На площині (V, T) ізобарні процеси при різних значеннях тиску p зображуються групою прямих ліній (мал. 1), які називаються ізобарами. Залежність об'єму газу від температури при незмінному тиску була експериментально досліджена французьким фізиком Ж. Гей-Люссаком (1862р.). Тому рівняння ізобарного процесу називають законом Гей-Люссака. Мал. 1. Група ізобар на площині (V, T).p3 > p2 > p1
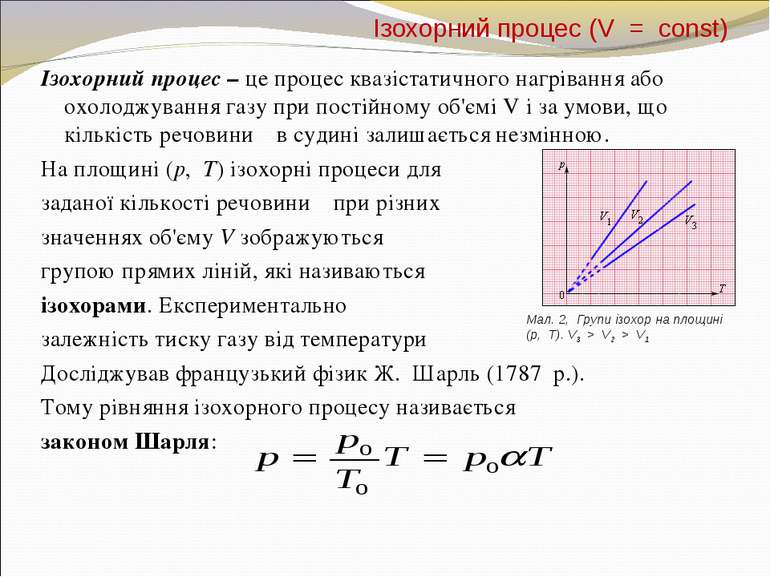
Ізохорний процес (V = const) Ізохорний процес – це процес квазістатичного нагрівання або охолоджування газу при постійному об'ємі V і за умови, що кількість речовини ν в судині залишається незмінною. На площині (p, T) ізохорні процеси для заданої кількості речовини ν при різних значеннях об'єму V зображуються групою прямих ліній, які називаються ізохорами. Експериментально залежність тиску газу від температури Досліджував французький фізик Ж. Шарль (1787 р.). Тому рівняння ізохорного процесу називається законом Шарля: Мал. 2, Групи ізохор на площині (p, T). V3 > V2 > V1
Теплові двигуни – це пристрої, що перетворюють енергію палива в механічну енергію. Робочим тілом у двигунів є газ, що робить роботу при розширенні. Види теплових двигунів: поршневі - у двигунах відбувається розширення газу, що тисне на поршень, змушуючи його переміщатися. турбінні - у турбодвигуні розширення газу діє на лопатки колеса турбіни, спричиняючи його обертання. Прикладами поршневих двигунів є парові машини і двигуни внутрішнього згорання (карбюраторні і дизельні).
Фазові переходи Фазовий перехід (фазовий перетворення) в термодинаміці - перехід речовини з однієї термодинамічної фази в іншу при зміні зовнішніх умов. З точки зору руху системи по фазовій діаграмі при зміні її інтенсивних параметрів (температури, тиску і т. п.), фазовий перехід відбувається, коли система перетинає лінію, що розділяє дві фази. Оскільки різні термодинамічні фази описуються різними рівняннями стану, завжди можна знайти величину, яка стрибкоподібно змінюється при фазовому переході.
Класифікація фазових переходів При фазовому переході першого роду міняються такі термодинамічні характеристики речовини, як щільність, концентрація компонент;у одиниці маси виділяється або поглинається сповна певна кількість теплоти, що носить назву теплоти переходу. Найбільш поширені приклади фазових переходів першого роду: плавлення і кристалізація; кипіння і конденсація; сублімація та десублімація.
При фазових переходах другого роду відбуваються без поглинання чи виділення тепла, при цьому щільність і концентрація змінюються безперервно. Найбільш поширені приклади фазових переходів другого роду: проходження системи через критичну точку; перехід металів і сплавів у стан надпровідності (параметр порядку - щільність надпровідного конденсату); перехід рідкого гелію в надтекучий стан; перехід аморфних матеріалів у склоподібний стан. Класифікація фазових переходів
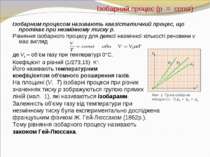
Тверді тіла Тверде тіло — агрегатний стан речовини, що характеризується стабільністю форми на відміну від інших агрегатних станів рідини та газу. Атоми твердих тіл більшість часу проводять в околі певних рівноважних положень, здійснюючи тільки незначні теплові коливання. За типом упорядкування атомів розрізняють кристалічні і аморфні тверді тіла. Кристали характеризуються наявністю просторової періодичності в розміщенні рівноважних положень коливань атомів, тобто наявністю кристалічної гратки. Атоми аморфних твердих тіл коливаються поблизу невпорядковано розміщених точок.
Схожі презентації
Категорії