Презентація на тему:
Хімічний склад біомембран
Завантажити презентацію
Хімічний склад біомембран
Завантажити презентаціюПрезентація по слайдам:
Біомембрани клітин Плазматична мембрана (ПМ) і набір внутрішньоклітинних мембран (ЕПР, апарат Гольджі, мембрани ядер, мітохондрій, лізосом, пероксисом, піно- і фагосом)
Компоненти біомембран Ліпіди – 30% Білки – 60% Вуглеводи – 10% (у вільному вигляді не зустрічаються – присутні як гліколіпіди, глікопротеїни; напр., рецептори є глікозильованими білками) Мінорні компоненти – НК, поліаміни, неорганічні іони Незамерзаюча зв язана вода – до 30% всієї ваги мембрани
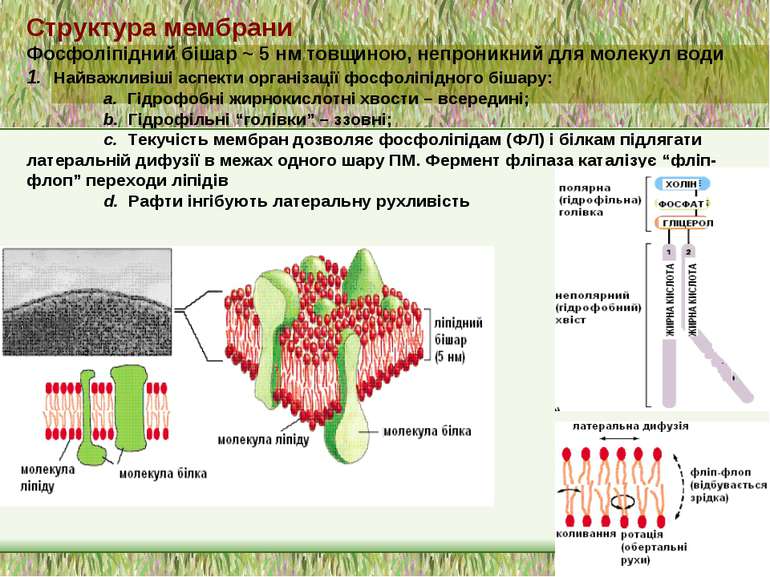
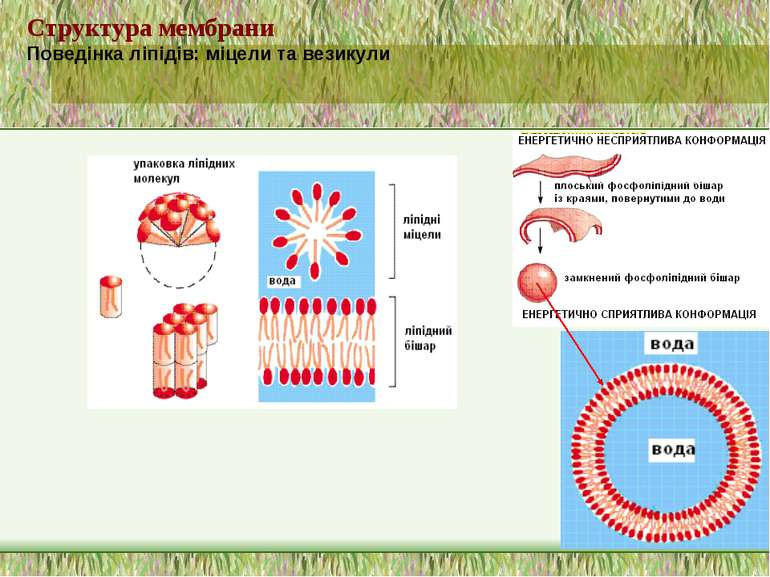
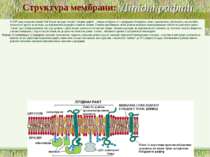
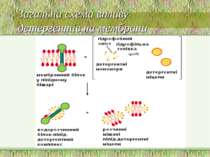
Структура мембрани Фосфоліпідний бішар ~ 5 нм товщиною, непроникний для молекул води 1. Найважливіші аспекти організації фосфоліпідного бішару: a. Гідрофобні жирнокислотні хвости – всередині; b. Гідрофільні “голівки” – ззовні; c. Текучість мембран дозволяє фосфоліпідам (ФЛ) і білкам підлягати латеральній дифузії в межах одного шару ПМ. Фермент фліпаза каталізує “фліп-флоп” переходи ліпідів d. Рафти інгібують латеральну рухливість
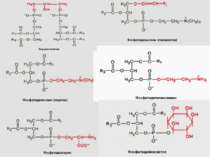
4 головних ФЛ (~50% of ліпідів мембрани); 1 мінорний ФЛ: a. фосфатидилхолін (ФХ) & сфінгомієлін (СМ) – головним чином зовнішній листок ПМ. b. фосфатидилетаноламін (ФЕ) & фосфатидилсерин (ФС) – внутрішній листок ПМ c. фосфатидилінозитол (ФІ) – мінорний компоненет внутрішнього листка ПМ, що є важливим для клітинної сигналізації d. ФС і ФІ – негативно заряджені, що надає негативного заряду внутрішньому листку ПМ Мембрана E. coli містить головним чином ФЕ і майже не містить ФХ, ФС, ФІ, СМ, або холестеролу) Гліколіпіди: ~2 % ліпідів ПМ; виключно у зовнішньому листку ПМ Холестерол: в середньому – до 30 % всіх ліпідів ПМ Структура мембрани 2. Фосфоліпідний склад плазматичної мембрани ссавців:
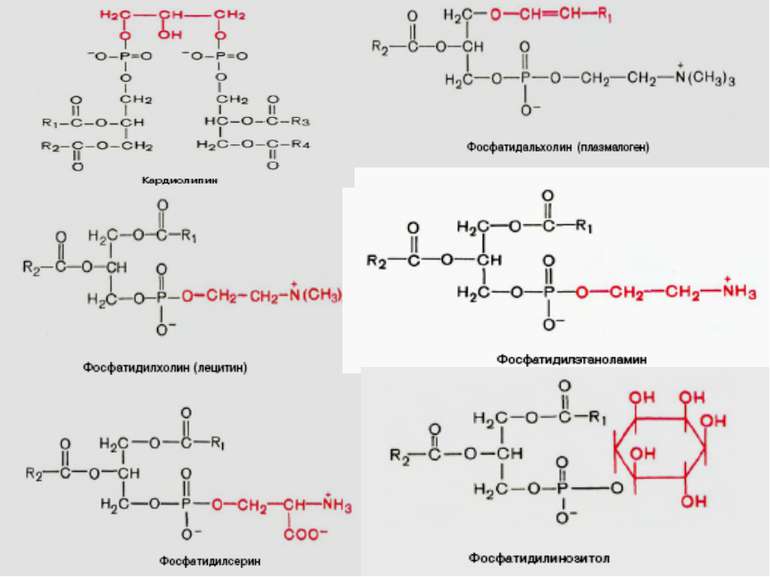
Ліпіди мембран: фосфоліпіди Фосфоліпіди поділяються на 2 підгрупи – гліцерофосфоліпіди й сфінгофосфоліпіди Гліцерофосфоліпіди – похідні фосфатидної кислоти (фосфатидилхоліни, фосфатидилетаноламіни, фосфатидилсерини, фосфатидилінозитоли, кардіоліпіни, плазмалогени), до складу яких входять жирні кислоти із парною кількістю атомів вуглецю, напр., С16, С18, С20 – насичені й ненасичені. Найпоширеніші – перші чотири; кардіоліпін характерний для мембран бактерій та внутрішньої мітохондріальної мембрани Структура мембрани
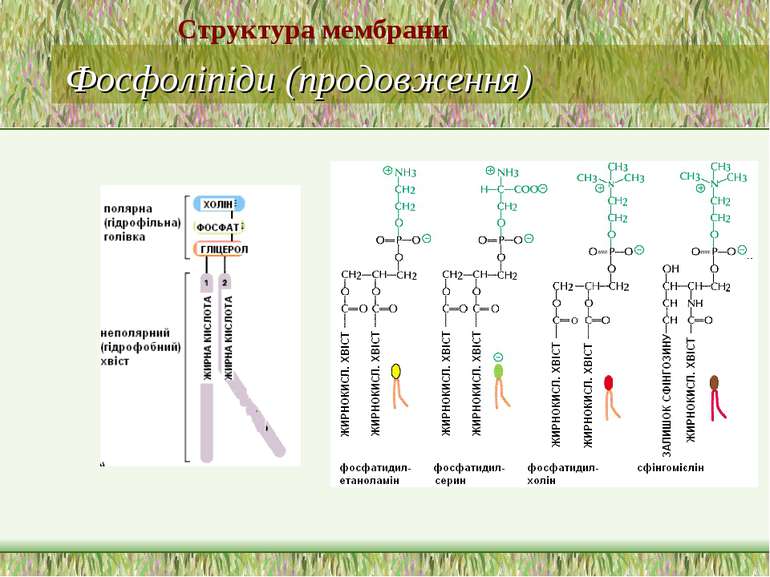
Фосфоліпіди (продовження) В основі молекули сфінгофосфоліпідів – не гліцерол, а сфінгозин; основний представник – сфінгомієлін; в мембранах мітохондрій він відсутній Структура мембрани
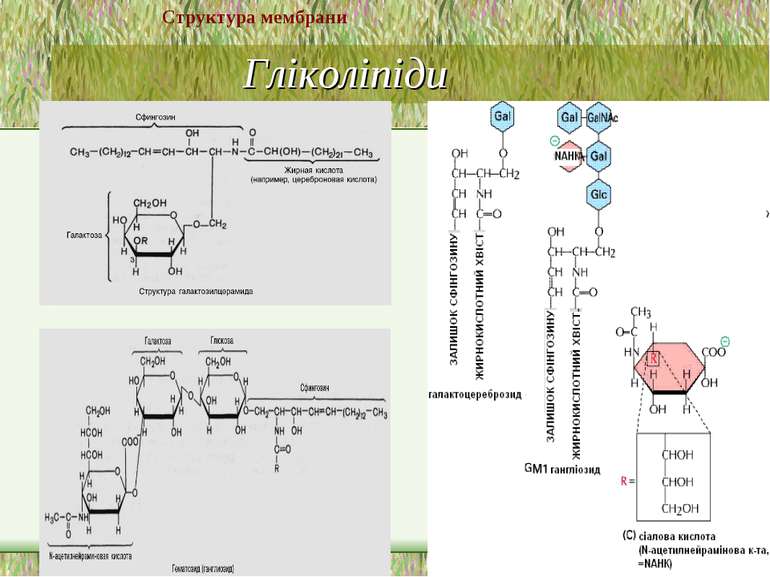
Гліколіпіди 2 підгрупи: глікогліцеролліпіди й глікосфінголіпіди Глікогліцеролліпіди – в 3-му положенні гліцеролу не залишок фосфорної к-ти (як у гліцерофосфоліпідів), а залишок вуглеводу, напр., галактоза. Вони поширені у синьозелених водоростей і ціанобактерій, а також зустрічаються у хлоропластах (напр., діацилгалактозилгліцерид) Глікосфінголіпіди – містять церамід (сфінгозин +жирна кислота) й 1 чи кілька залишків моносахаридів; найпростіші з них – це цереброзиди, напр., галактозилцерамід (галактоцереброзид) й глюкозилцерамід (глюкоцереброзид). Найскладнішу будову мають гангліозиди – їх можна розглядати як похідні цереброзидів, що мають 1 чи кілька залишків сіалової кислоти (у людини – N-ацетилнейрамінової), а замість 1-го залишка моносахариду – олігосахарид. Також є сульфоцереброзиди (або сульфатиди - складні ефіри цереброзида й сірчаної к-ти; зв язок – через третій атом С гексози), глобозиди (або церамідполігексозиди – в молекулі містять не 1 залишок моносахариду, а 2 і більше Гліколіпідів найбільше (особливо цереброзидсульфатів) в мієліновій оболонці й ПМ мікроворсинок кишечника Структура мембрани
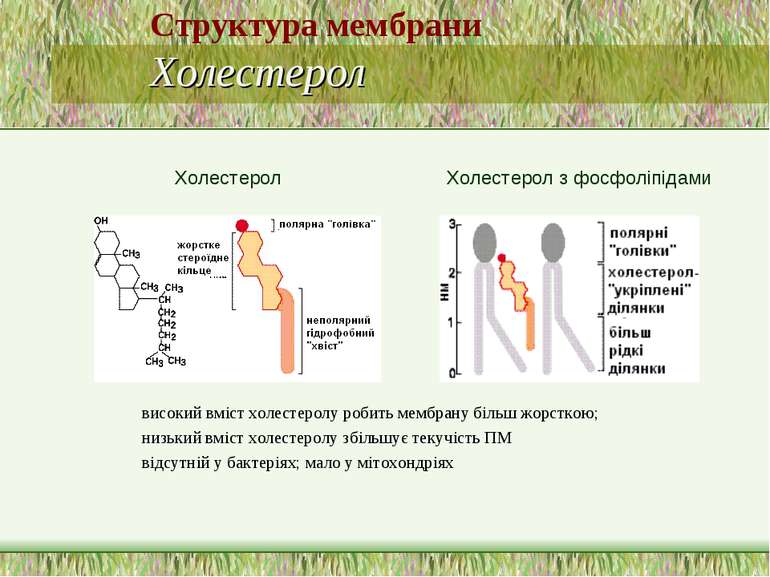
Структура мембрани Холестерол високий вміст холестеролу робить мембрану більш жорсткою; низький вміст холестеролу збільшує текучість ПМ відсутній у бактеріях; мало у мітохондріях Холестерол Холестерол з фосфоліпідами
Особливості ліпідного складу мембран Менш функціонально активні мембрани містять менше білків (напр., мієлін – до 80% ліпідів і лише 1 білок ліпофілін) Більш функціонально активні мембрани – більше білків Плазматичні мембрани різних типів клітин також різняться між собою, наприклад: Структура мембрани
Мінорні ліпідні компоненти мембран Токофероли Убіхінони та ін. хінони 7-кетохолестерол Ретинол ДАГ Моноацилгліцерол Вільні жирні кислоти (зокрема, арахідонова – попередник ейкозаноїдів) Структура мембрани
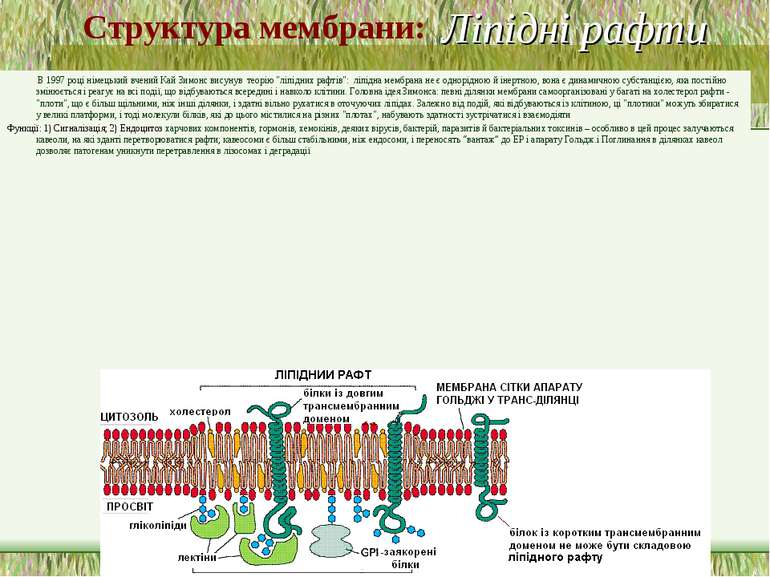
Ліпідні рафти В 1997 році німецький вчений Кай Зимонс висунув теорію "ліпідних рафтів": ліпідна мембрана не є однорідною й інертною, вона є динамичною субстанцією, яка постійно змінюється і реагує на всі події, що відбуваються всередині і навколо клітини. Головна ідея Зимонса: певні ділянки мембрани самоорганізовані у багаті на холестерол рафти - "плоти", що є більш щільними, ніж інші ділянки, і здатні вільно рухатися в оточуючих ліпідах. Залежно від подій, які відбуваються із клітиною, ці "плотики" можуть збиратися у великі платформи, і тоді молекули білків, які до цього містилися на різних "плотах", набувають здатності зустрічатися і взаємодіяти Функції: 1) Сигналізація; 2) Ендоцитоз харчових компонентів, гормонів, хемокінів, деяких вірусів, бактерій, паразитів й бактеріальних токсинів – особливо в цей процес залучаються кавеоли, на які зданті перетворюватися рафти; кавеосоми є більш стабільними, ніж ендосоми, і переносять “вантаж” до ЕР і апарату Гольдж.і Поглинання в ділянках кавеол дозволяє патогенам уникнути перетравлення в лізосомах і деградації Структура мембрани:
Ліпідні рафти (продовження) Ліпідний рафт (досл. ліпідний плот, англ. lipid raft) — мікродомен ліпідного бішару ПМ, багатий на холестерол, сфінголіпіди і насичені фосфоліпіди (асоціація із ділянкою щільноупакованого ліпіду, що «плаває» на поверхні «рідкого» фосфоліпіду (звідси назва ліпідний плот). Ліпідний рафт відносно нерозчинний у оточуючому ліпіді, є достатньо гетерогенною і нестабільною структурою (50 - 200 нм). Вбудовування специфічних мембранних білків у ліпідний рафт спричиняє його стабілізацію, а наступне зв язування лігандів із рецепторами або глікосфінголіпідами, що розташовані у таких рафтах, запускає передачу внутрішньоклітинного сигналу. Ліпідні рафти стійкі до обробки неіонним детергентом Тритоном X-100 за низкої температури (+4°C). При цьому ліпідна мембрана, що є у рідкій невпорядкованій фазі, розчиняється, а мембрана у рідкій впорядкованій фазі (тобто у ділянці рафти) зберігає свою цілісність. В той же час, обробка мембрани циклодекстраном, що специфічно зв язує холестерол і видаляє його із ліпідної мембрани, спричиняє розчинення рафту в оточуючих фосфоліпідах і підкреслює важливість холестеролу для утворення рафта Деякі білки специфічно локалізуються у ліпідних рафтах (тирозинкінази родини Src, трансмембранні білки, тощо). Інші білки приєднуються до рафту лише після активування (рецепторы Т-клітин, рецепторы B-клітин, CD39 , тощо). В той же час деякі білки взагалі не можуть бути присутніми у рафтах, і щоб забезпечити їх взаємодію із білками-компонентами рафт, клітина руйнує частину рафтів і звільнює необхідні білки Структура мембрани:
Ліпідні рафти: медичні аспекти Для молекулярної медицини рафти стали ланкою, якої не вистачало для розуміння механизмів розвитку багатьох захворювань. Напр., виявилося, що віруси (у т. ч. й вірус СНІДу) вибирають своєю мішенню у клітинній мембрані саме ліпідні "плоти" і звідти розпочинають своє проникнення у клітину. Пріонові і нейродегенеративні захворювання теж залучають ділянки рафтів.
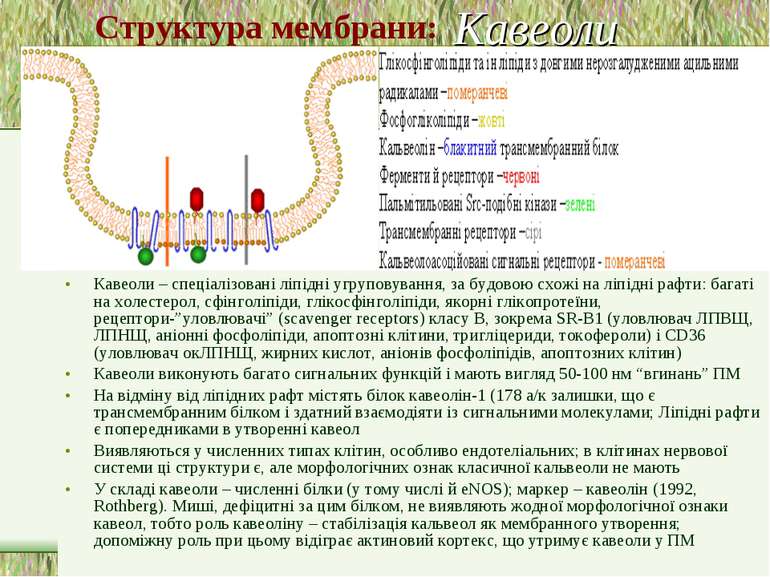
Кавеоли – спеціалізовані ліпідні угруповування, за будовою схожі на ліпідні рафти: багаті на холестерол, сфінголіпіди, глікосфінголіпіди, якорні глікопротеїни, рецептори-”уловлювачі” (scavenger receptors) класу В, зокрема SR-B1 (уловлювач ЛПВЩ, ЛПНЩ, аніонні фосфоліпіди, апоптозні клітини, тригліцериди, токофероли) і CD36 (уловлювач окЛПНЩ, жирних кислот, аніонів фосфоліпідів, апоптозних клітин) Кавеоли виконують багато сигнальних функцій і мають вигляд 50-100 нм “вгинань” ПМ На відміну від ліпідних рафт містять білок кавеолін-1 (178 а/к залишки, що є трансмембранним білком і здатний взаємодіяти із сигнальними молекулами; Ліпідні рафти є попередниками в утворенні кавеол Виявляються у численних типах клітин, особливо ендотеліальних; в клітинах нервової системи ці структури є, але морфологічних ознак класичної кальвеоли не мають У складі кавеоли – численні білки (у тому числі й eNOS); маркер – кавеолін (1992, Rothberg). Миші, дефіцитні за цим білком, не виявляють жодної морфологічної ознаки кавеол, тобто роль кавеоліну – стабілізація кальвеол як мембранного утворення; допоміжну роль при цьому відіграє актиновий кортекс, що утримує кавеоли у ПМ Кавеоли Структура мембрани:
Властивості мембран Замкненість; Текучість: залежить від: - кількості ліпідів на одиницю площини; - співвідношення насичених і ненасичених жирних кислот (зі збільшенням вмісту ненасичених ЖК текучісь зростає, т.я. наявність подвійних зв язків сприяє порушенню напівкристалічної мембранної структури); - довжини жирних кислот; - температури; - концентрації холестеролу; Асиметричність: зовнішній шар – фосфатидилхолін, сфінгомієлін, гліколіпіди, холестерол; внутрішній шар – фосфатидилсерин, кефалін, фосфатидилінозитол, холестерол Вибіркова проникність;
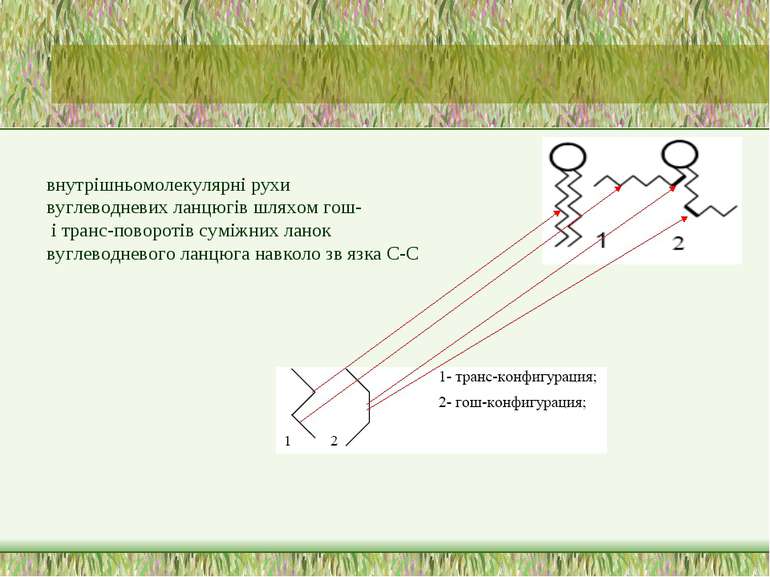
Властивості мембран: динаміка ліпідів Динамічні властивості біологічних мембран зумовлені текучістю ліпідного бішару. У випадку ліпідів великий вклад у рухливість дають внутрішньомолекулярні рухи вуглеводневих ланцюгів шляхом гош- і транс-поворотів суміжних ланок вуглеводневого ланцюга навколо зв язка С-С. При цьому в ланцюзі постійно виникають згини, що спричиняє порушення регулярного розташування ліпідних молекул у бішарі і появу дефектів упаковки бішару – “кінків” і “джоггів” (рис – наступні два слайди) Різні ділянки ліпідної молекули у складі бішару мають різну рухливість. Найменша – у гліцеринового остову молекули (він служить жорстким “якорем”, що обмежує рух прилеглих ділянок вуглеводневих ланцюгів). По мірі наближення до середини бішару рухливість ланцюгів зростає і стає максимальною в ділянці кінцевих метильних груп. Доволі високою рухливістю також володіє полярна голівка ліпідної молекули Окрім руху окремих частин молекули, в бішарі також спостерігаються рухи молекули як єдиного цілого: обертання навколо вісі; маятникоподібні і поплавецьподібні коливання молекули відносно її рівноважного положення у бішарі; латеральна дифузія в межах моношару; фліп-флоп-переходи. Всі ці рухи мають різну швидкість. Обертання навколо вісі – дуже швидко (частота порядка 107-108 об/с-1); латеральна дифузія - набагато повільніше (в сер. 10-8см/с-1); дуже повільно - фліп-флоп (пнапівперіод – величина порядку кількох годин/днів). Але в деяких мембранах швидкість флип-флопа значно вища (напівперіод 1-2 хв), что пов язано із залученням певних інтегральних білків у перенос ліпідних молекул через мембрану. Виключенням із всіх ліпідів складає холестерол, що може легко переходити з одного шару мембрани на інший. Іммобілізація (зупинка руху) ліпідів може відбуватися при їх взаємодії з білками: інтегральні біки оточені пограничним шаром ліпідних молекул (т. наз. аннулярні ліпіди), рухливість яких обмежена або хоча б порушена в результаті контакту з неровною поверхнею білкової глобули
внутрішньомолекулярні рухи вуглеводневих ланцюгів шляхом гош- і транс-поворотів суміжних ланок вуглеводневого ланцюга навколо зв язка С-С
Можливість змін конфігурації ланцюгів жирних кислот має велике значення для розчинення у ліпідному шарі і переноса через нього різних молекул й іонів. Іон потрапляє в порожнину всередині ліпідного бішару, що утворюється за рахунок відповідних вигинів оточуючих ланцюгів жирних кислот. Така порожнина має назву «кінк» (англ. kink - петля, вигин). Кінки утворюються в результаті теплового руху молекул, й іон може переміщуватися в ліпідному шарі мембрани, перескокуючи із одного кінку в сусідній:
Білкові компоненти структури мембран За локалізацією: Інтегральні (помпи, канали); Частково занурені (“заякорені”); Периферійні (розташовані з зовнішнього або цитоплазматичного боку мембрани); Мембранні білки є гідрофобними і тому легко вбудовуються у фосфоліпідний бішар Окрім мембранних і цитоплазматичних білків є група т.зв. амфітропних білків, здатних існувати і у вільному, і у мембранозв язаному стані. Найчастіше такі білки локалізовані у цитоскелеті; сигналом для їх вбудовування у мембрани стає модифікація шляхом ацилювання – нековалентного приєднання жирних кислот або дигліцеридів За функціями: білки-ферменти (інтегральні – АТФази; периферійні - ацетилхолінестераза, ЛФ, КФ, РНКаза); Білки-рецептори (як інтегральні, так і периферійні); Структурні білки; Транспортні білки Структура мембрани:
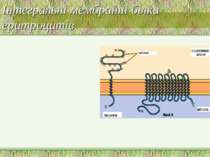
Інтегральні і периферійні білки На поверхні периферійних білків залишки гідрофільних амінокислот розташовані на поверхні білкової глобули. Периферійні білки (спектрин – головний білок цитоскелкту еритроцитів, на внутрішній м-ні; фібронектин-на зовнішній) утримуються на поверхні мембрани іонними і водневими зв язками між ними та інтегральними білками і тому не міцно зв язані із мембранами. Завдяки цьому периферійні білки легко відокремлюються від мембрани за дії сольових розчинів (екстракція карбонатами), зміни рН (рН 10) і т.д., а також за дії детергентів середньої сили Інтегральні білки (глікофорин, бактеріородопсин) мають великі гідрофобні ділянки, розташовані всередині мембрани. Вважається, що трансмембранні ділянки є структурами типу α-спіралі. Такі білки можна виділити з мембрани тільки шляхом її руйнування за допомогою екстракції детергентами або органічними розчинниками Деякі інтегральні білки є компонентами олігомерних комплексів (білок-білкові взаємодії) – напр., Н+-АТФаза/АТФ-синтаза внутрішньої мембрани мітохондрій, Na+, К+-АТФаза ПМ, Н+, К+-АТФаза слизової оболонки кишечнику. Ступінь олігомеризації мембранних білків важлива для існування їх різної активності за різних функціональних станів клітини Шляхом взаємодії інтегральних і периферійних білків реалізуються механізми регуляції білкових функцій (напр., активності ферментів) “Заякорені” білки утримуються в мембрані завдяки наявності ковалентно приєднаного ліпідного або гліколіпідного “якоря”. Для їх виділення застосовують детергенти або ферменти, що здійснюють лізис ліпідного “якоря”. Структура мембрани:
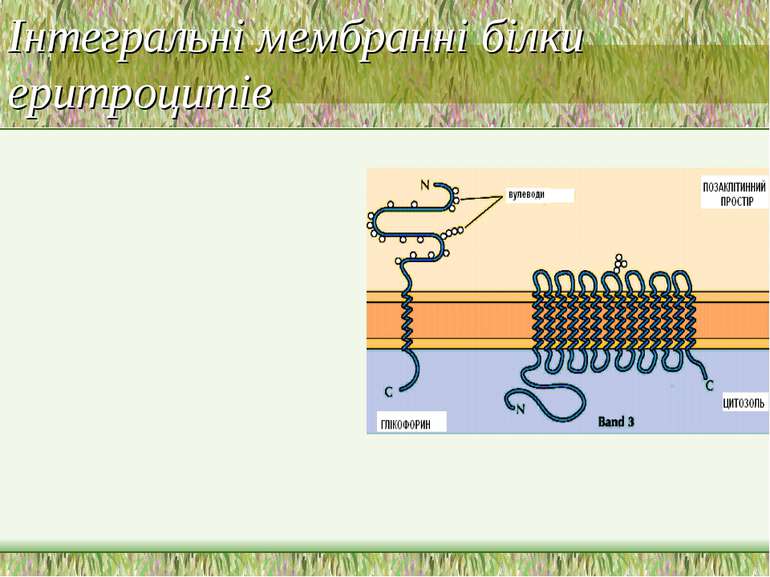
Приклади мембранних білків еритроцитів Інтегральні білки: Band 3 Глікофорин A Периферійні білки: анкірин Band 4.1 актин спектрин
Взаємодія білка із ліпідним бішаром: стадії 1) адсорбція білка на поверхні бішару; 2) це змінює конформацію білкової молекули і індукує виникнення гідрофобного контакту між білком і ацильними ланцюгами фосфоліпідів 3) Надалі білок вбудовується у бішар, причому глибина такого вбудовування залежить від сили гідрофобних взаємодій і від співвідношення гідрофобних і гідрофільних ділянок на поверхні білкової глобули, побудованих із відповідно гідрофобних і гідрофільних амінокислот. Білкова молекула інтегрального білка фіксується у бішарі за допомогою : - електростатичних сил (на рівні полярних голівок фосфоліпідів; гідрофобних взаємодій (у товщині бішару) Інтегральні білки тісно зв язані з мембранним бішаром, і зміна стану цих білків передається на оточуючі їх ліпіди. Шар ліпідів, який безпосередньо примикає до білка, має назву шару пограничних або анулярних ліпідів. Периферійні білки мембран відрізняються від інтегральних меншою глибиною проникнення у бішар і більш слабкими білок-ліпідними взаємодіями Структура мембрани:
Динаміка мембранних білків Внутрішньомолекулярна динаміка мембранних білків вивчена менше, ніж ліпідів. Лише відомо, що бічні замісники на тих ділянках поліпептидного ланцюга, які розташовані всередині ліпідного бішару, значною мірою іммобілізовані. Численні мембранні білки здатні легко дифундувати вздовж мембрани і мають досить високу обертальну рухливість. Але коефіцієнти дифузії навіть у найрухливіших білків приблизно на порядок нижче, ніж у ліпідних молекул. Швидка дифузія білків вздовж мембрани спостерігається лише у рідиннокристалічному бішарі, в гелевій фазі білки не мігрують. Мобільными є 20-50% мембранних білків, інші мають обмежену рухливість або зовсім нерухомі. Причиною іммобілізації інтегральних білків у мембрані може бути їх асоціація з утворенням крупних агрегатів або навіть двовимірних кристалічних структур, взаємодія із периферійними білками, зв язування із елементами цитоскелету і т.п.
Способи прикріплення білків до мембрани Периферійні білки (або периферійні субодиниці інтегральних білків): Зв язування із білками, зануреними у бішар (АТФ-синтаза: F0 с/о занурена у бішар, а F1 – кріпиться до неї); Зв язування із поверхнею бішару (електростатична чи гідрофобна природа) – приклади: відповідно основний білок мієліну і фосфоліпаза С. “Заякорені білки (рисунок): Зв язування за допомогою гідрофобного “якоря” (“якір” – це послідовність неполярних амінокислот – напр., у цитохрому b5, або в деяких випадках – ковалентно зв язані з білками жирні кислоти (пальмітилювання чи міристилювання білка)) Трансмебранні білки перетинають мембрану один (глікофорин) або кілька разів (лактозопермеаза, бактеріородопсин) 1.Інтегральний монотопний білок, α-спіральний домен якого пронизує мембрану. 2. Інтегральний політопний білок, що пронизує мембрану кілька разів. 3. «Заякорений» білок, приєднаний до мембрани через жирну кислоту. 4,5. Периферійні білки не мають гідрофобних ділянок, а містять заряджені частини, що взаємодіть з іншими білками (5) або фосфатними групами фосфоліпідів (4) Структура мембрани:
Способи обмеження рухливості білків у мембрані Утворення надмолекулярного комплекса; Сполучення мембранних білків із підмембранною сіткою білків; Сполучення з інтегральними білками іншої мембрани
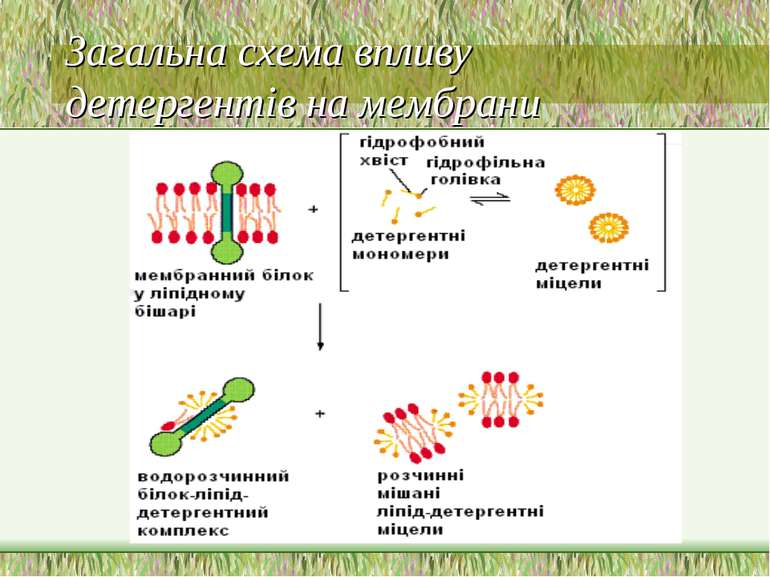
Виділення мембранних білків Мембранні білки є нерозчинними у воді і погано розчиняються у органічних розчинниках Першим етапом виділення мембранних білків є вибір біологічного джерела і виділення мембранної фракції, збагаченої на даний білок Наступне виділення мембранних білків пов язане з їх солюбілізацією – переходом у розчинену форму. Периферійні білки солюбілізуються легко, без порушення цілісності мембрани. Виділення інтегральних білків потребує руйнування мембрани. Про солюбілізацію судять по появі білка або відповідної біологічної активності в надосадовій рідині після високошвидкісного центрифугування (1 год, 105 000 g) – за цих умов осаджується більшість мембран. Інші критерії солюбілізації: гель-фільтрація на носіях з великими розмірами пор; електронна мікроскопія; спектетрофотометричні методи (при солюбілізації зменшується мутність розчину і відповідно розсіювання світла досліджувальним зразком); 31Р-ЯМР (широкий ЯМР-сигнал, характерний для фосфоліпідів у складі мембран, перетворюється на вузький пік, який утворюють фосфоліпіди в міцелах Для відокремлення білків від ліпідного оточення застосовують детергенти (напр., TWIN-8, TRITON X100). Детергенти – це амфіпатичні молекули, що містять полярні групи (“голівка”) і довгий вуглеводневий гідрофобний ланцюг (“хвіст”). У воді утворюють міцели. У складі міцел здатні солюбілізувати у воді гідрофобні структури. Детергент не повинний порушувати вторинну і третинну структури білка. Т.я. білкова молекула контактує своїми гідрофобними ділянками з гідрофобними ліпідними участками мембрани, детергент повинен замістити ці гідрофобні ліпідні ділянки з утворенням білково-детергентної міцели. Білки вбудовуються у такі міцели за допомогою гідрофобних взаємодій, а сам детергент копіює ліпідне бішарове оточення білка Далі білково-детергентну міцелу треба розділити, т.я. детергент буде впливати на властивості білка (заряд, електрофоретичну рухливість). Для цього застосовують діаліз – при цьому певна частина молекул детергенту відокремлюється. Якщо цього не можна зробити за допомогою діалізу, існують специфічні смоли, які дозволяють відокремити білок від детергенту
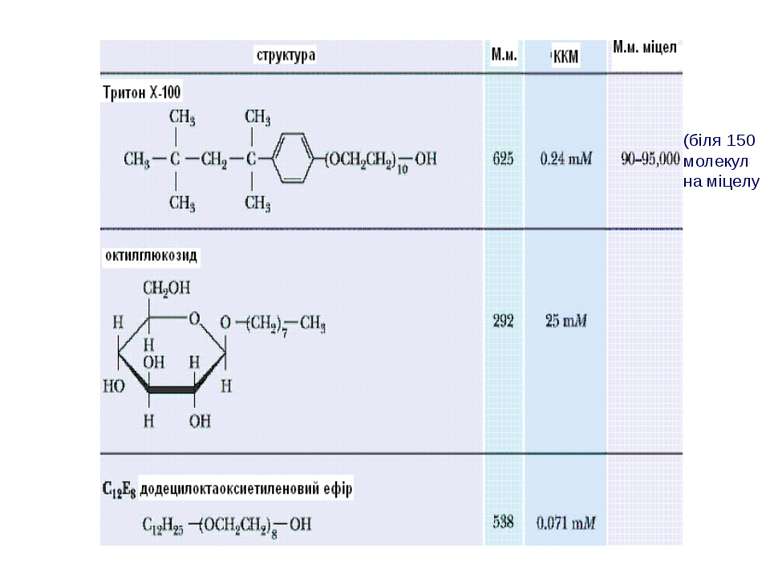
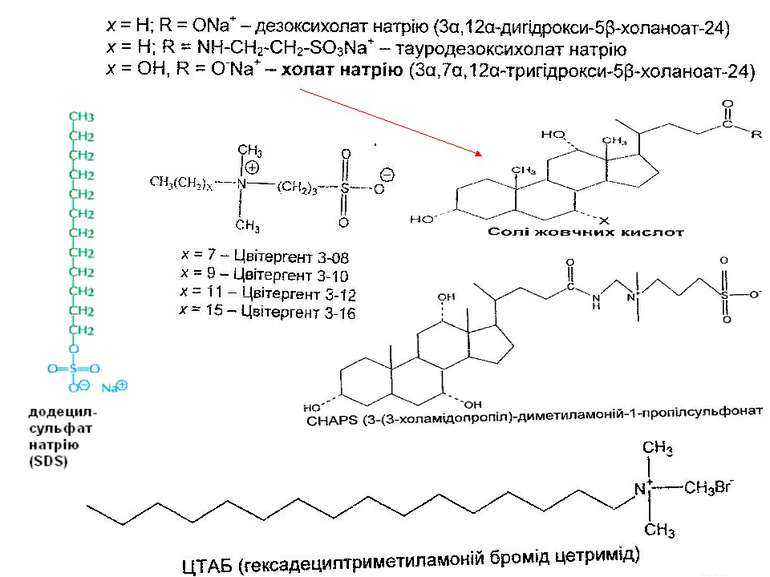
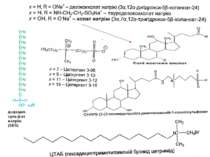
Класифікація детергентів За природою групи гідрофільної голівки: - іонні (катіонні, аніонні – “голівка” містить заряджені групи. Приклади: солі жовчних кислот – холат, дезоксихолат (аніонний детергент – є карбоксильна група і гідроксильні групи); додецилсульфат натрію (SDS, аніонний – сульфатна група); алкілтриметиламонієві солі (катіонний – триметиламонієва група); ЦТАБ (цетилтриметил-1-амоній бромід – катіонний – триметиламонієва група). Крім “голівки”, містять вуглеводневий ланцюг (SDS, ЦТАБ) або жорстке стероїдне ядро (дезоксихолат натрію). Денатуруючі. - неіонні – октил-β-D-глюкопіранозид (октилглюкозид) і поліоксиетиленові похідні типу тритону Х-100, лубролу РХ, твінів. Вони в голівці мають незаряджені гідрофільні групи, що містять поліоксиетиленові компоненти (BRIJ, тритон) або глікозидні групи (октилглюкозид, додецилмальтозид). Детергенти цієї групи краще придатні для руйнування ліпід-ліпідних і ліпід-білкових взаємодій, ніж білок-білкових. Тому вони вважаються неденатуруючими і широко використовуються для виділення мембранних білків у біологічно активній формі - цвітер-іонні (CHAPS – 3[(3-холамідопропіл)-диметиламоній]-1-пропансульфонат; цвітергент серії 3-Х; ). Мають властивості як іонних, так і неіонних детергентів: як і неіонні, не несуть електричного заряду, їм не властиві електропровідність і електрофоретична рухливість, вони не зв язуються із іонообмінними смолами; як і іонні, є ефективними для руйнування білок-білкових взаємодій Виділення мембранних білків:
Типи детергентів, які використовуються найчастіше Неіонні - TRITON X100, октилглюкозид Іонні – солі жовчних кислот (холат, дезоксихолат) Цвіттер-іонні детергенти – CHAPS, цвітергент
Стадії солюбілізації компонентів біомембран за допомогою детергентів За низьких концентрацій детергенти зв язуються із мембраною і деструктурують ліпідний бішар За вищих концентрацій, коли бішари насичені детергентами, мембрана дезінтегрується з утворенням мішаних міцел, в яких гідрофобні ділянки мембранних білків оточені гідрофобними ланцюгами міцел На кінцевих стадіях солюбілізація компонентів мембран зумовлює формування мішаних міцел, що складаются із ліпідів та детергентів, та детергентних міцел із включеними в них білками (звичайно 1 білок на міцелу) При застосуванні проміжних концентрацій можливі інші комбінації міцел, напр., ліпід-білок-детергент Міцели, що містять комплекси білок-детергент, можна відокремити від інших міцел за їх зарядом, розміром і густиною
Вибір детергенту Щоб отримати 100%-ву солюбілізацію (критерій - поява білка або відповідної біологічної активності в надосадовій рідині після високошвидкісного центрифугування (1 год, 105 000 g); Щоб білок був у нативній формі (напр., якщо білок є ферментом, паралельно контролюють рівень ферментативної активності) – щоб при виділенні не порушувалася вторинна і третинна структури білка; Щоб білок був стабільний – із цією метою іноді додають екзогенні фосфоліпіди (напр., при виділенні лактозопермеази) і для запобігання протеолізу – інгібітори протеаз Щоб легко відокремлювався від білка, напр., за допомогою діалізу; Залежно від мети (напр., якщо надалі будуть проводити іонообмінну хроматографію, то треба враховувати заряд детергенту. А при рН
В той же час, вибір детергенту, найбільш придатного для солюбілізаціїі очищення певного мембранного білка, як і раніше, насьогодні здійснюється методом спроб і помилок
Видалення детергенту і ліпідних домішок Методи видалення детергенту базуються на їх властивостях: гідрофобності, ККМ, заряді. Залишковий вміст детергенту повинен бути в 100 разів нижчим від вихідного рівня. Гідрофобна адсорбція – пов язана зі здатністю детергентів зв язуватия із гідрофобними смолами (напр., CalbiosorbТМ Adsorbent “Calbiochem”); придатна для більшості детергентів. Сорбент із зв язаним детергентом видаляють центрифугуванням або методом гель-фільтрації Діаліз – найпоширеніший метод для видалення детергентів із високою ККМ. Недоліки – довга тривалість, тривалий контакт детергенту і білка, що виділяється; Переваги – простота. Гель-хроматографія – для розділення за розміром білково-детергентних, детергентно-ліпідних і гомогенних детергентних міцел. Перевага – швидкість; але малопридатний за наявності великої кількості зразків Іонообмінна хроматографія – використовується різниця зарядів між білково-детергентними і вільними від білка детергентними міцелами Для видалення із мішаних міцел домішок фосфоліпідів, особливо при їх міцному зв язуванні, використовують їх екстракцію органічними розчинниками (хлороформ, суміш хлороформу з метанолом, етанолом або бутанолом, 1-бутанол, суміш діетилового ефіру з етанолом); денатурацію білка за допомогою SDS чи органічних розчинників. Надалі органічний розчинник видаляють випаровуванням (за допомогою роторного випарнику) або здійснюють осадження білків Виділення мембранних білків:
Після виділення мембранних білків зазвичай проводять їх фракціонування за допомогою звичайних хроматографічних і електрофоретичних методів, імуноафінного методу із застосуванням моноклональних антитіл. Для білка окремої фракції надалі можна застосувати всі відомі аналітичні методи вивчення його структури – встановити амінокислотний склад, визначити N- та С-кінцеві залишки, вміст вуглеводів, первинну структуру тощо
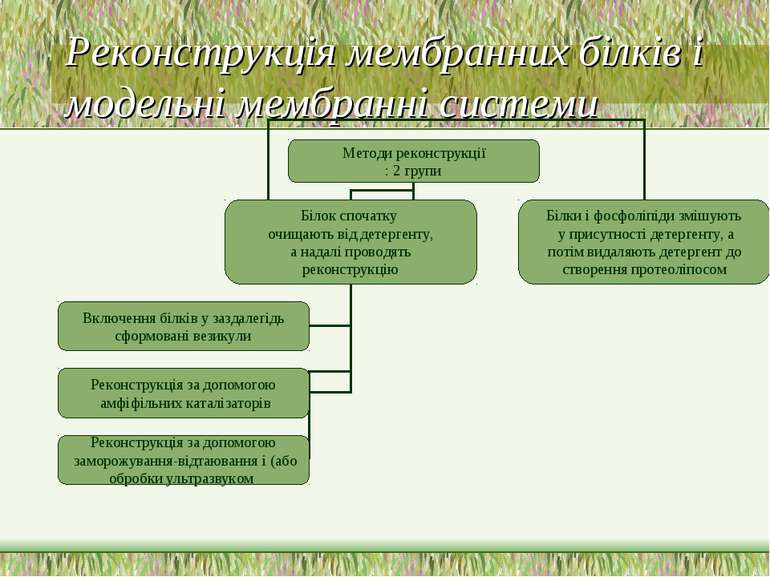
Реконструкція мембранних білків і модельні мембранні системи Проводиться з метою дослідження функціонування виділених мембранних білків Можлива реконструкція мембранних білків у бішарові везикули (ліпосоми) або у плоский бішар. Перевага останніх – плоскі бішари зручні для електрохімічних вимірювань, які дозволяють визначити величину іонної провідності, залежність частки відкритих каналів від прикладеної електричної напруги, тощо. В той же час біохімічні характеристики білка – напр., каталітичну активність – за допомогою плоских бішарів дослідити не можна Вимоги до везикул: Продуктом реконструкції повинна стати суспензія моноламелярних везикул одного розміру із однаковим білок/ліпідним співвідношенням Везикулярний бішар повинний мати таку ж проникність, як і нативна мембрана Везикули не повинні містити залишків детергенту Мембранні білки повинні бути вмонтовані у бішар в такій орієнтації, як і в нативній мембрані Бішар повинний мати певний склад, необхідний для збереження функціональної активності, притаманної нативному білку Використання реконструйованих систем дозволяє не тільки охарактеризувати ізольовану систему, але й визначити мінімальну кількість компонентів, необхідних для прояву тих чи інших біохімічних властивостей. Зокрема, так було встановлено склад системи аденілатциклазної гормональної відповіді і існування єдиного білка лактозопермеази, що відповідає за поглинання лактози клітинами E.coli. Для реконструкції беруть мішані міцели, що складаються із очищеного білка, детергенту й ліпіду; іноді до білок-детергентних міцел додають ліпід, напр., у вигляді ліпід-детергентних міцел
Моношари на межі розподілу фаз повітря/вода Шар товщиною в 1 молекулу Полярні голівки – до води; гідрофобні “хвости” – до повітря Найлегший спосіб отримання моношару: на водну поверхню нанести краплину органічного розчинника з ліпідом і дати час розчиннику випаритися Коли площина розподілу фаз зменшується за допомогою рухомого обмежувача, молекули спочатку спресовуються, а надалі моношар руйнується: прошарки молекул “наповзають” один на одний і моношар стає невпорядкованим Фосфоліпідні моношари вивчають за допомогою ванн (кювет) Легмюра. Для цього певна кількість ліпіду у летому розчиннику наноситься на водну поверхню. З одного боку кювети розташований рухливий поплавець, що дозволяє вимірювати площу поверхні, на якій утворився моношар Модельні мембранні системи: Використовується для виміру площі поверхні (А) і поверхневого тиску (π) моношару Перевага методу: зазначені параметри можна змінювати – том метод можна застосувати для вивчення поверхнево-активних ліпідів, а також ферментів, що функціонують на межі розподілу фаз ліпід-вода (напр., ліпази) Система малопридатна для вивчення поведінки мембранних інтегральних білків, хоча у моношар можна включати білки
Моношари на твердій основі Моношари, отримані на межі розподілу повітря/вода, можна перенести на тверду основу – напр., алкільоване предметне скло (за рахунок алкілування поверхні скла стає гідрофобною) Для цього досить торкнутися склом моношару В цьому випадку полярні “головки” контактують із водою Динамічні властивості і термодинамічні харатеристики моношарів обох типів близькі до відповідних значень для бішарів
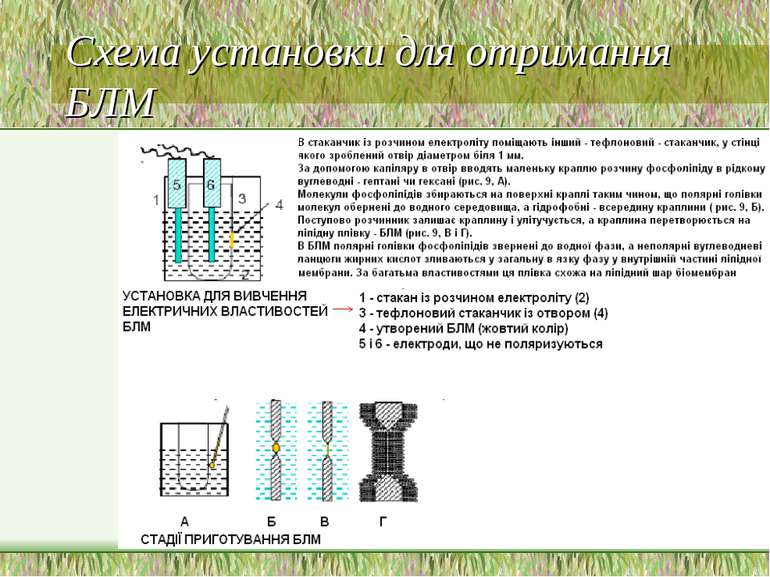
Плоскі бішарові мембрани (=бімолекулярні ліпідні мембрани, БЛМ) Їх формують на отворі (діаметр біля 1 мм) в гідрофобній перетинці (із полістиролу чи тефлону), яка розділяє 2 розчини електроліту, склад яких можна цілеспрямовано змінювати На гідрофобну перетинку наносять концентрований розчин фосфоліпіду в розчиннику (напр., в декані). Більша частина розчиннику переходить у воду, а ліпіди за відповідних умов самовільно – під впливом власної ваги і поверхневих сил – утворюють бішарову плівку, що затягує отвір і стоншується до товщини бішару Цей процес є багатостадійним і модулює самозбирання мембрани – його можна спостерігати під світловим мікроскопом Ще одна назва – “чорні ліпідні мембрани” – пов язана з тим, що ці двошарові мембрани із товщиною 5-6 нм не відбивають світло Полярні “голівки” – до водної фази, гідрофобні “хвости” – всередину бішару Мембрана стабілізується електростатичними взаємодіями між іонами електроліту й зарядженими групами фосфоліпідів, а також гідрофобними взаємодіями між гідрофобними ділянками молекул фосфоліпідів На цих моделях за допомогою електродів, уведених в розчини електроліту, й підключених до вимірювального приладу, можна реєструвати опір бішару, його ємністьтрансмембранну різницю потенціалів. При цьому зазначені характеристики близькі до характеристик біологічних мембран На них можна також вивчати функціонування мембранних білків, зокрема, іонних каналів – але для цих цілей є ряд перешкод: слідові кількості розчинника, нестабільність бішарів, особливо в присутності домішок детергентів. Для усунення впливу розчинника – отримання БЛМ методом Монтала-Мюллера – шляхом з єднання 2-х моношарів фосфоліпіду, утворених на межі фаз електроліт/повітря (мюлерівські мембрани) Утворення сферичних бішарів методом видування розчину фосфоліпіду з трубки із гідрофільного матеріалу, зануреної в розчин електроліту. Радіус кривизни таких мембран біля 1 см, кривизною поверхні можна знехтувати, тому такі мембрани вважаються еквівалентними плоским. Застосовують для вивчення транспортних процесів і злиття мембран Модельні мембранні системи:
Плоскі бішарові мембрани на твердій основі Формуються на твердих гідрофільних основах (напр., оксидованих силіконових плстинках), послідовно переносячи два моношари з межі розподілу повітря/вода Цінні для вимірювання латеральної дифузії мембранозв язаних молекул за допомогою флуоресценції
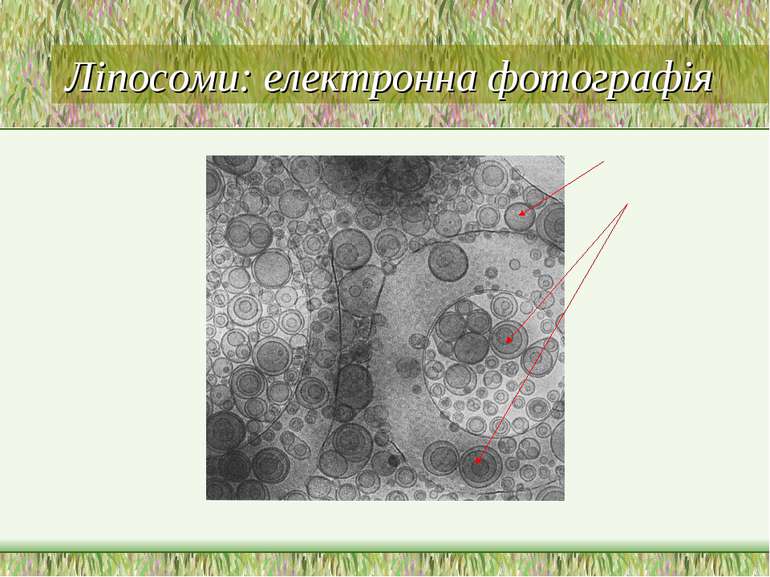
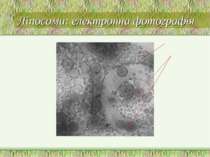
Ліпосоми Вперше виявлені у 1964 р. А. Бенгхемом Це бішарові замкнені сферичні пухирці, утворені із амфіпатичних сполук (напр., фосфоліпідів). При взаємодії з водними розчинами ці речовини самоорганізуються у двошарові замкнені мембрани; в процесі утворення ліпосом у них можна включати різні сполуки (неорганічні іони, низькомолекулярні органічні сполуки, великі білки, нуклеїнові кислоти) Основні методи отримання ліпосом розроблені у 80-рр Залежно від вмісту водної фази ліпосом: протеоліпосоми, імуносоми, віросоми, фармакосоми За кількістю концентричних бішарів: моноламелярні (1) і мультиламелярні везикули (десятки-сотні бішарів, розмір – 5 – 50 мкм) За розміром везикул – малі (200 – 500 Å) і великі (500 – 5 000Å) моноламелярні везикули За формою – не завжди сферичні Модельні мембранні системи:
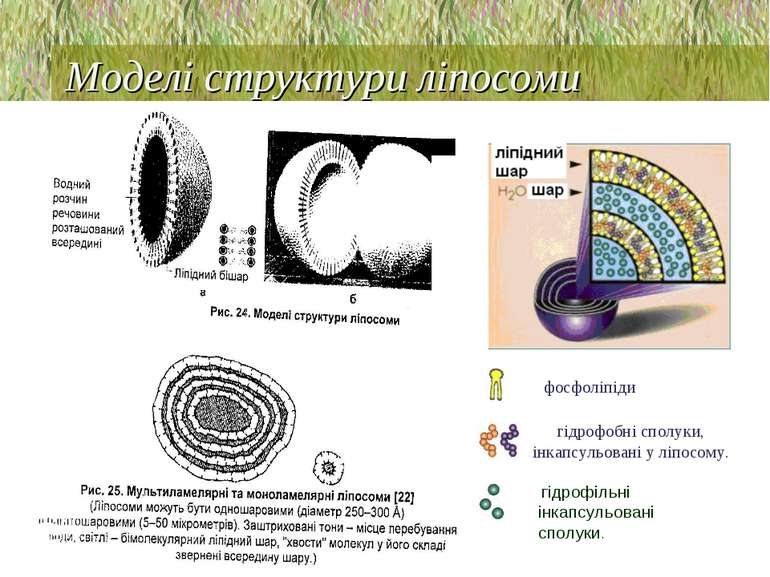
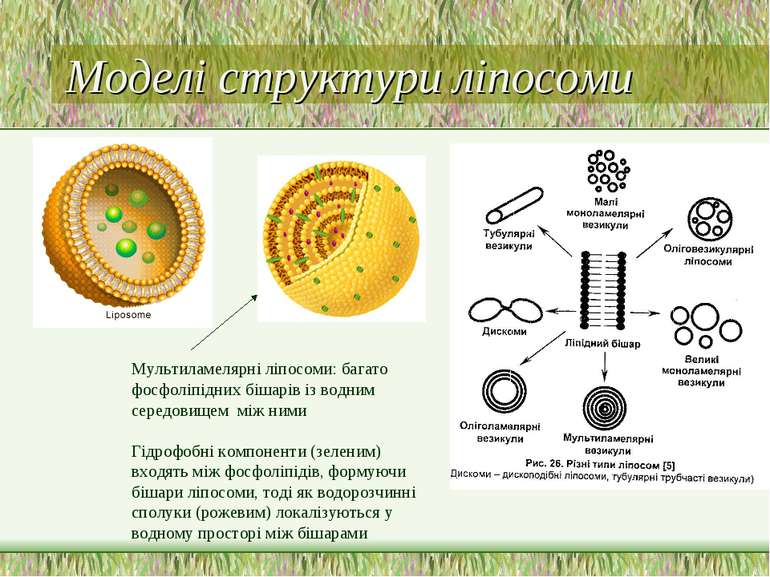
Моделі структури ліпосоми фосфоліпіди гідрофобні сполуки, інкапсульовані у ліпосому. гідрофільні інкапсульовані сполуки.
Моделі структури ліпосоми Мультиламелярні ліпосоми: багато фосфоліпідних бішарів із водним середовищем між ними Гідрофобні компоненти (зеленим) входять між фосфоліпідів, формуючи бішари ліпосоми, тоді як водорозчинні сполуки (рожевим) локалізуються у водному просторі між бішарами
Застосування ліпосом Модельні системи, в які можна вбудовувати різні білки і досліджувати їх функції, а також вивчати склад і стан фосфоліпідного бішару, властивості біологічних мембран Створення систем доставки лікарських препаратів, включених у ліпосоми
Методи отримання ліпосом У вихідну суміш, окрім фосфоліпідів (природного або синтетичного походження) і водного розчину, вводять холестерол (до 40%) – це надає мембранам підвищеної міцності Гідрофільні речовини, які потрібно ввести у ліпосому, розміщують у водній фазі; сторонні гідрофобні сполуки, якими необхідно “навантажити” ліпосому, теж вводять у водну фазу, але в новостворених ліпосомах вони будуть розміщені у ліпідній фазі; на поверхні бішару можна адсорбувати різні хімічні речовини або ковалентно зв язувати їх з ліпідами і іншими компонентами ліпосом Органічний розчин фосфоліпідів випаровують до отримання тонкої ліпідної плівки, яку потім заливають або водним буферним розчином, або розчином сполуки, яку потрібно включити у ліпосоми. При механічному струшуванні водної дисперсії фосфоліпідів утворюються суспензія, що містить великі шматки ліпідів або багатошарові (мультиламелярні) ліпосоми. Малі моноламелярні везикули формують шляхом подальшої обробки цієї суспензії ультразвуком – при цьому відбувається дроблення великих шматків ліпідів і утворюється прозора рідина із невеликою опалесценцією Надалі отриманий розчин моноламелярних ліпосом фракціонують за розміром (гель-хроматографія або центрифугування у градієнті гліцеролу) і одержують гомогенну суміш ліпосом з діаметром біля 250 Å. Недолік малих моноламелярних везикул: площа поверхні зовнішнього моношару фосфоліпідного бішару майже вдвічі більше за внутрішній, і 70% ліпідів міститься ззовні. Фосфатидилхолін і сфінгомієлін через особливості будови молекули будуть розміщені переважно теж ззовні - виникає асиметрія мембран і асиметричне вбудовування у ліпосоми деяких білків. Ще один недолік – малий об єм водної фази. Перевага – гомогенність отриманого матеріалу
Одержання великих моноламелярних везикул Переваги ВМВ: об єм водної фази – 5-20 л/моль (ММВ – 0,5-1 л/моль) Діаліз або розведення детергентних розчинів – цей метод придатний для включення у ВМВ білків. Суть: надлишком детергенту диспергують ліпід або ліпід із білком; надалі детергент видаляють або за допомогою діалізу, або гель-фільтрації на сефадексі. По мірі видалення детергенту утворюються великі везикули діаметром біля 1 мкм. Детергенти із високою ККМ (холат, дезоксихолат, октилглюкозид) майже цілком видаляються діалізом. Для видалення детергентів із низькою ККМ (Тритон Х-100) використовують гідрофобні смоли (напр., біобідс), що вибірково з язують детергент. В деяких випадках повного видалення детергенту не потрібно – досить просто розвести суміш; при цьому концентрація детергенту знижується до рівня, за якого ліпіди самовільно формують везикули. При цьому розмір ліпосом залежить від типу використаного детергенту (холат – 500-800 Å; октилглюкозид – 1000-2000 Å), типу ліпіду й швидості видалення детергенту. Методи злиття ММВ до розмірів ВМВ (повторне заморожування-відтаювання; використання Са++ для ММВ, що містять фосфатидилсерин) Додавання фосфатидилхолінів із коротими ланцюгами (до 20% загального вмісту ліпідів) – при цьому мультиламелярні ліпосоми перетворюються на ВМВ Додавання жирних кислот або детергентів за певних умов викликає злиття ММВ з утворенням ВМВ, а додавання жирних кислот – ще й включенню у бішари ВМВ білків Для отримання ВМВ із клітинними розмірами здійснюють звичайну гідратацію ліпідів та білково-ліпідних сумішей у розчинах із низькою іонною силою. Розмір везикул складає 0,1-300 мкм, а об єм водної фази – до 300 л/моль. Ці везикули залишаються стабільними при центрифугуванні, яке проводять для їх поділу за розмірами. В них можна вводити мікроелектроди для електричних вимірювань. Мультиламелярні ліпосоми для експериментальних досліджень не використовуються
Використання ліпосом: наукові дослідження Ліпосоми застосовують як експериментальні моделі біологічних мембран, оскільки останні мають ті ж фосфоліпідні бішари і відрізняються тільки наявністю численних білкових молекул. Використання ліпосом дозволяє: Вивчити трансмембранну іонну проникність та вплив на неї різноманітних речовин; дослідити розподіл молекул ліпідів у мембранах; вияснити функції окремих ліпідних компонентів мембран; дослідити процес вбудовування різних білків у модельні мембрани; проаналізувати структурно-функціональні взаємовідносини між білковими і ліпідними молекулами у мембранах; вивчати процеси генерації потенціалів; досліджувати процеси взаємодії антигенів і антитіл з мембранами та аналізувати імунні механізми пошкодження мембран; вивчати взаємодію ліпосом з окремими клітинами, моделюючи міжклітинну взаємодію. Зокрема, вже відомо, що при взаємодії не лише клітини захоплюють ліпосоми, але й ліпосоми можуть помітно впливати на клітини, що залежить від складу ліпосомальних мембран. За допомогою ліпосом встановлено основні закономірності транспорту речовин через мембрану; показано роль фазових переходів у функціонуванні мембран; визначено молекулярні параметри ліпідного бішару та його динамічні характеристики; процеси злиття мембран (зокрема, показано, що ліпідні бішари можуть мимовільно зливатися, якщо перебувають у тісному контакті; досліджено процеси злиття ліпосом і бішарових мембран) На реконструйованих мембранних системах вивчено індивідуальні мембранні білки та білкові ансамблі (нікотиновий ацетилхоліновий рецептор; Са++, Мg++-АТФаза саркоплазматичного ретикулуму; Останнім часом ліпосоми використовуються як модельні об єкти в фізиці, хімії, математиці, матеріалознавстві та ін.
Використання ліпосом: фармакологія і медицина. Історія. Ліпосоми можна “навантажити” практично будь-якою сполукою без обмежень щодо їх хімічної природи, властивостей і розміру молекул, у т.ч. І високомолекулярними сполуками білкової природи, які у відсутності ліпосом у клітини не проникають. 1971р – перші спроби включення у ліпосоми ферментів із наступним їх введенням у кровоток для корекції метаболічних розладів при глікогенозах Пізніше – ліпосомальні форми деяких антибіотиків, протипухлинних препаратів, комплексонів, гормонів, цитокінів (останні - для корекції імунного статусу організму) Включення у ліпосоми ліків нового покоління, створених на базі білкової та генної інженерії (фрагментів ДНК і РНК) – для терапії спадкових захворювань та онкологічних
Використання ліпосом: фармакологія і медицина. Плюси. Лікарський препарат при введенні в організм може швидко втрачати активність під дією інактивуючих агентів – мембрана запобігає дії останніх; “обхід” низького терапевтичного індексу препарату (тобто ситуації, коли концентрація, в якій діє препарат, мало відрізняється від токичної дози) – мембрана не дозволяє перевищити допустиму концентрацію препарату Ліпосома (у т.ч. мультиламелярна) дає змогу препарату, що в неї заключений, звільнюатися поступово, у потрібних дозах і впродовж певного проміжку часу: поступовий гідроліз мультиламелярних ліпосом забезпечує повільне надходження препарату до клітини. Препарат, інкапсульований у ліпосому, забезпечує більшу терапевтичну дію ( час дії пролонгується, і доза може бути значно знижена). Ліпосоми за хімічним складом дуже подібні до природних мембран клітини, в яких на ліпіди припадає 20-80% загальної маси. Тому за вірного добору компонентів ліпосом їх введення у організм не спричиняє негативних наслідків. Завдяки можливості варіювання розмірів ліпосом, складу їх поверхні зя вляються можливості переносити у ліпосомах широке коло фармакологічноактивних речовин (протипухлинні і протимікробні препарати, гормони, ферменти, вакцини, додаткові джерела енергії, генетичний матеріал) Ліпосоми не мають властивостей антигенів, запобігаючи взаємодії “вантажа” з імунною системою і не викликаючи захисних і алергійних реакцій організму та забезпечуючи інтактність інкапсульованих в них речовин, запобігаючи їх зв’язуванню білками плазми, руйнуванню ферментами
Використання ліпосом: доставка ліків у органи і тканини Є спроби Мінуси: ліпосоми є досить нестабільними у кровоносному руслі – вони швидко виводяться із нього макрофагами; тому ліпосоми-носії часто не вдається спрямувати в потрібні органи і тканини. Вихід: використання ліпосом із сильно гідрофільною поверхнею завдяки ковалентному приєднанню синтетичного полімеру поліетиленгліколю, що спричиняє зростання осмотичного тиску навколо ліпосоми і запобігає зближенню із клітинами РЕС (макрофагами). В цьому випадку час життя ліпосом (так звані пегільовані ліпосоми) у кровотоці перевищує 2 доби – вони стають невидимими для макрофагів Імуноліпосоми – ліпосоми, до яких прикріплені “вектори” - моноклональні антитіла (МКА). МКА забезпечують специфічне зв язування ліпосом із антигенпозитивними клітинами, а ліпосоми доставляють потрібний гідрофобний чи гідрофільний терапевтичний агент. Використовують як звичайні, так і пегільовані ліпосоми із МКА На практиці імуноліпосоми використовуються для лікування онкологічних захворювань: вони спрямовані проти клітин, які експресують антигени СD71 (рецептор трансферину), LL2 (антиген В-клітинної лімфоми), Her2/neu (рецептор епідермального фактору росту), HLA-DR (антигени ГКГ ІІ класу) та ін
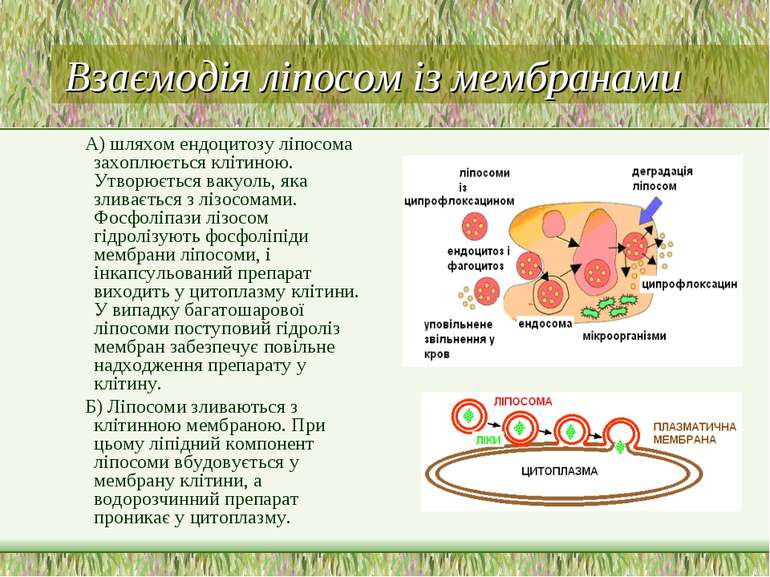
Взаємодія ліпосом із мембранами А) шляхом ендоцитозу ліпосома захоплюється клітиною. Утворюється вакуоль, яка зливається з лізосомами. Фосфоліпази лізосом гідролізують фосфоліпіди мембрани ліпосоми, і інкапсульований препарат виходить у цитоплазму клітини. У випадку багатошарової ліпосоми поступовий гідроліз мембран забезпечує повільне надходження препарату у клітину. Б) Ліпосоми зливаються з клітинною мембраною. При цьому ліпідний компонент ліпосоми вбудовується у мембрану клітини, а водорозчинний препарат проникає у цитоплазму.
Використання ліпосом: фармакологія і медицина. Приклади. Лікування інфекційних захворювань і паразитичних інвазій: шкірний лейшманіоз (препарати сурми – в 700 разів ефективніше за звичайне введення), грибкові захворювання криптококоз і гістоплазмоз, малярія, токсоплазмоз, черевний тиф (антибіотик цефалотин), бруцельоз (гентаміцин) Офтальмологічні захворювання (пілокарпін, кромолін) Інфекції, спричинені грамнегативними бактеріями у хворих на СНІД Найбільш перспективним є використання у вигляді ліпосомальних форм тих фармакологічних препаратів, які мають виражену внутришньоклітинну дію – напр.., протипухлинних засобів, ферментів, гормонів, вітамінів, антибіотиків, циклічних нуклеотидів, радіопротекторів, гепатопротекторів. Перспективним є метод введення інсуліну у формі ліпосом безпосередньо у шлунково-кишковий тракт. Із кишечника така ліпосомна форма інсуліну надходить у кров і може регулювати вуглеводний обмін у хворих на цукровий діабет. Гонадотропін разом із ліпосомою, яка утворена фосфатидилхоліном і кардіоліпіном, проявляє в 5 разів вищу активність, ніж вільний гормон.
Інші напрямки застосування ліпосом Косметологія Біотехнологічні розробки (введення ДНК і РНК в клітини інших типів; харчові і екологічні біотехнології – забезпечення мікроорганізмів тривалий час поживними елементами, мінеральними добавками, ростовими речовинами; видалення нафти із поверхні води і грунту) Діагностика (в ліпосоми можна включати радіоактивні, рентгеноконтрастні, парамагнітні сполуки, речовини, що відбивають ультразвук – для покращення якості зображень, отриманих при комп ютерній томографії, рентгенографії, ультразвуковому зондуванні
Вуглеводні компоненти мембран У вільному стані вуглеводи відсутні Є глікопротеїни, протеоглікани, гліколіпіди В мембранах глікозильовано біля 10% всіх білків і 5-26% ліпідів Основні функції вуглеводних компонентів: Контроль за міжклітинними взаємодіями; Підтримання імунного статусу клітини; Забезпечення стабільності білкових молекул в мембрані Структура мембран:
Глікокалікс Численні інтегральні білки мембран мають вуглеводні групи, прикріплені до їх зовнішньоклітинного домену Ці вуглеводи, разом із вуглеводами, прикріпленими до молекул фосфоліпідів, формують глікокалікс Функції: клітинна адгезія; клітинне розпізнавання
Динаміка структурних компонентів мембрани: узагальнення 1) Інтерналізація рецепторів (за певних умов вони погружаються у ліпідний шар, втрачають свою активність, мембрана змінює свої властивосі); 2) Можливі рухи фосфоліпідів мембран: фліп-флоп перехід (компоненти рухаються із одного ліпідного шару бішарової мембрани у інший); Обертання компонентів навколо своєї вісі; Латеральна дифузія (рух ліпідів в межах 1-го шару); Сегментарні рухи (коливальний рух жирнокислотних залишків) 3) Білки в бішарі підлягають: Обертальним рухам в межах 1-го шару; Латеральній дифузії (часто із оточуючими їх ліпідами); Обертальним рухам із переміщенням з одного моношару в інший із паралельною зміною своєї конфігурації (напр., так переміщуються рухомі переносчики різних сполук – напр., фосфатидилхоліну, фосфатидилінозитолу, сфінгомієліну, сприяючи процесам полегшеної дифузії цих сполук) 4) Можливе вбудовування цілих мембранних фрагментів одного типу в інші мембрани
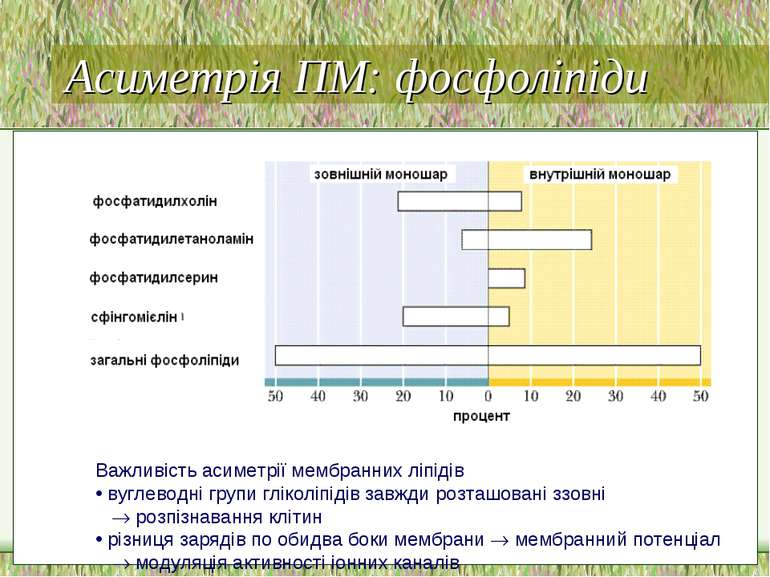
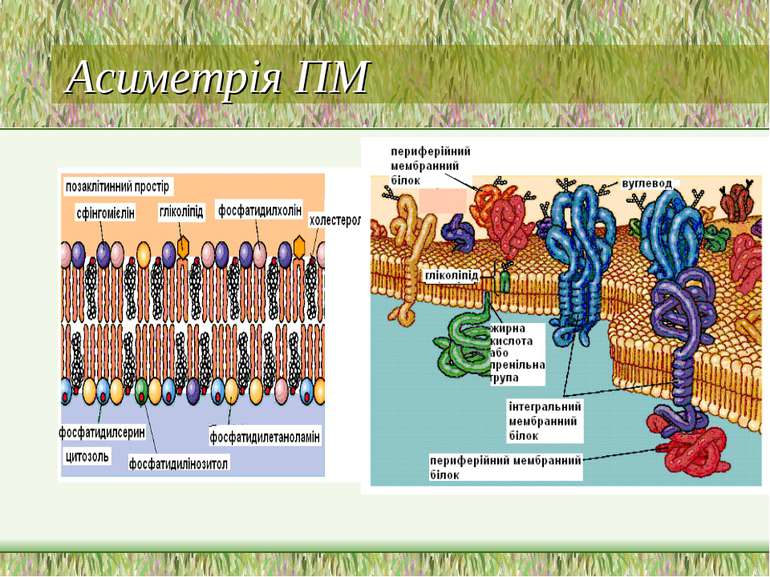
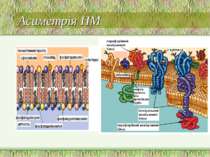
Асиметрія ПМ Важлива для: мембранного транспорту, ефектів гормонів, імунологічних реакцій Асиметрія стосується як білків, так і ліпідів і вуглеводів Білки: напр., N-кінець глікофорину – інтегрального мембранного білка еритроцитів – є позаклітинним, тоді як С-кінець - внутрішньоклітинним Асиметрія ліпідів: склад зовнішнього моношару є відмінним від внутрішнього Структура мембран:
Важливість асиметрії мембранних ліпідів вуглеводні групи гліколіпідів завжди розташовані ззовні розпізнавання клітин різниця зарядів по обидва боки мембрани мембранний потенціал модуляція активності іонних каналів Асиметрія ПМ: фосфоліпіди
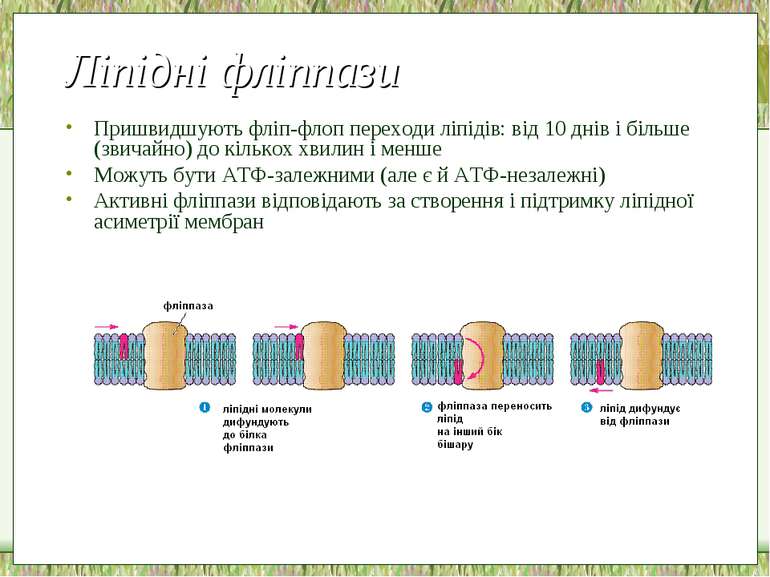
Ліпідні фліппази Пришвидшують фліп-флоп переходи ліпідів: від 10 днів і більше (звичайно) до кількох хвилин і менше Можуть бути ATФ-залежними (але є й АТФ-незалежні) Активні фліппази відповідають за створення і підтримку ліпідної асиметрії мембран
Схожі презентації
Категорії