Презентація на тему:
Карбонові кислоти
Завантажити презентацію
Карбонові кислоти
Завантажити презентаціюПрезентація по слайдам:
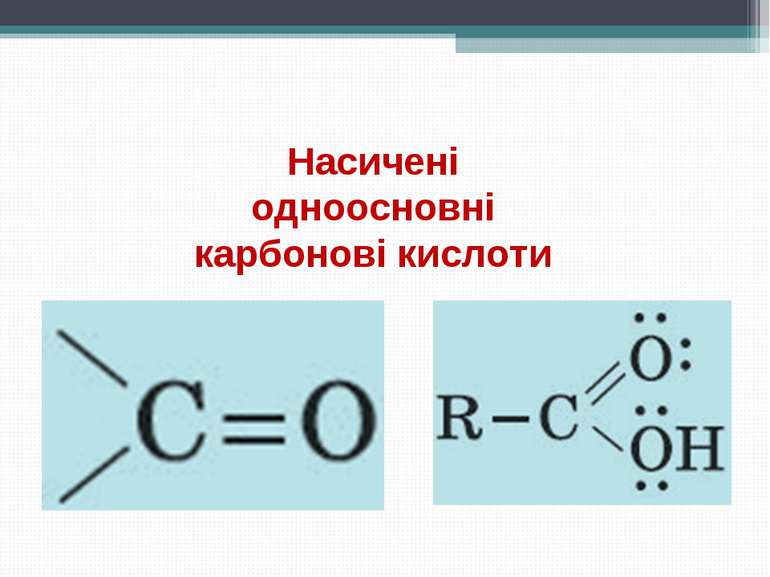
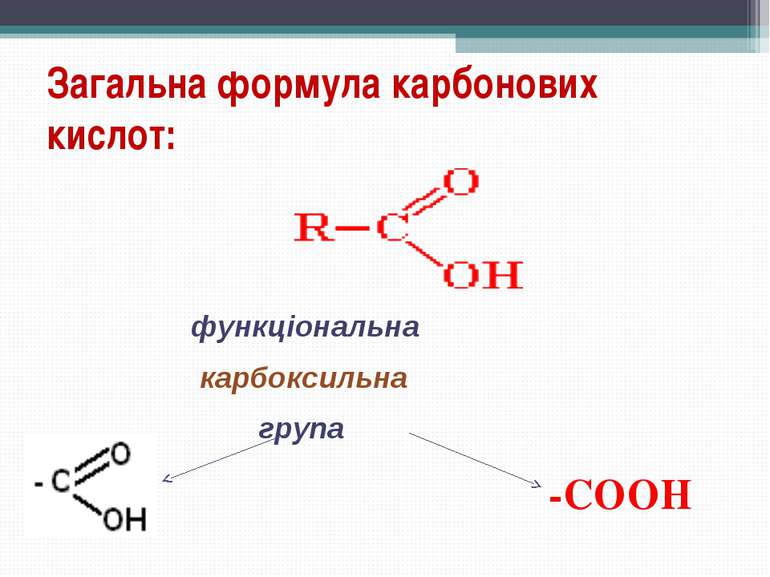
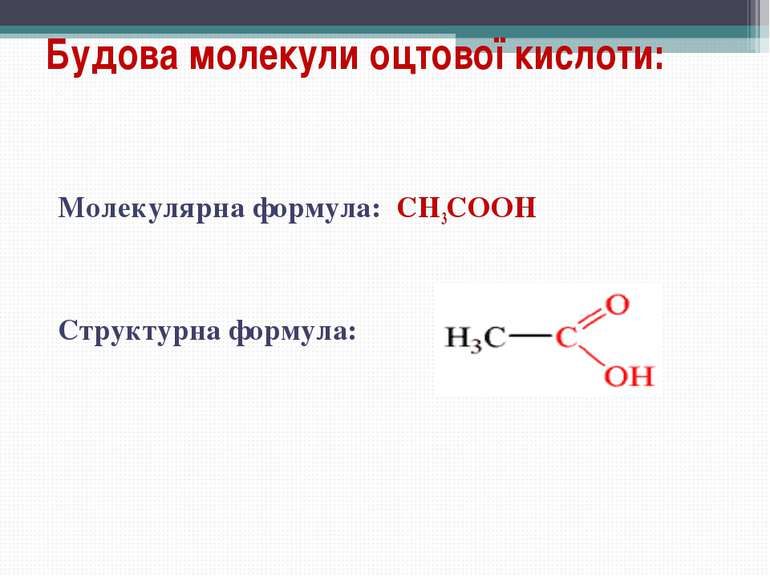
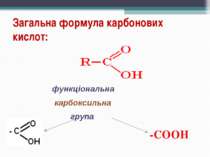
Карбонові кислоти - органічні сполуки, до складу яких входить карбоксильна функціональна група - COOH. Карбоксильна група складається з карбонільної й гідроксильної груп, тому її так і називають. Загальна формула кислот Де R – радикал. Він може бути насиченим і ненасиченим, ароматичним, що містить інші функціональні групи, і т. д.
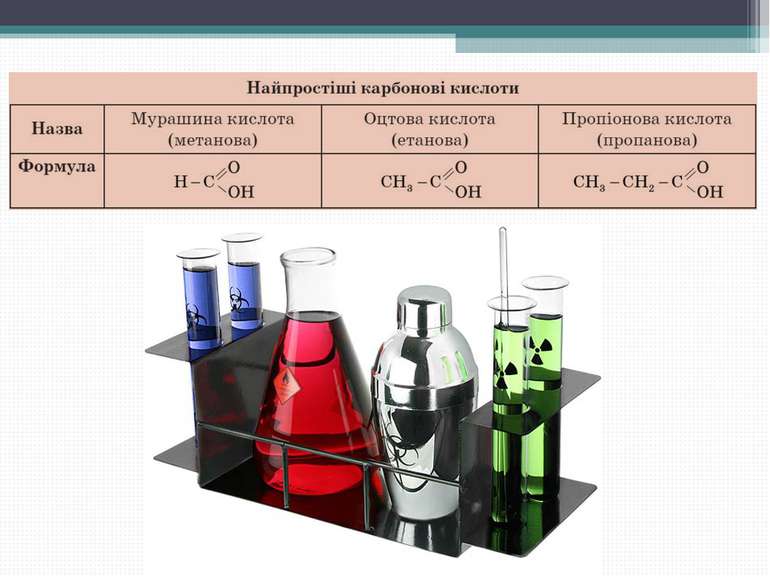
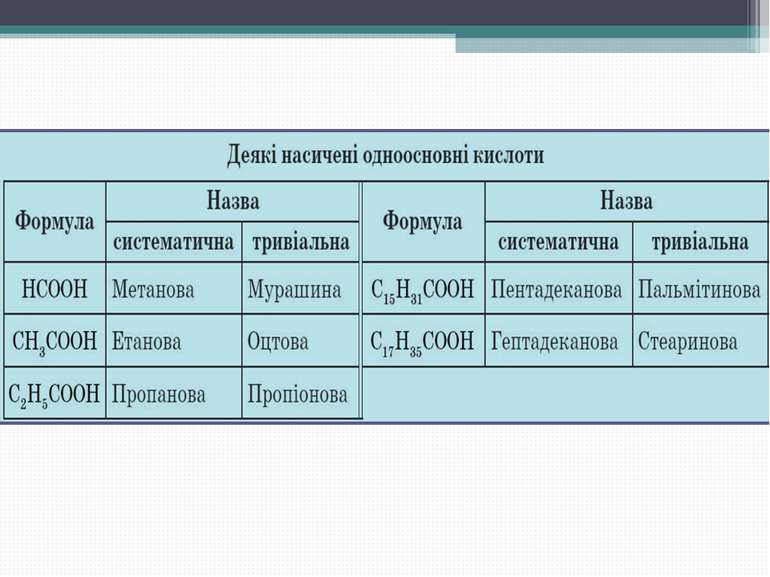
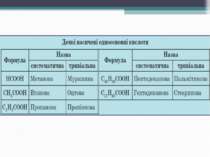
Номенклатура карбонових кислот: HCOOH – мурашина кислота (метанова) CH3COOH – оцтова кислота (етанова) CH3 – (CH2)2 – COOH – масляна кислота (бутанова) Вищі карбонові кислоти: C15H33COOH – пальмітинова кислота C17H35COOH – стеаринова кислота C17H33COOH – олеїнова кислота
Класифікація карбонових кислот 1) За числом карбоксильних груп кислоти поділяються на такі: одноосновні (монокарбонові); багатоосновні (дикарбонові, трикарбонові тощо).
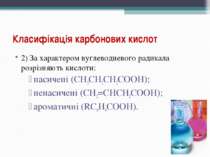
Класифікація карбонових кислот 2) За характером вуглеводневого радикала розрізняють кислоти: насичені (CH3CH2CH2COOH); ненасичені (CH2=CHCH2COOH); ароматичні (RC6H4COOH).
Номенклатура карбонових кислот Систематичні назви кислот даються за назвою відповідного вуглеводню з додаванням суфікса -ова і слова «кислота».
Карбоксильна група сполучає в собі дві функціональні групи - карбоніл і гідроксил, що взаємно впливають один на одного: Кислотні властивості карбонових кислот обумовлені зсувом електронної густини до карбонільного кисню й викликаної цим додаткової (у порівнянні зі спиртами) поляризації зв'язку О-Н. Розчинність у воді й високі температури кипіння кислот обумовлені утворенням міжмолекулярних водневих зв'язків. Зі збільшенням молекулярної маси розчинність кислот у воді зменшується. Будова карбоксильної групи
Ізомерія Cтруктурная ізомерія - ізомерія кістяка в углеводородном радикалі (починаючи з C4). - міжкласова ізомерія, починаючи з C2. Наприклад, формулі C2H4O2 відповідають 3 ізомери, що ставляться до різних класів органічних сполук. Просторова ізомерія Можлива цис-транс ізомерія у випадку ненасичених карбонових кислот.
Функціональні похідні карбонових кислот Карбонові кислоти проявляють високу реакційну здатність. Вони вступають у реакції з різними речовинами й утворять різноманітні сполуки, серед яких велике значення мають функціональні похідні, тобто сполуки, отримані в результаті реакцій по карбоксильній групі.
Фізичні властивості оцтової кислоти: Оцтова кислота – безбарвна рідина, летка, має різкий специфічний запах, змішується з водою в будь-яких пропорціях, розчин кислий на смак; за t < 170 С кристалізується (“крижана кислота “); 3-9% водний розчин – столовий оцет; 86% водний розчин - оцтова есенція
Молекули кислот з'єднані попарно за допомогою водневих зв'язків, утворюючи димер: Утворенням водневих зв'язків можна пояснити і розчинність карбонових кислот у воді.
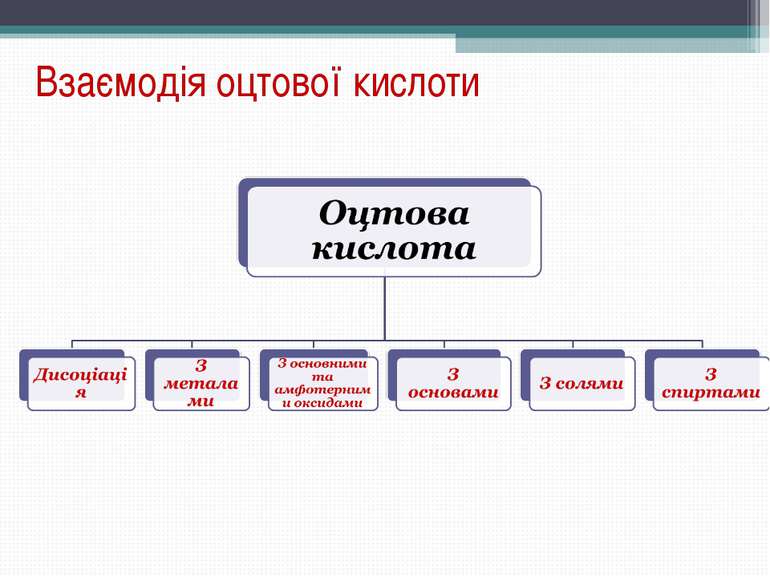
Хімічні властивості оцтової кислоти: 1) електролітична дисоціація: CH3COOH CH3COO1- + H1+ ацетат - йон 2) Взаємодія з металами: 2СН3СООН + Мg Mg(CH3COO)2 + H2 магній ацетат 3) Взаємодія з оксидами металів: 2СН3СООН + СаО Са(СН3СОО)2 + Н2О кальцій ацетат 4) Взаємодія з лугами: СН3СООН + NaOH NaCH3COO + H2O натрій ацетат 5) Взаємодія з солями, утвореними слабшими кислотами: 2СН3СООН + Na2CO3 2 NaCH3COO + CO2+ H2O
Хімічні властивості характерні для карбонових кислот: Взаємодія зі спиртами: СН3СООН + НОС2Н5 СН3СООС2Н5 + Н2О етиловий естер оцтової кислоти Загальна формула естера (складного ефіру):
Схожі презентації
Категорії