Презентація на тему:
Комплексні сполуки. Будова, класифікація, номенклатура. Властивості комплексних сполук. Біологічна роль комплексних сполук у хімії.
Завантажити презентацію
Комплексні сполуки. Будова, класифікація, номенклатура. Властивості комплексних сполук. Біологічна роль комплексних сполук у хімії.
Завантажити презентаціюПрезентація по слайдам:
Комплексні сполуки. Будова, класифікація, номенклатура. Властивості комплексних сполук. Біологічна роль комплексних сполук. Теорія Вернера. Ізомерія координаційних сполук. Класифікація комплексних сполук. Номенклатура комплексних сполук. Природа хімічного зв’язку в комплексних сполуках. Стійкість комплексних сполук. Взаємний вплив координуючого атома і ліганду. Комплексні сполуки з органічними лігандами. Комплексони, їх використання в аналізі. Біметалеві комплекси. Використання комплексних сполук у фармації.
Координаційна теорія комплексних сполук запропонована в 1893 році шведським хіміком Альфредом Вернером. Він висунув ідею про координацію, тобто просторове оточення іона металу аніонами або нейтральними молекулами. Комплексним іоном називають більш чи менш стійке утворення, яке несе заряд і це утворення існує внаслідок безпосередньої взаємодії атома або іона металу з групою нейтральних молекул або іонів. Згідно з координаційною теорією, головний постулат Вернера формулюється так: ”Навіть, якщо, зважаючи на число валентностей, зв’язуюча здатність декількох атомів вичерпана, вони в більшості випадків ще можуть приймати участь далі в побудові складних молекул з утворенням певних атомних зв’язків. Можливість цього слід вбачати в тому факті, що поруч із зв’язками спорідненості, які називають головною валентністю, існують ще й інші зв’язки між атомами, які називають побічними валентностями...”
Згідно з координаційною теорією, у молекулі будь-якої комплексної сполуки один з іонів, звичайно позитивно заряджений, займає центральне місце і називається комплексоутворювачем, або центральним іоном. У безпосередній близькості навколо цього іона розміщено, або як говорять, координовано деяке число протилежно заряджених іонів або електронейтральних молекул, що називаються лігандами (або адендами), які утворюють внутрішню координаційну сферу сполуки. Решта іонів, не розмістилися у внутрішній сфері, містяться на дальшій відстані від центрального іона, утворюючи зовнішню координаційну сферу. Число лігандів, що оточують центральний іон, називається координаційним числом.
Внутрішня сфера комплексу значною мірою зберігає стабільність при розчиненні комплексної сполуки. Її межі показують квадратними дужками. Іони, що містяться у зовнішній сфері, у розчинах легко відщеплюються. Тому говорять, що у внутрішній сфері іони зв’язані неіоногенно, а у зовнішній – іоногенно. Наприклад:
Центральними атомами можуть бути практично всі елементи періодичної системи Д.І.Менделєєва. Найбільш активними комплексоутворювачами є платинові метали (Pt, Pd), елементи родини Феруму (Fe, Co, Ni), підгруп Купруму (Cu, Ag, Au), Цинку (Zn, Cd, Hg). Катіони, що найлегше утворюють координаційні сполуки, мають незавершений або 18-електронний (зовнішній) енергетичний рівень. Найменшу здатність до комплексоутворення виявляють лужні та лужно-земельні метали. Центральними атомами в координаційних сполуках можуть бути також і неметали, наприклад, бор K[BF4], силіцій K2[SiF6], фосфор K[PF6].
Важливою характеристикою лігандів є їх координаційна ємкість, або дентатність, яка визначається числом місць, які ліганди займають у внутрішній координаційній сфері комплексу. Розрізняють: монодентатні ліганди (F-, Cl-, Br-, I-, CN-, CSN-), бідентатні ліганди (CO32-, SO42-) тощо. Координаційне число (КЧ) – величина змінна і визначається природою центрального атома, лігандів, зовнішньою сферою сполуки, природою розчинника та зовнішніми умовами, в яких утворюється сполука. Координаційні числа центрального атома в різних координаційних сполуках змінюються від 2 до 12. Сполуки з великими КЧ (8 і ) трапляються дуже рідко. Найчастіше трапляються координаційні сполуки з КЧ 2, 4 та 6.
КЧ 6 зустрічається в комплексних сполуках Pt4+, Cr3+, Co3+, Fe3+, КЧ 4 – в комплексних Cu2+, Zn2+, Pd2+, Pt2+, КЧ 2 – у комплексах Ag+, Cu+. Заряд центрального іона КЧ +1 2 +2 4 ; 6 +3 6 ; 4 +4 8
Ізомерія координаційних сполук А. Просторова ізомерія: Геометрична (цис- і транс-ізомерія); Оптична Б. Структурна ізомерія: Сольватна (гідратна) Іонізаційна Координаційна Ізомерія зв’язку і т.д.
Геометрична ізомерія в координаційних сполуках спостерігається тоді, коли ліганди у внутрішній сфері розміщуються по – різному відносно один одного. Геометричні ізомери відрізняються за: Фізичними Хімічними властивостями Оптичні ізомери відносяться один до одного як предмет і його дзеркальне відображення. Два оптичні ізомери обертають площину поляризації світла на однаковий кут: один-вправо, а другий-вліво. За фізичними і хімічними властивостями оптичні ізомери практично не відрізняються один від одного.
Причиною сольватної ізомерії є неоднаковий розподіл молекул розчинника між внутрішньою і зовнішньою сферами координаційної сполуки. Для кристалогідратів таку ізомерію називають гідратною. Кристалогідрат хлориду Cr(III), CrCl3 6H2O, [Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2 H2O, [Cr(H2O)4Cl2]Cl 2H2O, [Cr(H2O)3Cl3] 3H2O. Іонізаційна ізомерія зумовлена різним розподілом іонів між внутрішньою і зовнішньою сферами, наприклад: [Co(NH3)5Br]SO4, [Co(NH3)5SO4]Br, [Pt(NH3)4Cl2]Br2 i [Pt(NH3)4Br2]Cl2. Координаційна ізомерія зв’язана з переходом лігандів від одного комплексоутворювача до другого: [Co(NH3)6][Cr(CN)6] i [Cr(NH3)6][Co(CN)6]. Ізомерія зв’язку може виявлятись тоді, коли ліганди містять два різних атоми, здатних координуватись з центральним атомом. Наприклад, у солях з [Co(NH3)5ONO]X2 i [Co(NH3)5NO2]X2 група ONO зв’язана з Со(ІІІ) через Оксиген, а група NO2 – через Нітроген.
Комплексні сполуки – електроліти, по специфіці дисоціації поділяють на кислоти, основи і солі. Електроліти Неелектроліти При розчиненні у воді (чи іншому розчиннику) взаємодіють з нею, дисоціюючи на іони. Електролітичній дисоціації не піддаються.
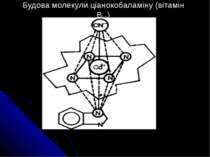
Класифікація комплексних сполук. По координаційному числу; По ступеню окиснення; По типу донорних атомів лігандів; По типу або природі координаційного зв’язку; По електронній конфігурації атома або іону металу. Широко прийнятою є класифікація комплексних сполук по типу лігандів, які утворюють внутрішню координаційну сферу комплексів. Аміакати – комплекси, в яких лігандами є молекули аміаку, наприклад: ; Відомі комплекси, аналогічні аміакатам, у який роль ліганду виконують молекули амінів: СН3NH2 (метиламін), C2H5NH2 (етиламін), NH2CH2CH2NH2 (етилендиамін Еn). Такі комплекси називають амінатами.
Аквакомплекси – лігандом виступає вода: Гідратовані катіони, які є у одному розчині, містять як центральну ланку аквакомплекс. У кристалічному стані деякі з аквакомплексів утримують і кристалізаційну воду, наприклад: Кристалізаційна вода не входить до складу внутрішньої сфери, вона зв’язана не так міцно, як координована, і легше віддається при нагріванні. Ацидокомплекси – лігандами є аніони. До них належать комплекси типу подвійних солей, наприклад, (їх можна подати як продукт поєднання двох солей – PtCl4 2KCl, Fe(CN)2 4KCN); комплексні кислоти H2 SiF6 , H2 CoCl4 ; гідроксокомплекси Na2 Sn(OH)4 , Na2 Sn(OH)6 .
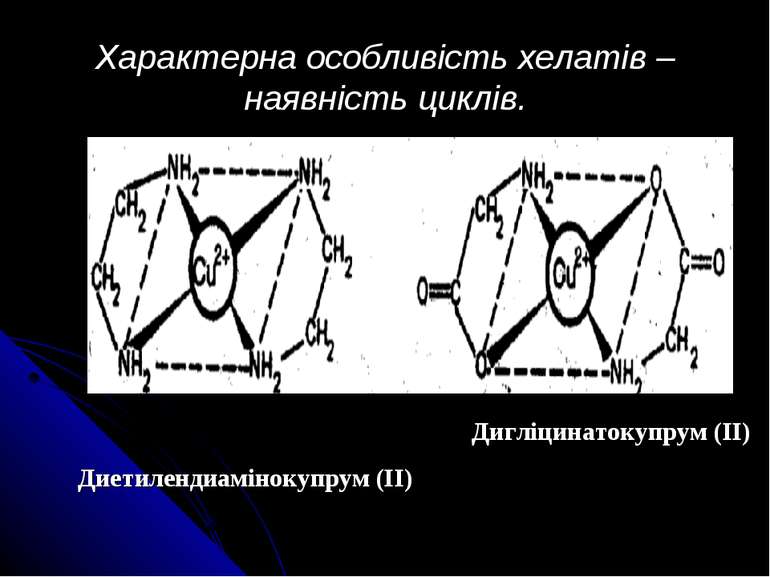
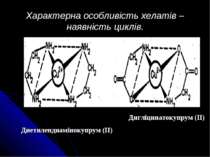
Різнолігандні. Між цими трьома класами існують перехідні ряди, які включають комплекси з різними лігандами: Pt(NH3)4 Cl2, Pt(NH3)3Cl Cl, Pt(NH3)2Cl2 , K Pt(NH3)3Cl3 , K2 PtCl4 . Циклічні або хелатні (клішнеподібні) комплексні сполуки. Вони містять бі- або полідентатний ліганд, який ніби захоплює центральний атом подібно до клішні рака:
Характерна особливість хелатів – наявність циклів. Диетилендиамінокупрум (ІІ) Дигліцинатокупрум (ІІ)
Номенклатура комплексних сполук. Cl- - хлоро, SO32- - сульфіто, CN- - ціано, ОН- -гідроксо, Н- - гідридо, О2- - оксо, СО32- - карбонато, SO42- -сульфато, NCS- - тіоціанато, F- - фторо, S2- -тіо. Нейтральні молекули, як ліганди, зберігають свою звичайну назву: етиламін, піридин, гідразин, етилендіамін, NH3 – амін, Н2О – аква 1 – моно, 2 – ди(ді), 3 - три, 4 – тетра, 5 – пента, 6 – гекса.
[Ag(NH3)2]ClO4 – перхлорат діамінаргентуму (І) [Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетрамін платини (IV) [Ag(NH3)2]Cl – хлорид діамінаргентуму (І) K3[Fe(CN)6] – гексаціаноферат (ІІІ) калію K4[Fe(CN)6] – гексаціаноферат (ІІ) калію (NH4)2[Pt(OH)2Cl4] - дигідроксотетрахлороплатинат(IV) амонію [Cr(H2O)3F3] – трифлуоротриаква хром (ІІІ) [Co(NO2)2Cl(NH3)3] – динітро-хлоро-триамін кобальт (ІІІ).
Природа хімічного зв’язку в комплексних сполуках. Теорія кристалічного поля. Основні положення цієї теорії можна сформулювати так: 1. Комплексні сполуки стійко існують через електростатичну взаємодію центрального іона з лігандами. 2. Центральний іон розглядають з врахуванням його електронної будови і тих змін, які спричиняють ліганди своїм електростатичним полем. Ліганди розглядають тільки як носії певного заряду, а їх власну елетронну структуру не враховують. 3. Взаємодія між центральним атомом і лігандами кількісно описують законами і математичним апаратом квантової механіки.
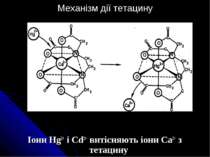
Стійкість комплексних сполук. Є два різних види стійкості – термодинамічна і кінетична. Якщо з термодинамічної позиції, тоді нас цікавлять енергії зв’язку метал-ліганд, нас цікавлять константи рівноваги процесів дисоціації комплексних сполук або їх окиснювально-відновні потенціали, які характеризують стабілізацію валентного стану. Якщо ж цікавить нас кінетична стійкість – то маємо справу з комплексними сполуками в розчині, а отже, цікавлять процеси заміщення, ізомеризації, рацемізації і реакції з переносом заряду (електрона) З позицій кінетики правильно говорити не про стійкі і нестійкі комплекси, а про інертні і лабільні Лабільними називають комплексні сполуки, які порівняно легко обмінюють ліганди внутрішньої сфери на інші ліганди. Інертні – це комплексні сполуки, які важко обмінюють ліганди внутрішньої сфери на інші ліганди.
Ефективно демонструють відмінності між кінетичною і термодинамічною стійкостями наступні два комплекси, для яких приведено константи рівноваги: Co(NH3)63+ + 6H3O+ Co(H2O)63+ + 6NH4+ K 1025 Ni(CN)42- Ni2+ + 4CN- K 10-23 Термодинамічно – нестійкий аміачний комплекс Со(ІІІ) внаслідок своєї кінетичної інертності може добами існувати без змін в кислому розчині, тоді як ціанідний комплекс Ni(II), не дивлячись на велику термодинамічну стійкість, проявляє велику кінетичну лабільність, миттєво обмінюючи свої СN- - іони на додані радіоактивно помічені CN- - іони. Фактори, що впливають на стійкість комплексних сполук: - природа іона металу і ліганду - заряд іона металу - іонний радіус комплексоутворювача - природа середовища
[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- (первинна дисоціація) [Ag(NH3)2]+ Ag+ + 2NH3 (вторинна дисоціація)
Дана константа рівноваги називається константою нестійкості комплексного іона. Константа нестійкості для різних комплексних іонів дуже різні і можуть бути мірою стійкості комплексу. Константи нестійкості, у вираз яких входять концентрації іонів і молекул, називають “концентраційними”.
Більш точними і незалежними від концентрацій та іонної сили розчину є константи нестійкості, які містять замість концентрацій активності іонів та молекул; такі константи нестійкості називають термодинамічними. У розбавлених розчинах ці два різні вирази констант нестійкості збігаються один з одним:
Кст(В) і Кнест – це загальні константи стійкості і нестійкості, які відносяться до розкладання комплексу на кінцеві продукти. Насправді ж у розчинах має місце ступінчаста дисоціація комплексу, аналогічна ступінчастій дисоціації слабких електролітів, наприклад, багатоосновних кислот.
Схожі презентації
Категорії















![Схема утворення аміачного комплексу купруму [Cu(NH3)4]2+ Схема утворення аміачного комплексу купруму [Cu(NH3)4]2+](https://svitppt.com.ua/images/29/28684/770/img14.jpg)
![Схема утворення і просторова будова [Co(NH3)6]3+ Схема утворення і просторова будова [Co(NH3)6]3+](https://svitppt.com.ua/images/29/28684/770/img15.jpg)

![[Ag(NH3)2]ClO4 – перхлорат діамінаргентуму (І) [Pt(NH3)4Cl2]Cl2 – хлорид дихл... [Ag(NH3)2]ClO4 – перхлорат діамінаргентуму (І) [Pt(NH3)4Cl2]Cl2 – хлорид дихл...](https://svitppt.com.ua/images/29/28684/770/img21.jpg)





![[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- (первинна дисоціація) [Ag(NH3)2]+ Ag+ + 2NH3 (... [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- (первинна дисоціація) [Ag(NH3)2]+ Ag+ + 2NH3 (...](https://svitppt.com.ua/images/29/28684/770/img27.jpg)


















![Схема утворення аміачного комплексу купруму [Cu(NH3)4]2+ Схема утворення аміачного комплексу купруму [Cu(NH3)4]2+](https://svitppt.com.ua/images/29/28684/210/img14.jpg)
![Схема утворення і просторова будова [Co(NH3)6]3+ Схема утворення і просторова будова [Co(NH3)6]3+](https://svitppt.com.ua/images/29/28684/210/img15.jpg)


![[Ag(NH3)2]ClO4 – перхлорат діамінаргентуму (І) [Pt(NH3)4Cl2]Cl2 – хлорид дихл... [Ag(NH3)2]ClO4 – перхлорат діамінаргентуму (І) [Pt(NH3)4Cl2]Cl2 – хлорид дихл...](https://svitppt.com.ua/images/29/28684/210/img21.jpg)





![[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- (первинна дисоціація) [Ag(NH3)2]+ Ag+ + 2NH3 (... [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- (первинна дисоціація) [Ag(NH3)2]+ Ag+ + 2NH3 (...](https://svitppt.com.ua/images/29/28684/210/img27.jpg)


























