Презентація на тему:
"Силіцій"
Завантажити презентацію
"Силіцій"
Завантажити презентаціюПрезентація по слайдам:
Періодична система хімічних елементів Д.І.Менделєєва Періоди 1 2 3 4 5 6 7 Ряди 1 2 3 4 10 9 8 7 5 6 Групи елементів I II VI V VII III IV VIII Si 28 +14 0 Характеристика 1. У 1811 р. французькі хіміки Ж.Л. Гей-Люссак і Л.Ж. Тенар добули чистий силіцій. 2. У Періодичній системі знаходиться в 3 періоді, ІVгрупа, головна підгрупа. 3. У природі зустрічається тільки у зв'язаному стані. 4. Як проста речовина має кристалічну будову, крихкий, темно-сірого кольору з металічним блиском. 5. Е=1,9;найнижчий ступінь окислення –4, найвищий ступінь окислення +4.
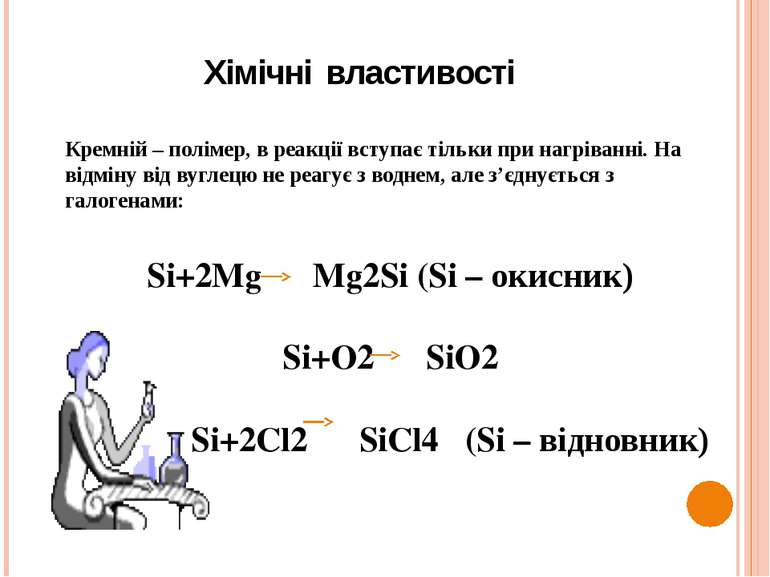
Хімічні властивості Кремній – полімер, в реакції вступає тільки при нагріванні. На відміну від вуглецю не реагує з воднем, але з’єднується з галогенами: Si+2Mg Mg2Si (Si – окисник) Si+O2 SiO2 Si+2Cl2 SiCl4 (Si – відновник)
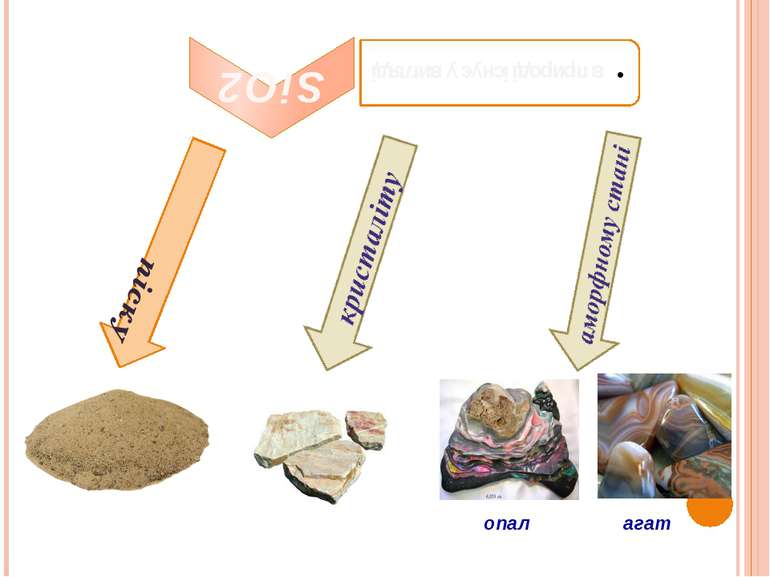
Характеристика сполук Силіцію SiO2 – тугоплавкий і хімічно малоактивний, при звичайних температурах. З водою не реагує, свої кислотні властивості проявляє в реакціях з лугами, основними оксидами і деякими солями, які проходять з достатньою швидкістю при підвищених температурах: 2NaOH+SiO2=Na2SiO3+H2O Na2CO3+SiO2=Na2SiO3+CO2 З кислотами SiO2 не реагує, виняток складає плавикова кислота: SiO2+4HF=SiF4+2H2O.
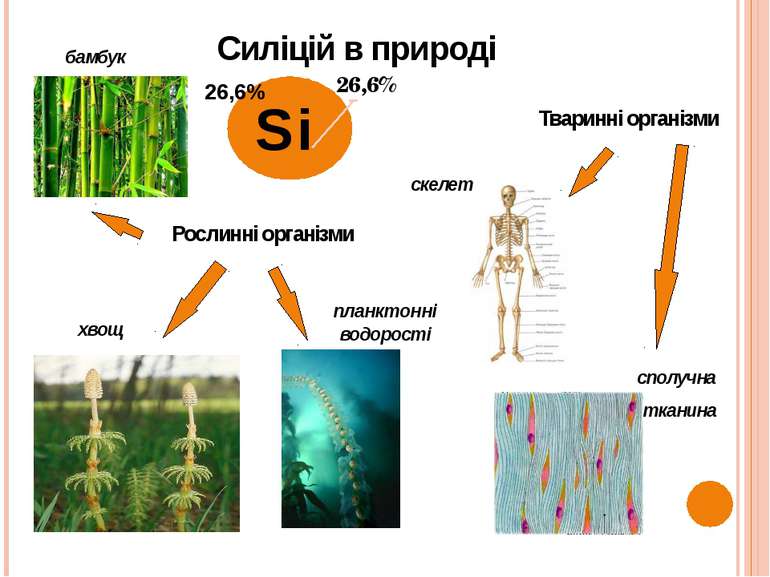
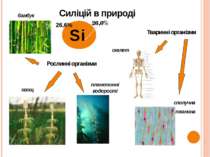
Si Рослинні організми бамбук хвощ Тваринні організми планктонні водорості скелет сполучна тканина Силіцій в природі
Категорії