Презентація на тему:
ЕЛЕКТРОХІМІЯ
Завантажити презентацію
ЕЛЕКТРОХІМІЯ
Завантажити презентаціюПрезентація по слайдам:
ЕЛЕКТРОХІМІЯ План 1. Електродні процеси. Електрод-ний потенціал. 2. Типи електродів. 3. Дифузійний і мембранний потен-ціали. 4. Гальванічні елементи. ЕРС. 5. Кінетика електрохімічних про-цесів. Підготувала: к.х.н., доц. Іванець Л.М.
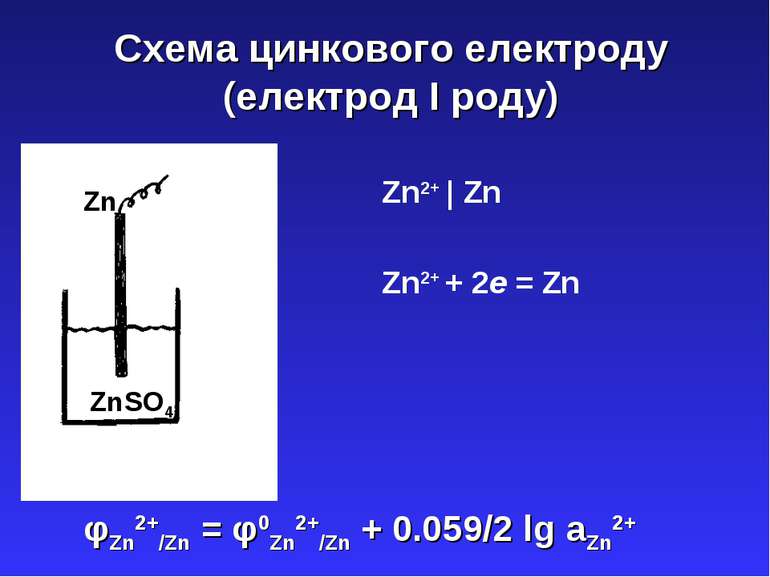
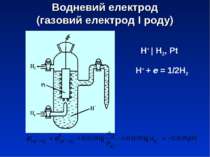
Схема цинкового електроду (електрод І роду) Zn ZnSO4 Zn2+ | Zn φZn2+/Zn = φ0Zn2+/Zn + 0.059/2 lg aZn2+ Zn2+ + 2e = Zn
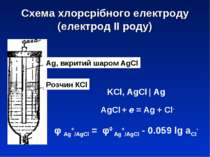
Схема хлорсрібного електроду (електрод ІІ роду) Ag, вкритий шаром AgCl Розчин КCl KCl, AgCl | Ag φ Ag+/AgCl = φ0 Ag+/AgCl - 0.059 lg aCl- AgCl + e = Ag + Cl-
Схема окисно-відновного електроду (електрод ІІІ роду) Pt FeCl3 + FeCl2 Fe3+ , Fe2+ | Pt Fe3+ + e = Fe2+
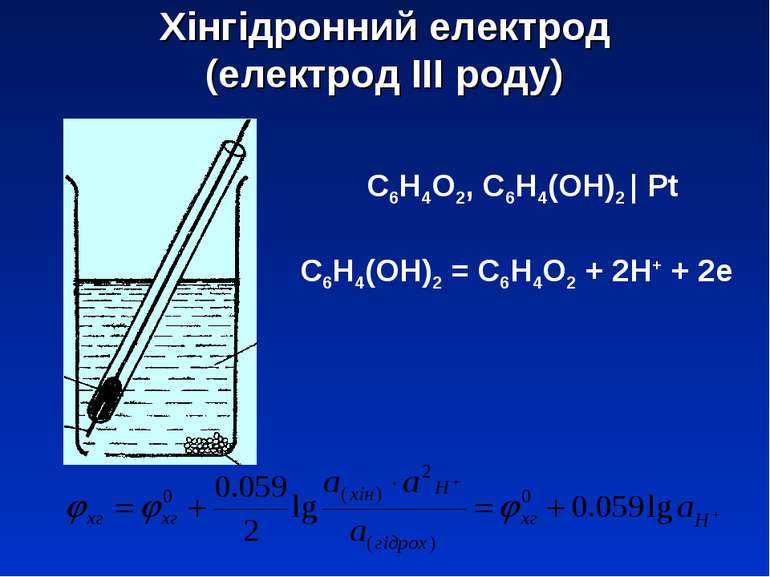
Хінгідронний електрод (електрод ІІІ роду) С6Н4О2, С6Н4(ОН)2 | Pt С6Н4(ОН)2 = С6Н4О2 + 2Н+ + 2е
Механізм виникнення дифузійного потенціалу HCl 1 н HCl 0.1 н H+ Cl- + + + + + + + + + - - - - - - - - -
Йонний склад нервової клітини кальмара Йони Концентрація, ммоль/л у клітині у зовн.середов. K+ Na+ Cl- Органічні йони 400 50 110 350 20 440 550 -
Мембранні потенціали клітин Потенціал пошкодження 30-40 мВ Потенціал спокою 50-100 мВ Потенціал дії -75-45 мВ
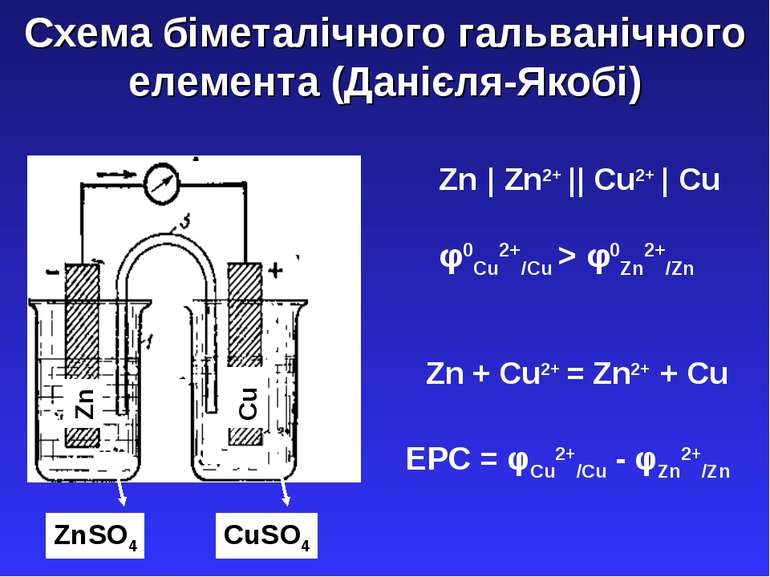
Схема біметалічного гальванічного елемента (Данієля-Якобі) Zn Cu ZnSO4 CuSO4 Zn + Cu2+ = Zn2+ + Cu Zn | Zn2+ || Cu2+ | Cu φ0Cu2+/Cu > φ0Zn2+/Zn EPC = φCu2+/Cu - φZn2+/Zn
Схема хінгідронно-каломельного гальванічного елемента з одним електролітом Hg| Hg2Cl2, KCl || KCl | H+ , хг | Pt EPC = φхг - φкалом
Схема концентраційного гальванічного елемента Ag | AgNO3 || AgNO3 | Ag а1 < а2 _ + AgNO3, а1 AgNO3, а2 EPC = φ2 Ag+/Ag – φ1 Ag+/Ag = = 0.059 lg (a2 / a1)
Свинцевий акумулятор Pb | PbSO4, H2SO4, PbSO4, PbO2 | Pb A+: PbO2 + H2SO4 + 2e = PbSO4 + 2OH- K-: Pb + H2SO4 – 2e = PbSO4 + 2H+ Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
Електроліз водного розчину H2SO4 (-)Pt | H2SO4 | Pt(+) Aнод: OH- - e = ½ H2O + ¼ O2 φ = φ0 + 0.059 lg ( P1/4 / a -) O2/OH- O2 OH Kатод: H+ + e = ½ H2 φ = φ0 + + 0.059 lg ( P1/2 / a +) 2H / H2 H2 H
Схожі презентації
Категорії