Презентація на тему:
"Цезій"
Завантажити презентацію
"Цезій"
Завантажити презентаціюПрезентація по слайдам:
Історія відкриття Відкрито цезій порівняно нещодавно, в 1860. В мінеральних водах відомих цілющих джерел Шварцвальда (Баден-Баден та ін.) За короткий історичний термін пройшов блискучий шлях - від рідкісного, нікому не відомого хімічного елемента до стратегічного металу. Належить до родини рідкісних лужних легких металів. Легко взаємодіє з іншими елементами, утворюючи міцні зв'язки. Цезій - хімічний елемент I групи періодичної системи, атомний номер 55, атомна маса132,9054; відноситься до лужних металів.
Отримання Промислово цезій отримується у вигляді сполук, що утворюються при обробці мінералу полуциту хлоридною чи сульфатною кислотами. Перший процес включає в себе обробку вихідного мінералу підігрітою соляною кислотою, додавання хлориду стибію SbCl3 для осадження сполуки Cs3[Sb2Cl9] і промивання гарячою водою або розчином амоніяку з утворенням хлориду цезію CsCl. При другому — мінерал обробляється підігрітою сірчаною кислотою з утворенням алюмоцезіевих галунів CsAl(SO4)2 · 12H2O. Цезій у вакуумованій ампулі
Фізичні властивості Кристалізується цезій у об'емноцентрірованную кубічні грати (тип α-заліза), просторова група I m3m, a = 0,6141 нм, Z = 2. При високому тиску може переходити в інші поліморфні модифікації [9]. Цезій - парамагнетик. Цезій розчиняється в рідкому аміаку (темно-сині розчини) і розплавленому CsOH. кристали цезію
Хімічні властивості Цезій є найбільш хімічно активним металом, отриманим в макроскопічних кількостях. Є найсильнішим відновником. На повітрі цезій миттєво окислюється із запалюванням, утворюючи надпероксід CsO2. При обмеженому доступі кисню окислюється до оксиду Cs2O. Взаємодія з водою відбувається з вибухом, продуктом взаємодії є гідроксид CsOH і водень H2. Цезій вступає в реакцію з льодом (навіть при -120 ° C), простими спиртами, галогеноорганічними сполуками, галогенидами важких металів, кислотами, сухим льодом (взаємодія протікає з сильним вибухом). Реагує з бензолом. Активність цезію обумовлена не тільки високим негативним електрохімічним потенціалом, але і невисокою температурою плавлення і кипіння (швидко розвивається дуже велика контактна поверхню, що збільшує швидкість реакції).
Cs Гідроксид цезію – найсильніша підстава з найвищою електропровідністю у водному розчині; так, наприклад, при роботі з ним необхідно враховувати, що концентрований розчин CsOH руйнує скло навіть при звичайній температурі, а розплав руйнує залізо, кобальт, нікель, а також платину, корунд і діоксид цирконію, і навіть поступово руйнує срібло і золото (у присутності кисню - дуже швидко). Єдиним стійким в розплаві гідроксиду цезію металом є родій і деякі його сплави.
Застосування Цезій знайшов застосування тільки на початку XX століття, коли були виявлені його мінерали та розроблено технологію отримання в чистому вигляді. В даний час цезій і його сполуки використовуються в електроніці, радіо-, електро-, рентгенотехніці, хімічної промисловості, оптиці, медицині, ядерній енергетиці. В основному застосовується стабільний природний цезій-133, і обмежено - його радіоактивний ізотоп цезій-137, що виділяється із суми уламків поділу урану, плутонію, торію в реакторах атомних електростанцій.
Цезій в живих організмах Цезій в живих організмах - постійний хімічний мікроелемент організму рослин і тварин. Морські водорості наприклад містять від 0,01-0,1 мкг цезію в 1 г сухої речовини, наземні рослини - 0,05-0,2. Тварини отримують цезій з водою і їжею. В організмі членистоногих близько 0,067-0,503 мкг / г цезію, плазунів - 0,04, ссавців - 0,05. Головне депо цезію в організмі ссавців - м'язи, серце, печінка; в крові - до 2,8 мкг / л цезій щодо малотоксичний; його біологічна роль в організмі рослин і тварин остаточно не розкрита. Найбільший коефіцієнт накопичення цезія відмічений у північних оленів і північноамериканських водоплавних птахів. Накопичується у грибах, ряд яких (маслюки, моховики, корбан, горькушки, польський гриб) вважається «акумуляторами» радіоцезію
Металургія Металевий цезій на зорі пошуків його асиміляції в промисловості виявив властивість різко підвищувати жаропрочність магнію і алюмінію, так наприклад добавка 0,3-0,4% цезію до магнію в 3 рази підвищує його міцність на розрив і різко покращує його корозійну стійкість, але зважаючи вельми високої ціни, та наявності інших більш дешевих металів для легування він не застосовується для цієї мети.
Каталізатори Каталітична активність цезію використовується в процесах отримання аміаку, сірчаної кислоти, бутилового спирту, в реакціях дегидрогенизації, при отриманні мурашиної кислоти. Особливо ефективним є застосування цезію як промотора при каталітичному отриманні аміаку, синтезі бутадієну, і має дуже велике економічне значення оскільки різко збільшує ефективність синтезу. мурашина кислота У цілому застосування цезію в каталізі має не тільки велику сферу його споживання але і великі перспективи подальшого розвитку. Цезій промотуючу дію срібного каталізатора і підвищує його селективність при епоксидуванні етилену. Сірчана кислота
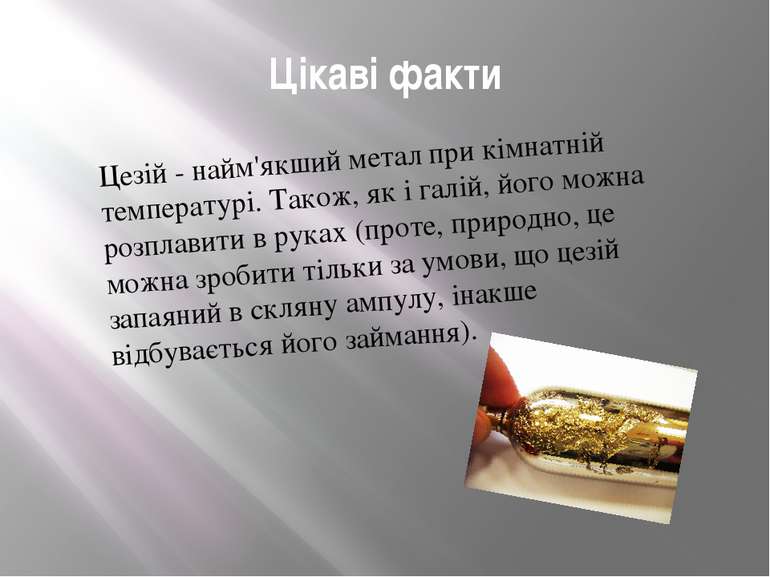
Цікаві факти Цезій - найм'якший метал при кімнатній температурі. Також, як і галій, його можна розплавити в руках (проте, природно, це можна зробити тільки за умови, що цезій запаяний в скляну ампулу, інакше відбувається його займання).
Схожі презентації
Категорії