Презентація на тему:
Металічні руди. Загальні методи добування металів
Завантажити презентацію
Металічні руди. Загальні методи добування металів
Завантажити презентаціюПрезентація по слайдам:
Металічні руди. Загальні методи добування металів Підготувала: учениця 10-Б класу Мукачівської ЗОШ №13 1-3ст. Котик Сніжана
План: 1.Залізо (Fe); 2.Основні руди заліза; 3.Фізичні властивості заліза; 4.Самородні метали; 5.Добування металів.
Хімічний елемент- Fe; порядковий номер- 26; група- 8; побічна підгрупа; 4 парний ряд; 4 період; заряд ядра- 26; валентність Fe- 2 і 3; відносна атомна маса, Ar(Fe)=56; відносна формульна маса, Mr(Fe)=56. Електронна формула- ) 2 ) 8 ) 16 1S2 2S2 2P6 3S2 3P8 +26
При взаємодії іонів [Fe(CN)6]4- з іонами Fe3+ утворюється темно-синій осад - берлінська блакить. 3[Fe(CN)6]4- + 4Fe3+ = Fe4[Fe(CN)6]3
Інша складна сполука заліза – червона кров’яна сіль, або гексаціано- ферат калію, в розчині дисоціює на іони за рівнянням: K3[Fe(CN)6] 3K+ + [Fe(CN)6]3-
А при взаємодії іонів [Fe(CN)6]3- з іонами Fe2+ також утворюється темно-синій осад – турнубулева синь: 2[Fe(CN6)]3- + 3Fe2+ = Fe3[Fe(CN)6]2
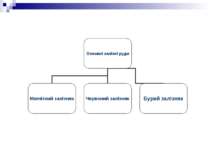
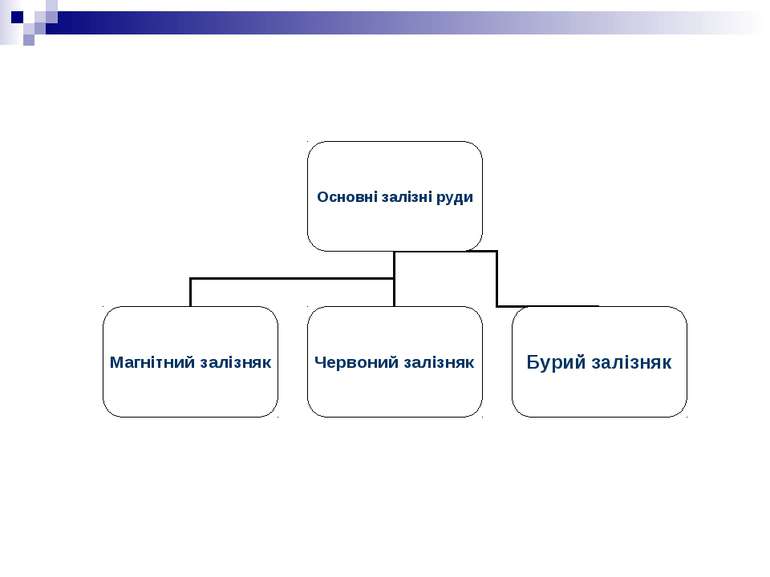
1. Магнітний залізняк Fe3O4 ; Великі родовища цієї руди високої якості є на Уралі – гори Висока, Благодать, Магнітна.
Фізичні властивості заліза Залізо - блискучий сріблясто-білий метал. Густина – 7,8 г см3. Температура плавлення 1539 С. Має добру пластичність. Залізо добре намагнічується і розмагнічується.
Самородні метали Самородні метали- метали,що утворюються в природі під дією різних геохімічних процесів як гомоатомні прості речовини. Наприклад: мідь самородна; золото самородне; залізо самородне; бісмут самородний.
Добування металів Добування металів з руд – це завдання металургії. Металургія – наука про промислові способи добування металів з природної сировини. Металургією також називають металургійну промисловість.
Залежно від способів добування металів розрізняють піро-, гідро- і електрометалургію. Пірометалургія посідає провідне місце у металургії. В основу цього методу покладено реакцію відновлення металу з його оксиду.Так,наприклад,вугілля й оксид вуглецю( ) відновлюють мідь з червоної руди (куприту) Cu2O: Cu2O + C = 2Cu + CO; Cu2O + CO = 2Cu + CO2. II
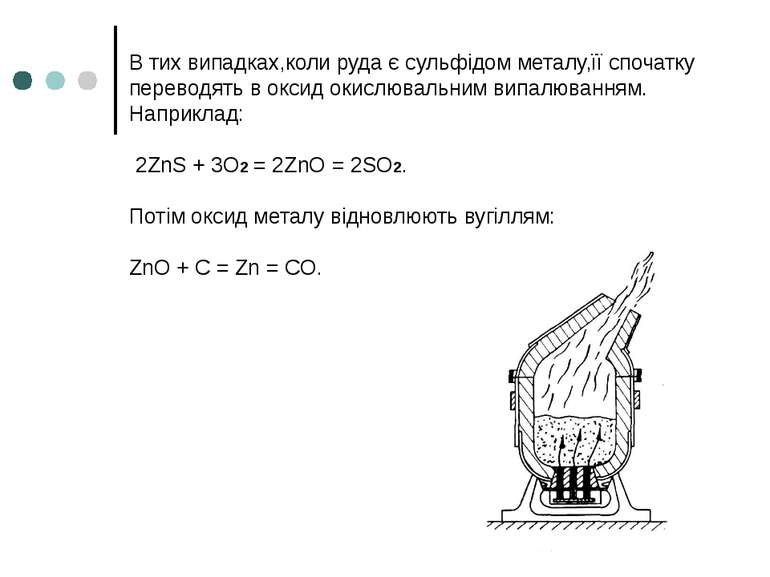
В тих випадках,коли руда є сульфідом металу,її спочатку переводять в оксид окислювальним випалюванням. Наприклад: 2ZnS + 3O2 = 2ZnO = 2SO2. Потім оксид металу відновлюють вугіллям: ZnO + C = Zn = CO.
Гідрометалургія охоплює способи добування металів з розчинів їхніх солей. Так,наприклад,при обробці розбавленою сірчаною кислотою мідної руди,що містить оксид міді СuО мідь переходить у розчин у вигляді сульфату: CuO + H2SO4 = CuSO4 + H2O. Далі мідь добувають з розчину або електролізом, або витісненням залізом: CuSO4 + Fe = Cu + FeSO4.
Електрометалургія охоплює способи добування металів за допомогою електричного струму (електролізу) . Цим способом добувають головним чином, легкі метали з їхніх розплавлених оксидів або металів. Наприклад: добування алюмінію з бокситів. Інший приклад- добування металічного натрію.
Схожі презентації
Категорії




![При взаємодії іонів [Fe(CN)6]4- з іонами Fe3+ утворюється темно-синій осад - ... При взаємодії іонів [Fe(CN)6]4- з іонами Fe3+ утворюється темно-синій осад - ...](https://svitppt.com.ua/images/17/16478/770/img3.jpg)

![А при взаємодії іонів [Fe(CN)6]3- з іонами Fe2+ також утворюється темно-синій... А при взаємодії іонів [Fe(CN)6]3- з іонами Fe2+ також утворюється темно-синій...](https://svitppt.com.ua/images/17/16478/770/img5.jpg)

















![При взаємодії іонів [Fe(CN)6]4- з іонами Fe3+ утворюється темно-синій осад - ... При взаємодії іонів [Fe(CN)6]4- з іонами Fe3+ утворюється темно-синій осад - ...](https://svitppt.com.ua/images/17/16478/210/img3.jpg)

![А при взаємодії іонів [Fe(CN)6]3- з іонами Fe2+ також утворюється темно-синій... А при взаємодії іонів [Fe(CN)6]3- з іонами Fe2+ також утворюється темно-синій...](https://svitppt.com.ua/images/17/16478/210/img5.jpg)