Презентація на тему:
Робота газу. Перший закон термодинаміки.
Завантажити презентацію
Робота газу. Перший закон термодинаміки.
Завантажити презентаціюПрезентація по слайдам:
Мета: розглянути питання про роботу в термодинаміці, розмежуючи поняття робота газу і робота над газом, пояснити зміст рівняння першого закону термодинаміки щодо різних теплових процесів, розвивати вміння користуватися методами індукції і дедукції; виховувати творчу активність, ініціативу.
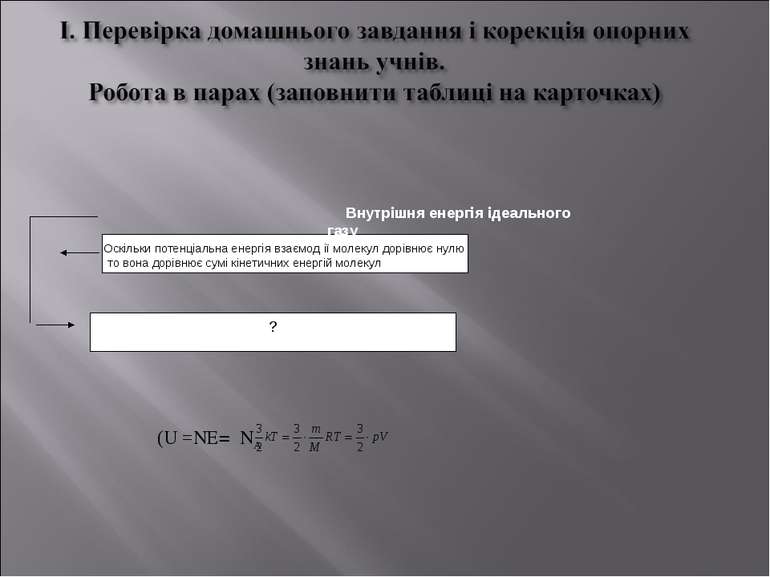
Оскільки потенціальна енергія взаємодії молекул дорівОскільки потемолекул, ? Внутрішня енергія ідеального газу Оскільки потенціальна енергія взаємод ії молекул дорівнює нулю то вона дорівнює сумі кінетичних енергій молекул, (U =NE=νNA
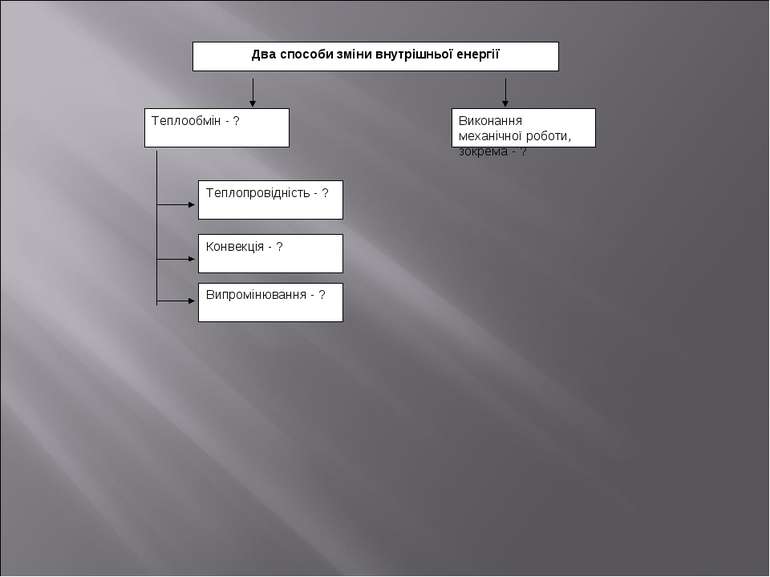
Два способи зміни внутрішньої енергії Теплообмін - ? Теплопровідність - ? Конвекція - ? Випромінювання - ? Виконання механічної роботи, зокрема - ?
ІІ. Повідомлення теми, мети, мотивація навчальної діяльності. «Розум полягає не тільки в знанні, але й в умінні застосовувати знання на ділі» Аристотель. ІІІ. Сприйняття і первинне усвідомлення нового матеріалу, розуміння зв’язків і співвідношень в об’єктах вивчення. Метод «Ажурна пилка» Учні поділені на 3-4 групи (домашні). Завдання на карточках (схеми, опорні таблиці). Учні розглядають схеми, співвідносять із матеріалом підручника (1 група – ізотерми; 2 група – ізобари; 3 група – ізохори; 4 група - адіабати). Учні об’єднуються в групи «експертів» (1 від групи) і обговорюють матеріал. «Експерти» повертаються в групи «домашніх» і діляться отриманими знаннями. Завдання «домашніх» груп – корекція та остаточне узагальнення всієї інформації.
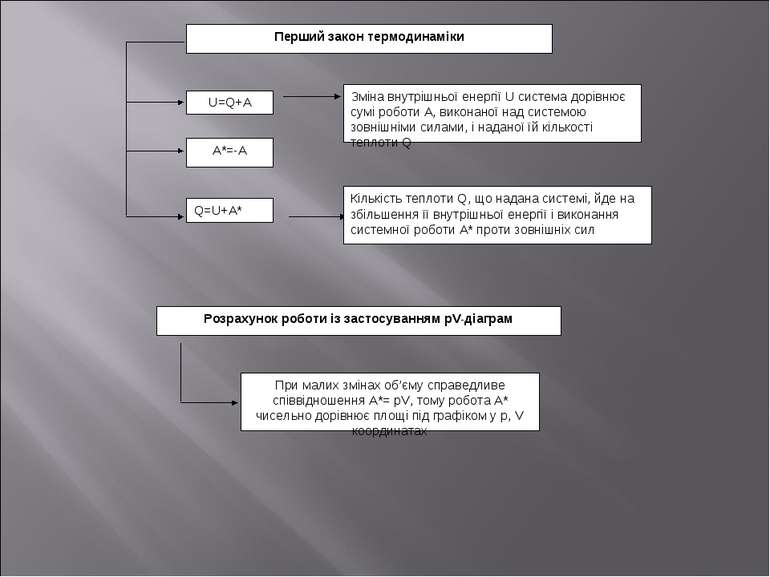
Перший закон термодинаміки U=Q+A A*=-A Q=U+A* Зміна внутрішньої енергії U система дорівнює сумі роботи А, виконаної над системою зовнішніми силами, і наданої їй кількості теплоти Q Кількість теплоти Q, що надана системі, йде на збільшення її внутрішньої енергії і виконання системної роботи А* проти зовнішніх сил Розрахунок роботи із застосуванням pV-діаграм При малих змінах об’єму справедливе співвідношення А*= pV, тому робота А* чисельно дорівнює площі під графіком у p, V координатах
Застосування першого закону термодинаміки до ізопроцесів у газах Ізохорне нагрівання:V= 0; А=0; U=Q=cvm(T2-T1), cv – питома теплоємність при сталому об’ємі. Перший закон термодинаміки: U=Q=cvm(T2-T1) Ізобарне нагрівання: p=const, A*=pV; А*=pV=;Q=cvmT+ ; зміна внутрішньої енергії U =cv mT. Q=cpT, cp=cv+, де cp – питома теплоємність при сталому тиску. Ізотермічне розширення:U= 0; А*>0; тому Q>0, газ отримує енергію ззовні.Ізотермічне стиснення: U=0; А*
Адіабатний процес Відбувається без теплообміну системи із зовнішнім середовищем (навколишніми тілами). Система або тепло ізольована термос, або процес відбувається настільки швидко, що дуже незначна частина теплоти передається навколишнім тілам, які не входять у дану систему наприклад, вибух, постріл. U= А+Q (Q=0) U=А – робота виконується за рахунок зміни внутрішньої енергії тіла При адіабатному розширенні газ охолоджується (холодильні машини), при стисненні – нагріваються (повітряне вогниво, двигун Дізеля).
IV. Узагальнення і систематизація знань. 1. Презентація кожною групою свого проекту. - Перший закон термодинаміки і застосування його до 1 група – ізотерми; 2 група – ізобари; 3 група – ізохори; 4 група – адіабати. - Розв’язок задачі з теми. V. Підведення підсумків уроку і повідомлення домашнього завдання. Д/З. вивчити опорні конспекти. Задачі (Л.А. Кирик С.р. №7. 1.2 (Д.р.) С.р. №8. 1.2 (Д.р.)
Схожі презентації
Категорії