Презентація на тему:
Квантова механіка
Завантажити презентацію
Квантова механіка
Завантажити презентаціюПрезентація по слайдам:
Структура енергетичних рівнів молекул є набагато складнішою ніж у атомів. Це обумовлено тим, що повна енергія молекули складається не тільки з електронної, але й енергії коливань ядер та енергії обертання молекули. У зв'язку із цим у випромінюванні молекул спостерігаються електронні, коливальні та обертальні спектри, а також їх комбінації (наприклад, коливально -обертальні спектри). Найбільш зручними об'єктами для демонстрації особливостей молекулярних спектрів, є їх найпростіші представники - двохатомні молекули.
Згідно з квантовою механікою енергія всіх видів руху в молекулі може набувати тільки певних значень, тобто вона квантується. У першому наближенні окремі види молекулярних рухів – рух електронів, коливання ядер та обертання молекули – можна вважати незалежними одне від одного.
1 2 Рисунок 1 Залежність енергії двохатомної молекули від відстані між ядрами для основного (крива 1) і збудженого (крива 2) станів В основному, зміна енергетичного запасу енергії відбувається за рахунок зміни електронної конфігурації периферичної частини молекули. При заданій електронній конфігурації ядра молекули можуть по-різному виконувати коливання та обертання відносно загального центру мас. Саме з цими видами руху пов’язані запаси коливальної та обертальної енергії.
Електронна енергія – це енергія, обумовлена електронною конфігурацією. Вона має мінімум при певному значенні (крива 1 на рис.1). Зміна електронної конфігурації молекули призводить до зміни кривої залежності електронної енергії від відстані між ядрами . Асимптотичне значення енергії також стає іншим – воно дорівнює сумарній енергії ізольованих атомів в новому квантовому стані (крива 2 на рис.1).
Правила добору – це правила, які визначають можливі квантові переходи для атомів, молекул, атомних ядер, елементарних частинок, що взаємодіють та т.і. Оптичні правила добору визначають, які квантові переходи є дозволеними (вірогідність переходу є значною) і які заборонені строго (вірогідність переходу дорівнює нулю) або наближено (вірогідність переходу – мала). Під час характеристики станів системи за допомогою квантових чисел оптичні правила добору визначають можливі зміни цих чисел при переході певного типу.
Коливання ядер у молекулі описують за допомогою моделі квантового гармонічного осцилятора. Енергія такого осцилятора дозволяє визначити коливальну енергію молекули для невеликих значень коливального числа та визначається співвідношенням коливальне квантове число, класична частота осцилятора. Для коливального квантового числа існує правило добору
Розглянемо обертання молекули. Енергія системи, яка має момент інерції I та обертається з кутовою швидкістю дорівнює: - момент імпульсу молекули. Момент імпульсу згідно з квантовою теорією може набувати лише дискретних значень: де J - обертальне квантове число.
Таким чином, обертальна енергія молекули може набувати лише дискретних значень: де I - момент інерції молекули відносно осі, яка проходить через центр мас. Для обертального квантового числа також є правило добору: Тоді повна енергія молекули дорівнює:
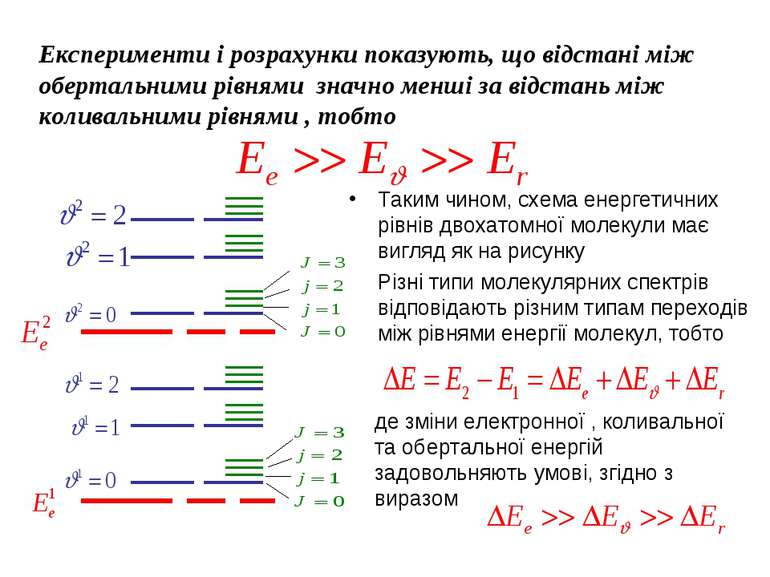
Експерименти і розрахунки показують, що відстані між обертальними рівнями значно менші за відстань між коливальними рівнями , тобто Таким чином, схема енергетичних рівнів двохатомної молекули має вигляд як на рисунку Різні типи молекулярних спектрів відповідають різним типам переходів між рівнями енергії молекул, тобто де зміни електронної , коливальної та обертальної енергій задовольняють умові, згідно з виразом
На відміну від лінійчастих спектрів атомів молекулярні спектри складаються із смуг, тобто є смугастими. У випадку застосування приладів з високим розрізненням виявляється, що ці смуги містять велику кількість тісно розташованих ліній. Залежно від того, зміна яких видів енергії молекули (електронної, коливальної чи обертальної) обумовлює випромінювання фотону, розрізняють три види смуг: 1) обертальні; 2) коливально – обертальні; 3) електронно – коливальні.
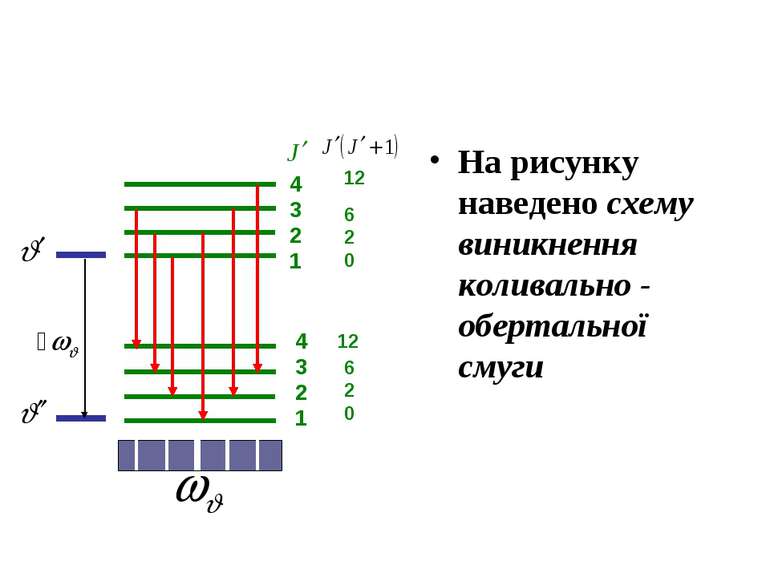
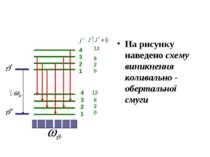
4 3 2 1 12 6 2 0 Схема виникнення обертальної смуги Двохатомну молекулу можна в першому наближенні розглядати як жорсткий ротатор (дзиґу) з моментом інерції J. Розв'язання рівняння Шредінгера для жорсткого ротатора дає наступні дозволені рівні енергії згідно з рівнянням
З правила добору для дозволених переходів випливає, що обертальний спектр складається з низки рівновіддалених ліній, які мічтяться в далекій інфрачервоній області. з частотами де Обертальні спектри багатоатомних молекул мають подібну структуру.
випливає, що для коливальних переходів існує тільки одна частота Але оскільки в молекулі відбуваються одночасно і коливання і обертання, то виникає коливально - обертальний спектр, в якому на коливальну частоту накладається «гребінка» обертальних ліній. Насправді молекулярні зв’язки не є жорсткими. В найпростішому наближенні рух ядер двохатомної молекули можна розглядати як коливання гармонічного квантового осцилятора. З правила добору для дозволених (інфрачервоних) переходів
На рисунку наведено схему виникнення коливально - обертальної смуги 4321 4321 620 12 620 12
У випадку, коли під час переходу змінюється і коливальний і обертальний стан молекули, енергія випромінюваного фотону складе:
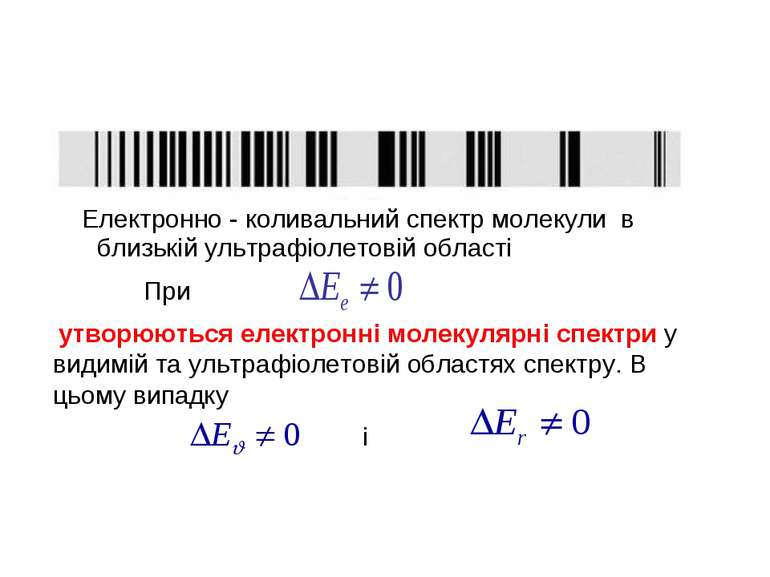
У молекул є велика кількість збуджених електронних рівнів, переходи між якими супроводжуються зміною коливальної та обертальної енергії. Внаслідок цього структура електронних спектрів молекул істотно ускладнюється. Електронний спектр являє собою серію коливальних смуг, кожна з яких містить десятки або сотні обертальних ліній. Як правило, в молекулярних спектрах спостерігається кілька електронних переходів в близькій інфрачервоній, видимій та ультрафіолетовій областях. Наприклад, в спектрі молекули йоду (J2) є біля 30 електронних переходів.
Електронно - коливальний спектр молекули в близькій ультрафіолетовій області утворюються електронні молекулярні спектри у видимій та ультрафіолетовій областях спектру. В цьому випадку При і
Методи молекулярної спектроскопії, які вивчають молекулярні спектри, дозволяють вирішувати різно-манітні завдання хімії, біології й ін. наук (наприклад, визначати сполуки нафтопродуктів, полімерних речо-вин і т.і.). У хімії за молекулярними спектрами вив-чають структуру молекул. Електронні молекулярні спектри дають можливість одержувати інформацію про електронні оболонки молекул. Дослідження колива-льних молекулярних спектрів дозволяє знаходити характеристичні частоти коливань, що відповідають певним типам хімічних зв'язків у молекулі, різних груп атомів, визначати просторову структуру молекул. Дослідження обертальних молекулярних спектрів, а також обертальної структури електронних і коливаль-них спектрів дозволяє за знайденими з досліду значен-нями моментів інерції молекул знаходити з великою точністю параметри рівноважної конфігурації молекули — довжини зв'язків і валентні кути.
Рентгенівське випромінювання - це електромагнітне іонізуюче випромінювання, яке займає спектральну область між гам-ма і ультрафіолетовим вип-ромінюванням у межах довжин хвиль від 10-5 нм до 100 нм. Рентгенівські промені з довжи-ною хвилі 0,2 нм - м'якими рентгенівськими променями. Найпоширенішим джерелом рентгенівських променів є рентгенівська трубка. Природ-ними джерелами рентгенівсь-ких променів є Сонце та інші космічні об'єкти. Загальний вигляд рентгенівських трубок для структурного ана-лізу (а), дефектоско-пії (б) і медичної рент-генодіагностики (в).
Рентгенівські промені було відкрито в 1895 р. Рентгеном і названі ним Х- променями (цей термін застосовується в багатьох країнах). Протягом 1895—97 Рентген досліджував властивості рентгенівського випромінювання і створив перші рентгенівські трубки. Він виявив, що жорсткі рентгенівські промені проникають через різні матеріали та м'які тканини людського тіла (ця властивість рентгенівських променів швидко знайшла застосування в медицині). Відкриття рентгенівських променів привернуло увагу вчених усього світу, і вже в 1896 було опубліковано понад 1000 робіт з досліджень і застосувань рентгенівських променів. Вільгельм РЕНТГЕН ( 1845 – 1923р.) перший (1901 р.) лауреат Нобелівської премії з фізики «за надзвичайно важливі заслуги перед наукою, які полягали у відкритті рентгенівських променів»
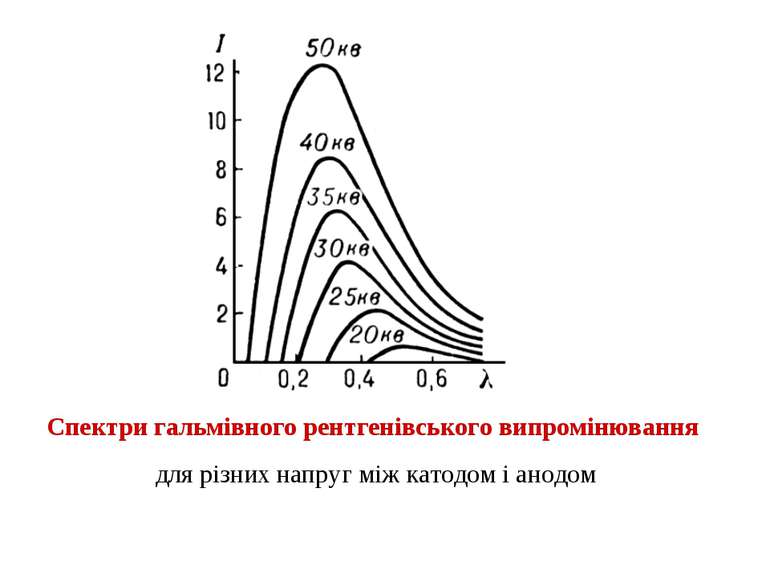
Суцільний рентгенівський спектр випромінюють швидкі заряджені частинки під час їх гальмування при взаємодії з атомами мішені (гальмівне випромінювання); цей спектр досягає значної інтенсивності лише при бомбардуванні мішені електронами. Інтенсивність гальмівних рентгенівських променів розподілена за всіма частотами до високочастотної (короткохвильової) межі Залежно від механізму виникнення рентгенівських променів розрізняють суцільні (гальмівні) або лінійчасті (характеристичні) рентгенівські спектри.
Гальмівне випромінювання Короткохвильова границя суцільного рентгенівського випромінювання визначається законом збереженням енергією Робота електричного поля з прискорення електрону в рентгенівській трубці дорівнює Під час гальмування електрону вона може повністю перетворитися в енергію кванта рентгенівського випромінювання тоді Така взаємодія здійснюється тільки у випадку лобового зіткнення електрона з ядром. В інших видах зіткнень кінетична енергія електрона втрачається частково і енергія рентгенівських квантів буде меншою, а отже довжини хвиль – більшими. Оскільки зіткнення електронів з ядрами мішені відбуваються під різними кутами, то спектр випромінювання рентгенівських променів є суцільним. Певна частина енергії випромінюється в інших спектральних діапазонах – УФ, видимому та ІЧ. Це призводить до розігрівання аноду, тому його потрібно охолоджувати.
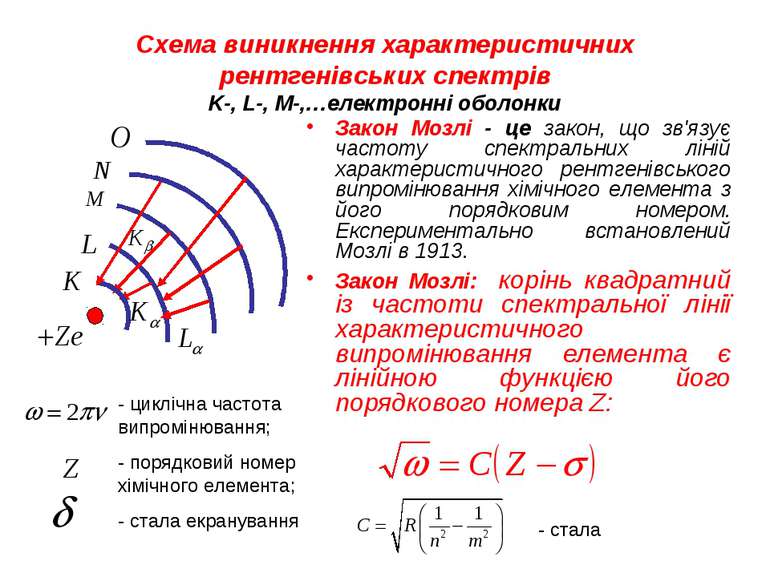
Характеристичне випромінювання Лінійчасте випромінювання виникає після іонізації атома з викиданням електрона з однієї з внутрішніх оболонок. Така іонізація може спричинятися зіткненням атома зі швидкою частинкою, наприклад електроном або поглинанням атомом фотона. Іонізований атом виявляється в початковому квантовому стані на одному з високому збудженому рівні енергії та через 10-16—10-15 с переходить у основний стан з меншою енергією. При цьому надлишок енергії атом може випроменити у вигляді фотона певної частоти. Спектр такого випромінювання є характерним для атомів кожного елемента, тому лінійчастий рентгенівський спектр називається характеристичним. Залежно від переходів (з якого рівня на який) певні групи характеристичних ліній отримали відповідно назви K -, L -, M -, N -, …- серій.
Схема виникнення характеристичних рентгенівських спектрів K-, L-, M-,…електронні оболонки Закон Мозлі - це закон, що зв'язує частоту спектральних ліній характеристичного рентгенівського випромінювання хімічного елемента з його порядковим номером. Експериментально встановлений Мозлі в 1913. Закон Мозлі: корінь квадратний із частоти спектральної лінії характеристичного випромінювання елемента є лінійною функцією його порядкового номера Z: - циклічна частота випромінювання; - порядковий номер хімічного елемента; - стала екранування - стала
Закон Мозлі Згідно з цим законом, частоти лінії можна визначити з формул Для ліній Для ліній Для ліній
МОЗЛІ, ГЕНРІ ГВІН ДЖЕФРІС Англійський фізик. Навчався в Ітоні та Трініті - коледжі Оксфордського університету. У 1910 –1914 працював у лабораторії Резерфорда в Манчестерському, а потім в Оксфордському університетах. У 1913 встановив залежність між частотою спектральних ліній характеристичного рентгенівського випромінювання та атомним номером елемента. (1887–1915)
Застосування рентгенівських променів Найбільш широке застосування рентгенівські промені знайшли в медицині для рентгенодіагностики та рентгенотерапії. Важливе значення для багатьох галузей техніки має рентгенівська дефектоскопія, наприклад для виявлення внутрішніх порожнин виливків (раковин, включень шлаків), тріщин у рейках, дефектів зварених швів. Рентгенівський структурний аналіз дозволяє встановити просторове розташування атомів у кристалічній решітці мінералів і сполук, у неорганічних та органічних молекулах. Рентгенівська мікроскопія дозволяє, наприклад, одержати зображення клітини, мікроорганізму, побачити її внутрішню будову. Рентгенівська спектроскопія за рентгенівськими спектрами вивчає розподіл густин електронних станів за енергіями у різних речовинах, досліджує природу хімічного зв'язку… Рентгенівський спектральний аналіз за положенням та інтенсивністю ліній характеристичного спектра дозволяє встановити якісний і кількісний склад речовини. Рентгенівські промені, що приходять із космосу, несуть інформацію про хімічний склад космічних тіл і про фізичні процеси, що відбуваються у Всесвіті.
Слово "лазер" складене з початкових букв в англійському словосполученні Light Amplification by Stimulated Emission of Radiation, що українською означає: посилення світла за допомогою змушеного випромінювання. Коротка історія створення лазера: 1917 р.- Ейнштейн вводить поняття “змушене випромінювання” 1939 р. – Фабрикант вказав на можливість використання змушеного випромінювання для підсилення електромагнітного випромінювання при його проходженні через речовину. 1952 р. - радянські фізики Басов і Прохоров (Таунс – США) зробили висновок про принципову можливість створення підсилювача випромінювання у СВЧ діапазоні. 1960 р. - Т. Мейман створив перший у світі рубіновий лазер
Мейман Теодор Теодор Мейман увійшов в історію як фізик, якому вперше в світі вдалося отримати лазерний ефект у твердому тілі. Закінчив університет штату Колорадо, потім працював у Стенфорді, в 1955 р. отримав ступінь доктора філософії. Незважаючи на те, що Мейман мав великий дослідницький досвід, у нього ніхто не вірив. Фінансування було скудним. Коли в якості матеріалу для лазера він запропонував рубін, маститі вчені з нього сміялися. Але 16 травня 1960 г. Т. Мейман створив перший у світі рубіновий лазер, випередивши на кілька місяців створення в 1961 р. газового лазера. 1927 - 2007
Академік БАСОВ Басов Микола Геннадійович – відомий радянський фізик віце – голова виконавчої ради Всесвітньої федерації наукових робітників, лауреат Нобелівської премії з фізики (разом с Прохоровим та Таунсом) за розробку принципу дії лазера і мазера. 1922 - 2001
Академік Прохоров (1916–2002) Лауреат (1964) Нобелівської премії з фізики (разом з Басовим і Таунсом) за фундамен-тальні роботи з квантової електроніки. ПРОХОРОВ, ОЛЕКСАНДР МИХАЙЛОВИЧ, російський фізик и радіофізик, народився в Австралії у сім‘ї –російського революціонера, який втік із заслання. В 1923 сім'я повернулась в Росію. В 1939 Прохоров закінчив фізфак ЛДУ та став аспірантом ФІАНу. В 1941 р. був призваний до армії. В 1944, після двох поранень, вернувся до ФІИАНу, де в 1946 захистив канди-датську дисертацію, а в 1951 - докторську з теорії нелінійних коливань. В 1952–1953 разом із своїм аспірантом Басовым сфор-мулював основні положення теорії молекулярного генератора – мазера.
Чарлз Таунс Американський фізик Чарлз Хард Таунс виявив великі здібності ще в школі, вступив до Фурманівського університету у Гринвілі в 16-річному віці. Закінчив його в 1935 р. і став бакалавром наук з фізики и бакалавром мистецтв в області сучасних мов. Після річної аспірантури в Дьюкському університеті Таунс отримав ступінь магістра з фізики в 1936 р., а потім і докторську ступінь в 1939 р. Народився в 1915 р. Лауреат (1964) Нобелівської премії з фізики (разом з Басовим і Прохоровим) за фундаментальні роботи з квантової електроніки.
Спонтанне випромінювання Змушене випромінювання Поглинання Розглянемо 3 фундаментальних процеси, які описують взаємодію фотонів електромагнітного випромінювання з речовиною – спонтанне випромінювання (а), змушене випро-мінювання (б) і поглинання (в). Для простоти розглянемо сере-довище (атом, молекулу) із двома енергетичними рівнями, енергії яких Е1 та Е2 , причому Е2.> Е1 Перехід з верхнього рівня на нижній може супроводжуватися випромінюванням фотона із частотою крім того, існують так звані безвипромінювальні переходи.
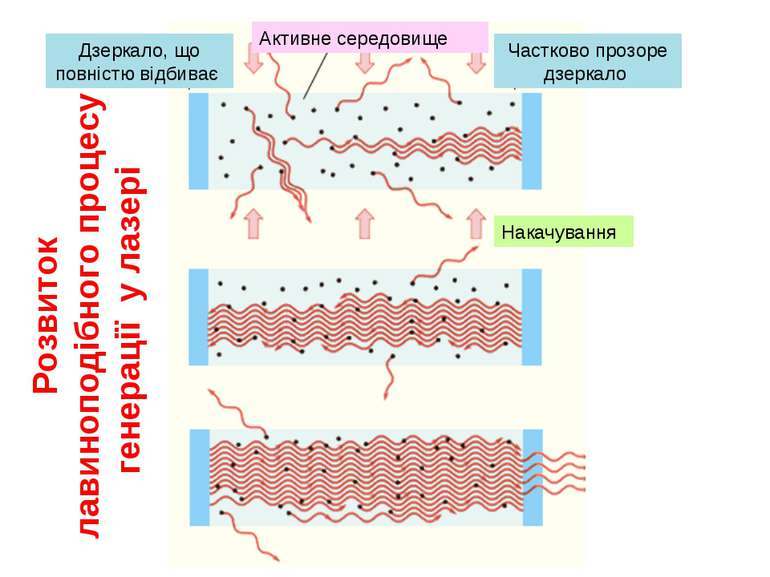
Як довів Ейнштейн у стані термодинамічної рівноваги вірогідності поглинання і змушеного випромінювання однакові. Однак середовище може перебувати в нерівноважному стані, у якому реалізується інверсна населеність рівнів, тобто. У цьому випадку середовище почне підсилювати випромінювання, тобто буде активним середовищем. Переведення середовища в нерівноважний стан здійснюється зовнішнім джерелом енергії (накачування). Слід зазначити, що в середовищі, що має тільки два рівні, інверсна населеність не може бути отримана.
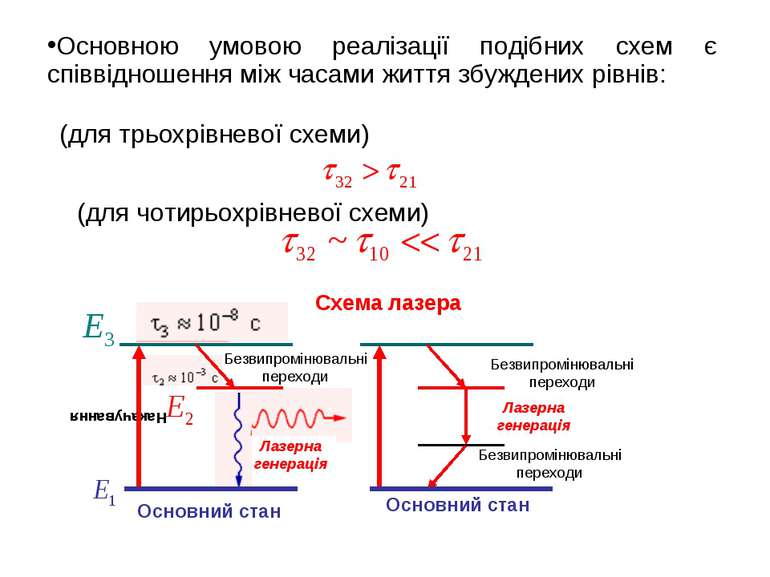
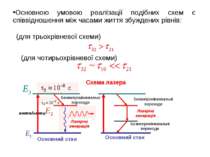
(для трьохрівневої схеми) (для чотирьохрівневої схеми) Схема лазера Основною умовою реалізації подібних схем є співвідношення між часами життя збуждeних рівнів:
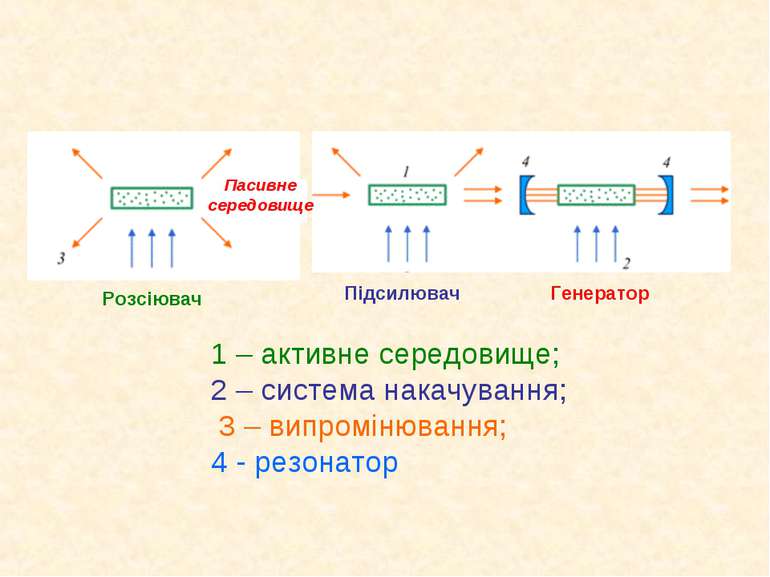
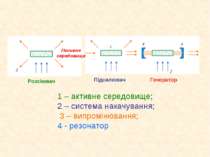
1 – активне середовище; 2 – система накачування; 3 – випромінювання; 4 - резонатор Пасивне середовище Розсіювач Підсилювач Генератор
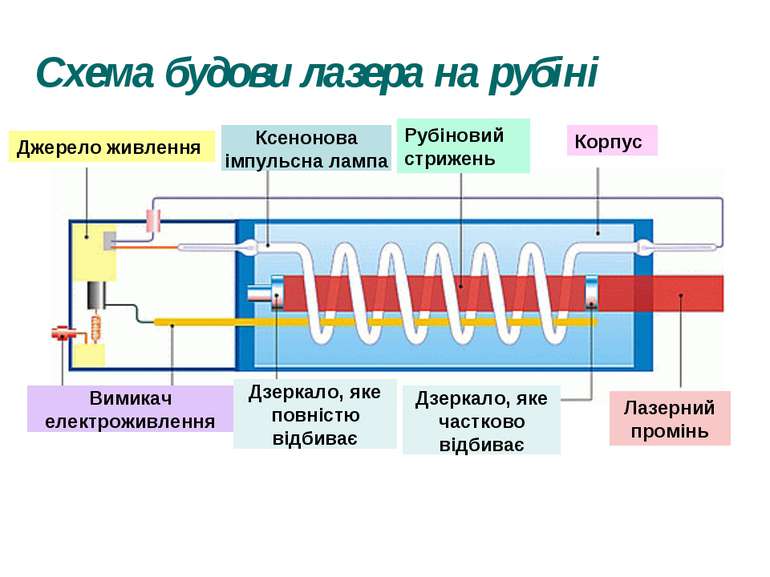
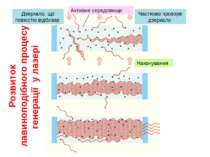
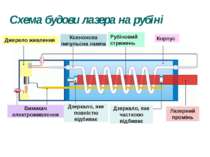
Рубіновий лазер Рубін - це твердий кристал, основою якого є корунд, тобто кристал окису алюмінію (Al2O3), у якому невелика частина атомів алюмінію (близько 0,05%) заміщена іонами хрому Cr+++. Для створення інверсної населеності використовується оптичне накачування, тобто освітлення кристала рубіна потужним спалахом світла. Рубіну надають форму циліндричного стрижня, кінці якого ретельно відполіровані, посріблені, і служать дзеркалами для лазера. Для освітлення рубінового стрижня застосовують імпульсні ксенонові газорозрядні лампи, через які розряджаються батареї високовольтних конденсаторів. Лампа-Спалах має форму спіральної трубки, що обвивається навколо рубінового стрижня. Під дією потужного імпульсу світла в рубіновому стрижні створюється інверсна заселеність і завдяки наявності дзеркал збуджується лазерна генерація, тривалість якої трохи менша за тривалість спалаху лампи, що накачує.
1) Висока ступінь монохроматичності. На практиці в спеціальних умовах вдається добитися, щоб відносна ширина спектральної лінії лазерного випромінювання в 107 - 108 разів була меншою за ширину найвужчих ліній спонтанного випромінювання, які спостерігаються в природі. 2) Когерентність. 3) Вузька спрямованість. В лазері вдається одержати розбіжність променя меншою 10-4 радіани, тобто на рівні кутових секунд. 4) Висока густина потужності.
Дати коротку відповідь на нижченаведені питання 1 Скільки типів молекулярних спектрів розрізняють? 1) 1; 2) 2; 3) 3; 4) 4 2 Перелічить квантові числа, які визначають енергію молекули 3 Сформулюйте правило добору для коливального квантового числа 4 Яким є молекулярний спектр? суцільним; 2) смугастим; 3) лінійчастим 5 Визначить короткохвильову границю суцільного рентгенівського випромінювання, коли напруга між катодом і анодом дорівнює 50кВ 6 Визначить циклічну частоту лінії олова (Z=50) 7 У скільки разів довжина хвилі де Бройля електрона більша за довжину хвилі де Бройля протона, що рухаються з однаковими швидкостями? 1) однакові; 2) у 1838; 3) у 1/1838 8 Які з нижченаведених блоків не містить квантовий генератор? 1) Активне середовище; 2) монохроматор; 3) резонатор; 4) система накачування; 5) охолоджувач; 6) поляризатор 9 У скільки разів повна енергія електрона на другому енергетичному рівні одновимірної потенціальної ями більша ніж на першому? 1) 1/4; 2) 2; 3) 1/2; 4) 4 10 Чому дорівнює спін електрона?
Схожі презентації
Категорії