Презентація на тему:
Атом і атомне ядро. Дослід Резерфорда
Завантажити презентацію
Атом і атомне ядро. Дослід Резерфорда
Завантажити презентаціюПрезентація по слайдам:
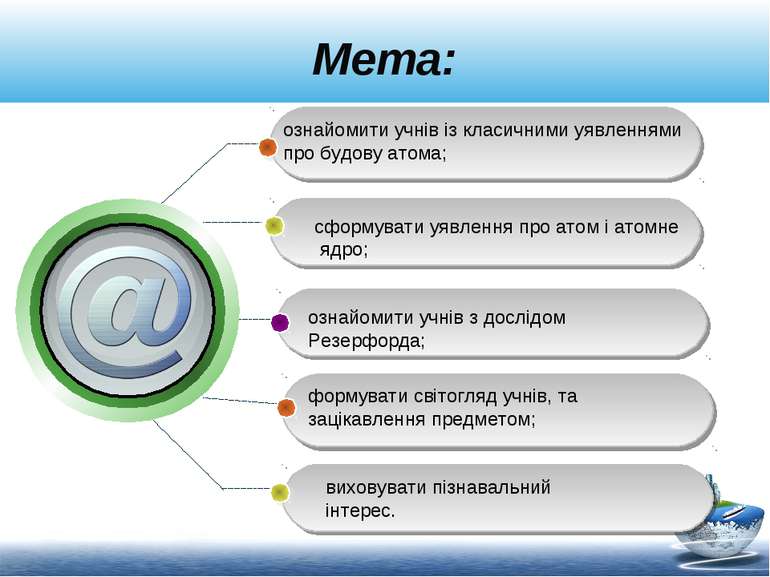
Мета: ознайомити учнів із класичними уявленнями про будову атома; сформувати уявлення про атом і атомне ядро; ознайомити учнів з дослідом Резерфорда; формувати світогляд учнів, та зацікавлення предметом; виховувати пізнавальний інтерес.
Актуалізація опорних знань Питання для бесіди: Що ви знаєте про будову речовини? Що означає слово “ атом ”? З чого складається атом? Що таке електрон? З чого складається ядро атома? Чи знаєте ви про існування ядерної фізики? Слово атом походить від грецького “ atomos ” – неподільний. Як ви гадаєте, чому?
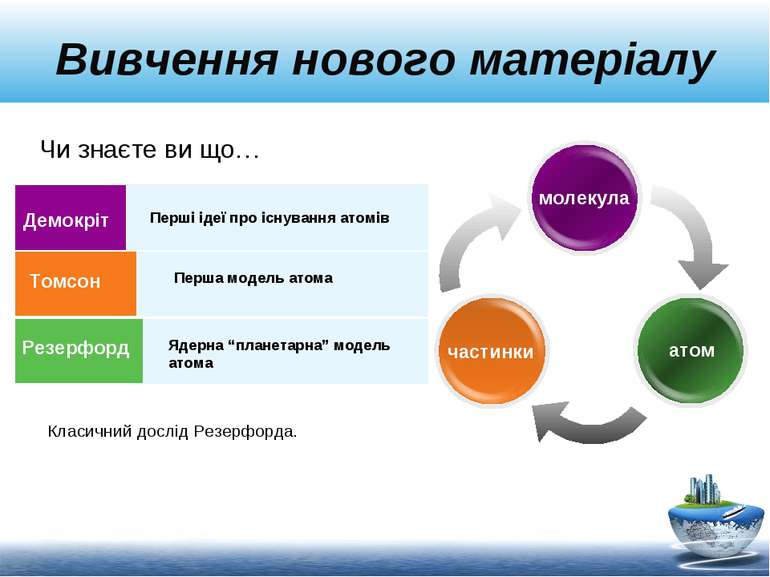
Вивчення нового матеріалу Демокріт Томсон Резерфорд Перші ідеї про існування атомів Перша модель атома Ядерна “планетарна” модель атома молекула частинки атом Класичний дослід Резерфорда. Чи знаєте ви що…
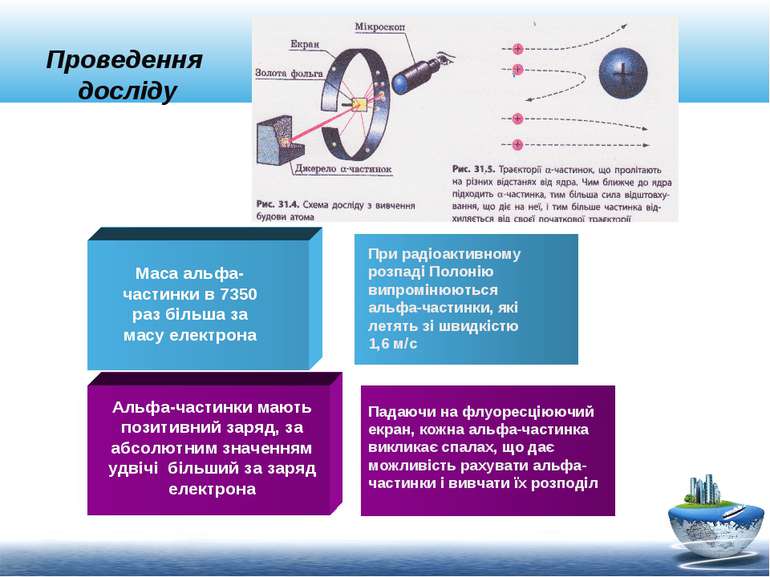
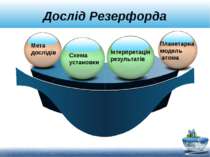
Дослід Резерфорда Мета дослідів Планетарна модель атома Схема установки Інтерпретація результатів
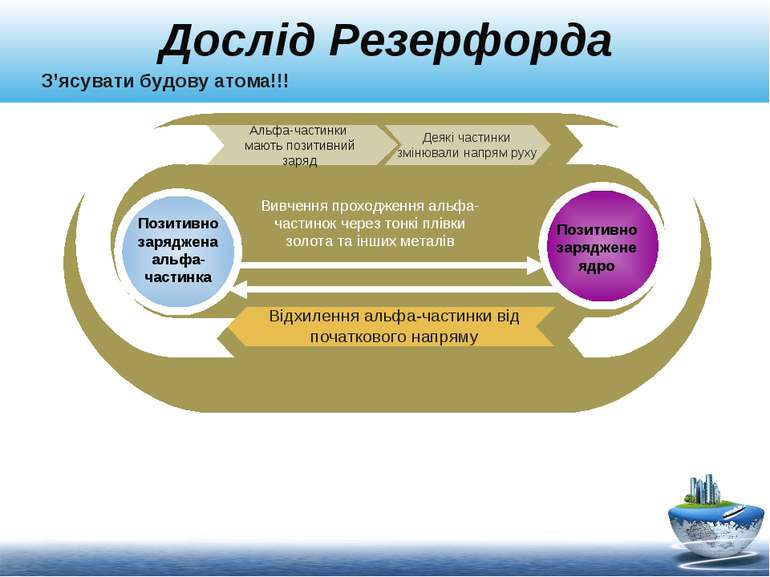
Дослід Резерфорда Альфа-частинки мають позитивний заряд Відхилення альфа-частинки від початкового напряму Деякі частинки змінювали напрям руху Позитивно заряджена альфа-частинка Позитивно заряджене ядро Вивчення проходження альфа-частинок через тонкі плівки золота та інших металів З’ясувати будову атома!!!
Проведення досліду Альфа-частинки мають позитивний заряд, за абсолютним значенням удвічі більший за заряд електрона Падаючи на флуоресціюючий екран, кожна альфа-частинка викликає спалах, що дає можливість рахувати альфа-частинки і вивчати їх розподіл Маса альфа-частинки в 7350 раз більша за масу електрона При радіоактивному розпаді Полонію випромінюються альфа-частинки, які летять зі швидкістю 1,6 м/с
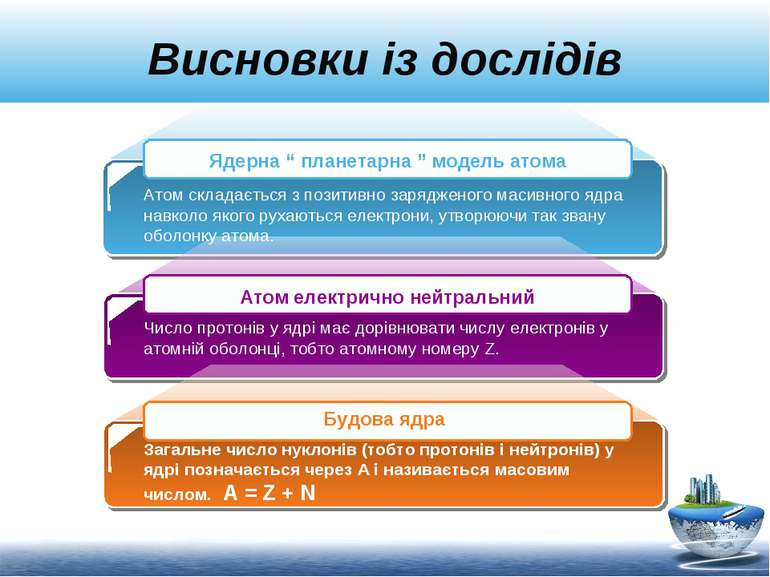
Висновки із дослідів Атом складається з позитивно зарядженого масивного ядра навколо якого рухаються електрони, утворюючи так звану оболонку атома. Число протонів у ядрі має дорівнювати числу електронів у атомній оболонці, тобто атомному номеру Z. Загальне число нуклонів (тобто протонів і нейтронів) у ядрі позначається через А і називається масовим числом. А = Z + N Ядерна “ планетарна ” модель атома Атом електрично нейтральний Будова ядра
Закріплення нового матеріалу Що являла собою перша модель атома? Які сили утримують електрон на орбіті? Як дізнатися про кількість електронів в атомі? Що можна сказати про заряд ядра? Які частинки рухаються навколо ядра? Який у них заряд? Хто досліджував структуру атома? Чому модель називають планетарною? Фронтальне опитування Чи знаєте ви… Що має більшу масу: атом Літію чи позитивний йон Літію? Атом Хлору чи негативний Йон Хлору? У ядрі Карбону 12 частинок. Навколо ядра рухаються 6 електронів. Скільки в ядрі протонів і нейтронів?
Схожі презентації
Категорії