Презентація на тему:
sensor_procaritiot 8 11 11
Завантажити презентацію
sensor_procaritiot 8 11 11
Завантажити презентаціюПрезентація по слайдам:
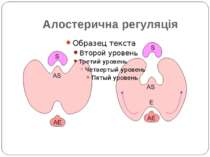
Основні компоненти сенсорних систем Мембранний чи цитоплазматичний сенсор, що детектує зміни навколишніх умов Внутрішньоклітинні посередники Ефектор – безпосередний регулятор клітинної відповіді NB!!! Мембрана – теж сенсор
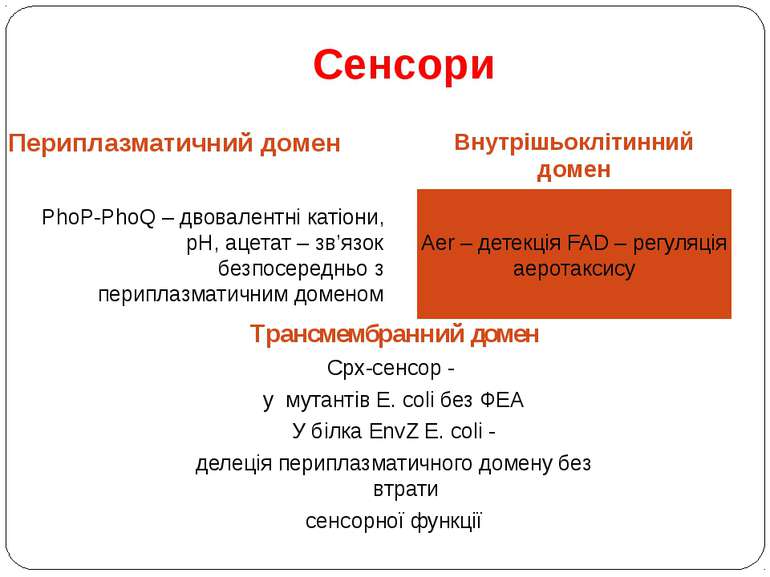
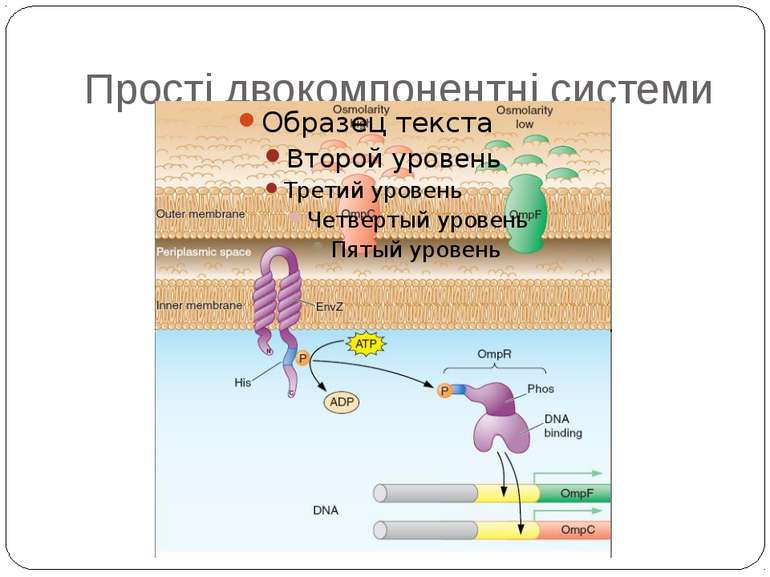
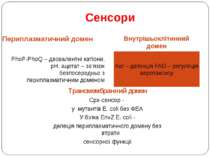
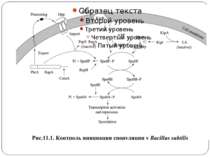
Сенсори Периплазматичний домен Внутрішьоклітинний домен PhoP-PhoQ – двовалентні катіони, рН, ацетат – зв’язок безпосередньо з периплазматичним доменом Aer – детекція FAD – регуляція аеротаксису Трансмембранний домен Cpx-сенсор - у мутантів E. coli без ФЕА У білка EnvZ E. coli - делеція периплазматичного домену без втрати сенсорної функції
Рухомість білків у мембрані Латеральна дифузія 0,1 мкм/с - 0,001 мкм/с Фактори: Текучість мембрани (визначається ліпідним складом) Належність до великого білкового комплексу – важке переміщення Власне мембранні структури – контакти, десмосоми і т.д. Заякореність на елементах цитоскелету
Ознаки вторинного посередника синтезуються клітиною у відповідь на позаклітинний стимул, тобто є задіяними у передачі сигналу від первинного месенджера; Беруть участь у процесах передачі сигналу у клітині, що їх синтезує; видаляються після закінчення дії сигналу.
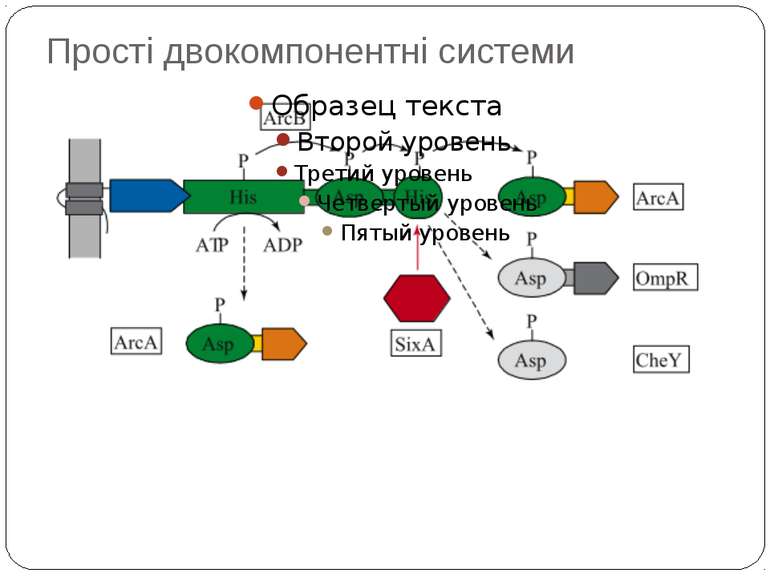
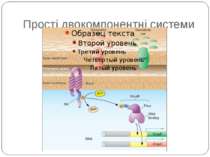
Механізм передачі сигналу Лінійна структура TM1–P–TM2–L–C, де P - периплазматичний домен-детектор C - цитоплазматичний сигнальний домен гістидинкіназа (EnvZ) або з гістидинкіназою взаємодіє (MCP рецептори хемотаксису) TM – трансмембранні сегменти L - цитоплазматичний лінкер Рецептори – гомодимери Р С ?
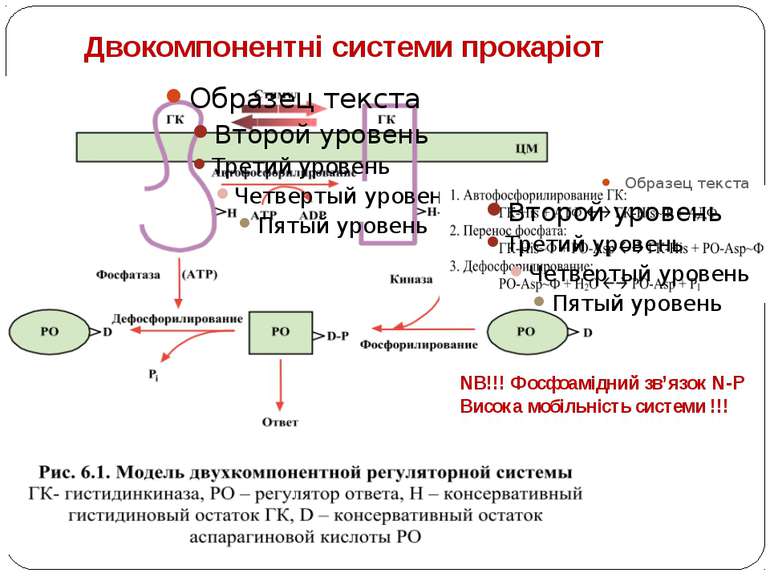
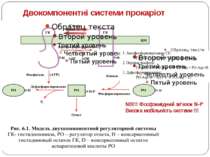
Двокомпонентні системи прокаріот NB!!! Фосфоамідний зв’язок N-P Висока мобільність системи !!!
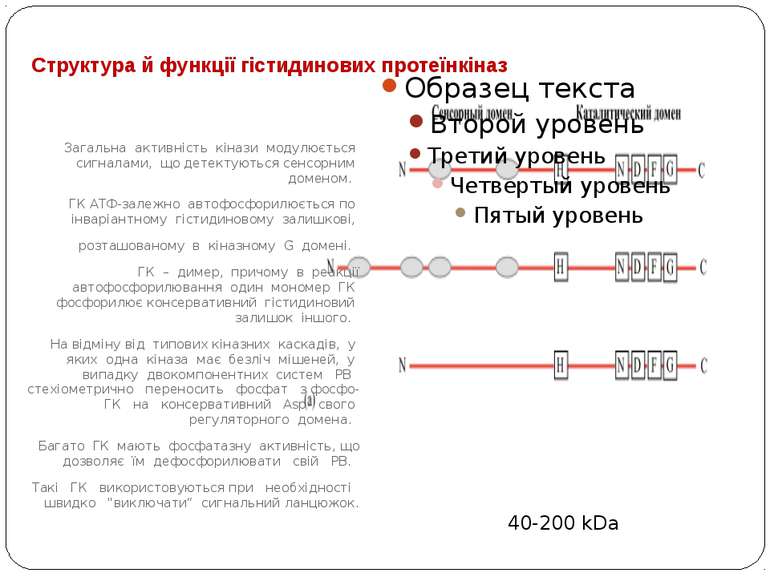
Структура й функції гістидинових протеїнкіназ Загальна активність кінази модулюється сигналами, що детектуються сенсорним доменом. ГК АТФ-залежно автофосфорилюється по інваріантному гістидиновому залишкові, розташованому в кіназному G домені. ГК – димер, причому в реакції автофосфорилювання один мономер ГК фосфорилює консервативний гістидиновий залишок іншого. На відміну від типових кіназних каскадів, у яких одна кіназа має безліч мішеней, у випадку двокомпонентних систем РВ стехіометрично переносить фосфат з фосфо-ГК на консервативний Asp свого регуляторного домена. Багато ГК мають фосфатазну активність, що дозволяє їм дефосфорилювати свій РВ. Такі ГК використовуються при необхідності швидко "виключати“ сигнальний ланцюжок. 40-200 kDa
Типи ГК “класичні” “гібридні” осмосенсор EnvZ из E. coli (трансмембранний компонент) кінази хемотаксису CheA і азотного регулоні NtrB (без трансмембранного компоненту) Множинні донорні і акцепторні сайти ArcB - регулятор активності ряду генів в анаеробних умовах - два N-кінцевих трансмембранних сегменти, за якими кіназний домен, потім домен, схожий на регуляторний і другий гістидинвмісний домен HPt-домен
Каталітичне кіназне ядро домен димеризації і АТФ/АДФ-зв’язуючий фосфотрансферний чи каталітичний домен. розмір ~350 АК Консервативний залишок гістидину в домені димеризації.
HPt-домени Виключно в складі гібридних кіназ розмір біля 120 АК містять залишок гістидину, який здатен брати участь в фосфотрансферних реакціях. HPt-домени не мають ні кіназної, ні фосфатазної активності !!!
Сенсорний домен Специфічні Н.: PAS-домени – невеликі (~100 АК), розміщені перед (ближче до N-кінця) кіназним ядром, як правило, після одної чи кількох пар трансмембранних сегментів Кофактори - гем, ФАД, ФМН і т.д.
Лінкерний домен 40-180 АК. характерний α-спіральний coiled coil мотив, в більшості випадків перед фосфорильованим гістидиновим залишком кіназного ядра. Функції: правильне розміщення мономерів в димері ГК передача сигнала від сенсорної до кіназної частини білка
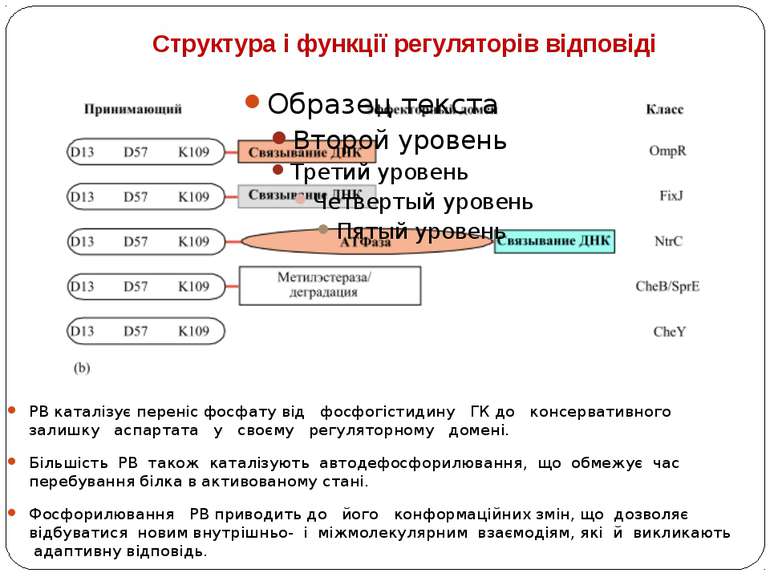
Структура і функції регуляторів відповіді РВ каталізує переніс фосфату від фосфогістидину ГК до консервативного залишку аспартата у своєму регуляторному домені. Більшість РВ також каталізують автодефосфорилювання, що обмежує час перебування білка в активованому стані. Фосфорилювання РВ приводить до його конформаційних змін, що дозволяє відбуватися новим внутрішньо- і міжмолекулярним взаємодіям, які й викликають адаптивну відповідь.
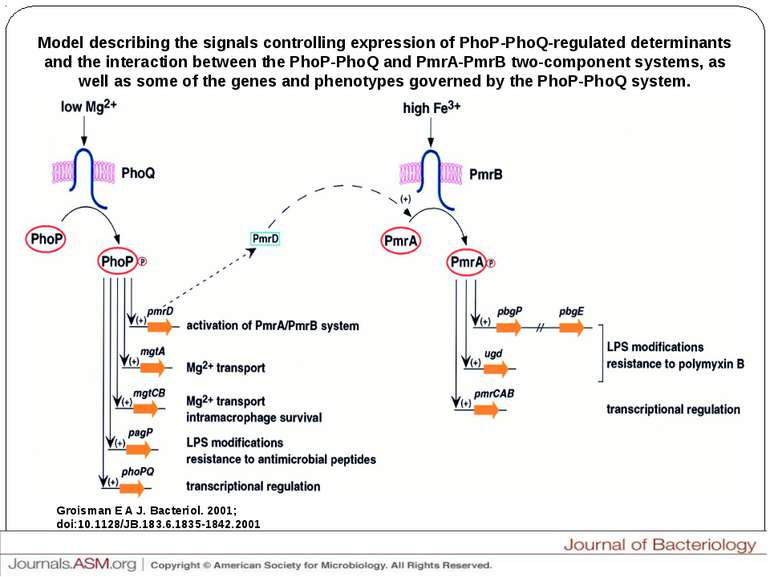
Model describing the signals controlling expression of PhoP-PhoQ-regulated determinants and the interaction between the PhoP-PhoQ and PmrA-PmrB two-component systems, as well as some of the genes and phenotypes governed by the PhoP-PhoQ system. Groisman E A J. Bacteriol. 2001; doi:10.1128/JB.183.6.1835-1842.2001 Model describing the signals controlling expression of PhoP-PhoQ-regulated determinants and the interaction between the PhoP-PhoQ and PmrA-PmrB two-component systems, as well as some of the genes and phenotypes governed by the PhoP-PhoQ system.
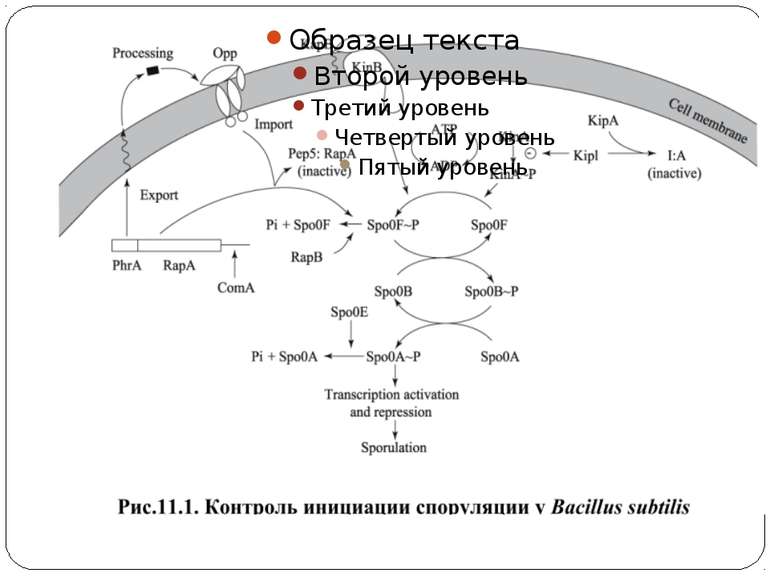
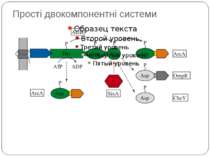
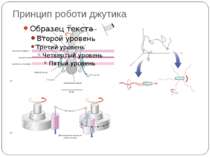
Фосфотрансляційні системи His-Asp-His-Asp 1. Автофосфорилювання ГК: ГК-His1 + АТФ ↔ ГК-His1 ~Ф + АДФ 2. 1-й переніс фосфату: ГК-His1 ~Ф + РО1 -Asp ↔ ГК-His1 + РО-Asp1 ~Ф 3. 2-й переніс фосфату: РО-Asp1 ~Ф + HPt-His2 ↔ РО-Asp1 + HPt-His2 ~Ф 4. 3-й переніс фосфату: HPt-His2 ~Ф + РО-Asp2 ↔ HPt-His2 + РО-Asp2 ~Ф 5. Дефосфорилювання: РО-Asp2 ~Ф + H2O ↔ РО-Asp2 + PI Н.: Система контролю споруляції B. subtilis
Регуляторні механізми Регуляція активності ГК Регуляція автокіназної і РО-фосфатазної активності Регуляція дефосфорилювання РВ Система споруляции бацилл имеет набор строго регулируемых фосфатаз (RapA, RapB, RapE), которые дефосфорилируют Spo0F, и еще одну фосфатазу, которая дефосфорилирует Spo0A. В системе хемотаксиса вспомогательный белок CheZ олигомеризуется с фосфо-CheY и стимулирует его дефосфорилирование. Інші способи регуляції
Інші способи регуляції может регулироваться сам перенос фосфата. Так, у гибридной киназы VirA из A. Tumefaciens карбоксиконцевой Asp-содержащий домен влияет на автокиназную активность киназного ядра путем физического взаимодействия с сайтом автофосфорилирования. Дополнительная возможность регуляции создается в тех случаях, когда ГК фосфорилирует более одного РО. В этих случаях конкуренция за фосфат может влиять на активацию различных ветвей сигнального пути. Наконец, еще один способ регуляции РО – контроль экспрессии его гена. Многие из двухкомпонентных систем, регулирующих транскрипцию, подвержены авторегуляции. В таких системах фосфо-РО действует как активатор или репрессор оперона, кодирующего ГК и РО
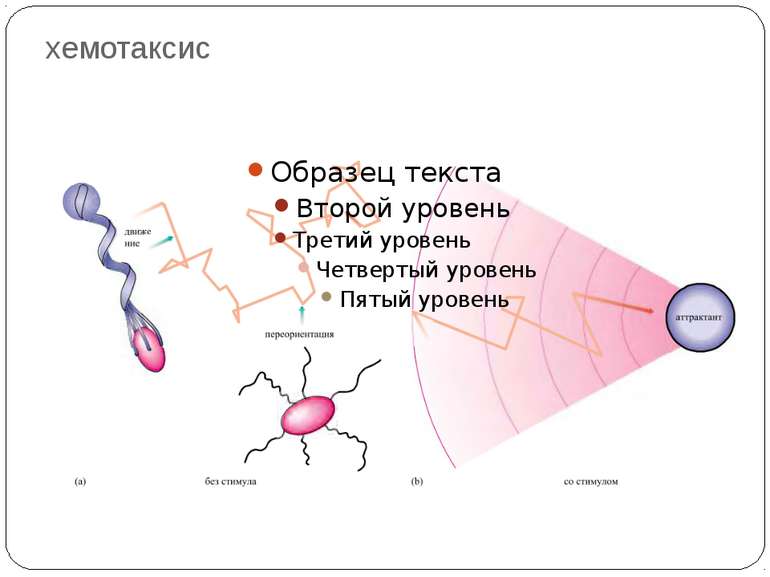
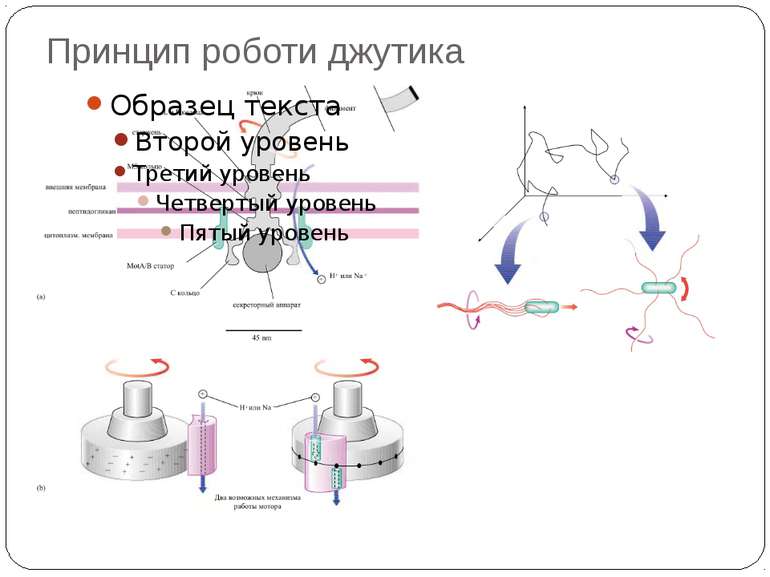
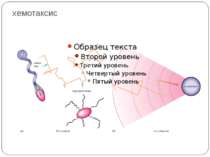
Хемотаксис ♦ CheA - ГК ♦ CheY - РО ♦ CheW - "адаптор" між рецептором і CheA ♦ CheZ - білок, що сприяє дефосфорилюванню CheY~Ф При відсутності аттрактанта концентрація Chey~ф підтримується на рівні, що сприяє обертанню джгутика переважно за годинниковою стрілкою й, отже, відсутності впорядкованого руху бактерії. Зв'язування аттрактанта з рецептором індукує конформаційну зміну, яка передається через мембрану і пригнічує автокіназну активність Chea. Концентрація Chey~ф падає, і джгутики бактерії більш тривалий час обертаються проти годинникової стрілки. Тому клітини будуть довше рухатися прямолінійно, якщо вони попадають у середовище з більш високою концентрацією аттрактанта.
Схожі презентації
Категорії