Презентація на тему:
membrana_sensor
Завантажити презентацію
membrana_sensor
Завантажити презентаціюПрезентація по слайдам:
Мембрана – рухома система Типи рухів: дифузія в горизонтальному моношарі ліпідів, обертання молекул, обертання ланцюгів довгих ЖК з різним ступенем ненасиченості
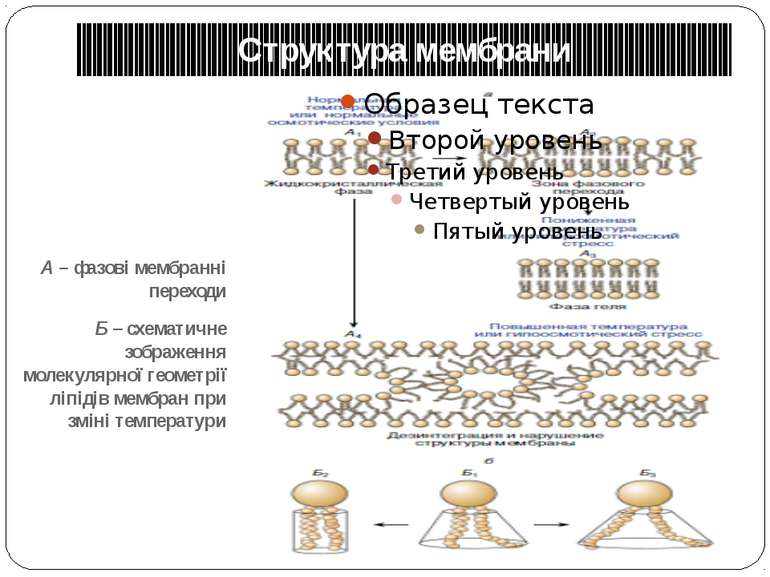
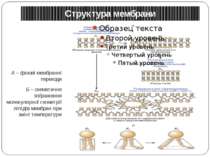
Структура мембрани А – фазові мембранні переходи Б – схематичне зображення молекулярної геометрії ліпідів мембран при зміні температури
NB !!! Фазовий перехід мембрани – смерть клітини!!! Причини: Зменшення рухомості білків в ліпідному бішарі; їх нездатність до зміни конформації; як наслідок – повна втрата своїх функцій (переніс електронів і речовин, синтез АТФ, транспорт іонів).
Зміна структури мембрани – сенсорний сигнал Осмотичний стрес Низькотемпературний стрес Високотемпературний стрес
Осмотичний стрес різка зміна концентрацій розчинених речовин в навколишьому оточенні і цитоплазмі. При підвищенні осмотичного тиску зовнішього розчину клітини втрачають воду і зменшуються в об’ємі. При зниженні - накачують воду всередину і збільшуються в об’ємі. В обох випадках клітини активують мембранні білки-переносники, а також генні блоки, які відповідають за адаптацію і в нормі, як правило, замовчувані.
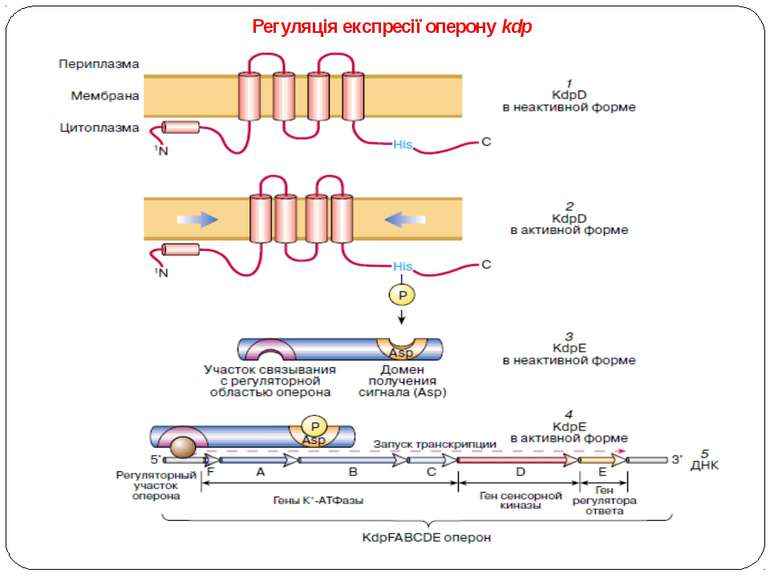
гістидин-кіназа KdpD оперон, що називається kdpFABCDE, кодує: систему переносу іонів калію, які самі по собі або у взаємодії із глутаміновою кислотою беруть участь у регуляції об'єму й іонного балансу в цитоплазмі клітин при гіперосмотичному стресі. Чотири гени цього оперона кодують АТФазу, що транспортує іони К+ Крім того, до складу оперону входять два гени, що виконують регуляторні функції. Молекулярні механізми, що приводять до автофосфорилювання сенсорної кінази kdpD, залишаються неясними, однак передбачається, що вона сприймає або зміну в напруженні мембрани, пов'язану з осмотичним стресом, або зміну іонної сили в цитоплазмі
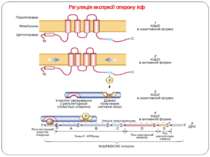
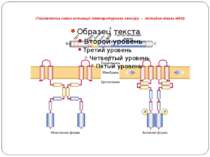
Регуляція експресії оперону kdp – сенсорная гистидин-киназа KdpD четырьмя трансмембранными доменами пронизывает цитоплазматическую мембрану клетки, находясь в неактивной форме (1). При гиперосмотическом стрессе мембрана сжимается,трансмембранные домены киназы сближаются, что приводит к изменению конформации KdpD и автофосфорилированию гистидинового остатка. Таким образом, KdpD переходит в активную форму (2). Далее фосфатная группа переносится с KdpD на остаток аспартата, находящегося в домене получения сигнала растворимого белка – регулятора KdpE. Этот белок также имеет участок связывания с регуляторной областью оперона kdp , но в нефосфорилированном виде не связывается с ДНК (3). После фосфорилирования KdpE переходит в активную форму (4) и связывается с регуляторным участком (промотором) оперона kdp , активируя его транскрипцию. Гены, входящие в оперон kdpFABCDE, отвечают за следующие функции: KdpFABC кодирует К+-АТФазу, в которой KdpF является низкомолекулярной субъединицей, предположительно стабилизирующей К+-АТФазу. KdpA – трансмембранная К+-связывающая и транспортирующая субъединица. KdpB – трансмембранный гомолог АТФазы Р-типа. KdpC – субъединица, собирающая весь комплекс. KdpD-мембраносвязанная сенсорная гистидин-киназа. KdpE – регулятор ответа оперона. 5– схематическое изображение оперона kdpFABCDE и включение его транскрипции с помощью активированного белка KdpE
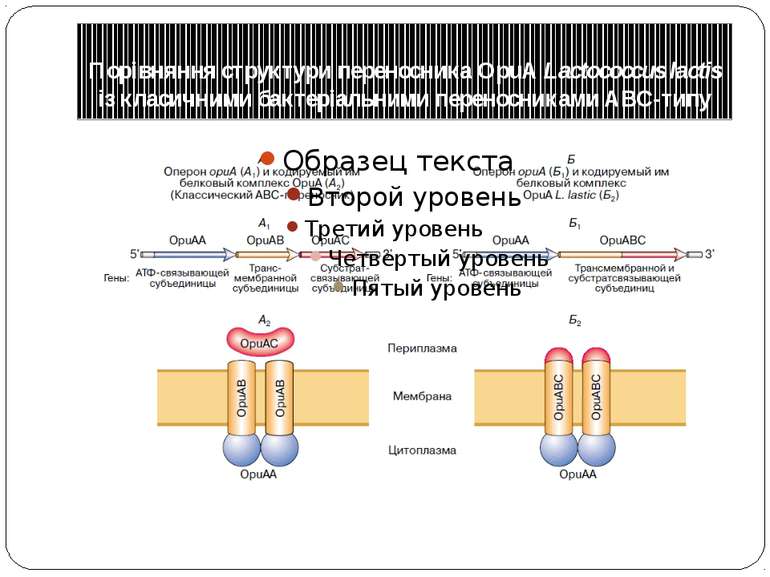
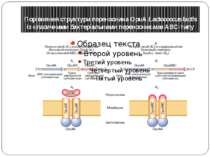
Осморегуляція АВС-переносника гліцин-бетаїну OpuA в бактерії Lactococcus lactis Гліцин-Бетаїн є так званим осмопротектором – речовиною, що накопичуються в цитоплазмі клітин, що й дозволяє регулювати їхній об'єм і тургорний тиск при гіперосмотичному стресі, коли в навколишньому середовищі підвищується концентрація осмотично активних речовин OpuА являє собою основну систему клітин, відповідальну за транспорт гліцин-бетаїну усередину клітин і, таким чином, що захищає їх від гіперосмотичного стресу активація OpuА відбувається в результаті зміни фізичного стану (текучості) мембран
Порівняння структури переносника OpuА Lactococcus lactis із класичними бактеріальними переносниками ABC-типу А1,Б1– последовательность генов в оперонах, кодирующих АВС-переносчики; А2,Б2– белковые комплексы АВС в мембране, обеспечивающие перенос субстрата через мембрану; A2– классический ABC-переносчик: субъединица OpuAC связывает субстрат (глицин-бетаин) и направляет его к домену переносчика, состоя- щему из двух идентичных или гомологичных субъединиц OpuAB и двух АТФ-связывающих субъединиц OpuAA. Гидролиз АТФ обеспечивает однонаправленный транспорт субстрата через мембрану; Б2– OpuA переносчик L. lactis: трансмембранный домен OpuABC представляет собой гибридный полипептид, состоящий из субстратсвязывающей и переносящей субъединиц (в остальном переносчик организован по тому же типу, чтоА2)
Інші типи осморегуляторів У клітинах E. coli передбачуваним осмосенсором є трансмембранна гістидин-кіназа EnvZ. Цей білок регулює експресію генів omp, що кодують порини зовнішньої мембрани
НИЗЬКОТЕМПЕРАТУРНИЙ СТРЕС гени десатураз жирних кислот, відповідальні за регуляцію текучості гени РНК-зв’язуючих білків (Rbp), які є шаперонами РНК, подібно білкам холодового шоку (Csp) E. coli і Bacillus subtilis; гени РНК-хеліказ, що беруть участь у дестабілізації вторинних структур мРНК і в такий спосіб полегшують ініціацію трансляції при низьких температурах; гени рибосомних білків, надлишок яких необхідний для акліматизації трансляційного апарата до холоду; гени протеаз, що беруть участь у регенерації фотосистеми II; інші гени різних функцій, що не попадають у жодну з перерахованих вище категорій
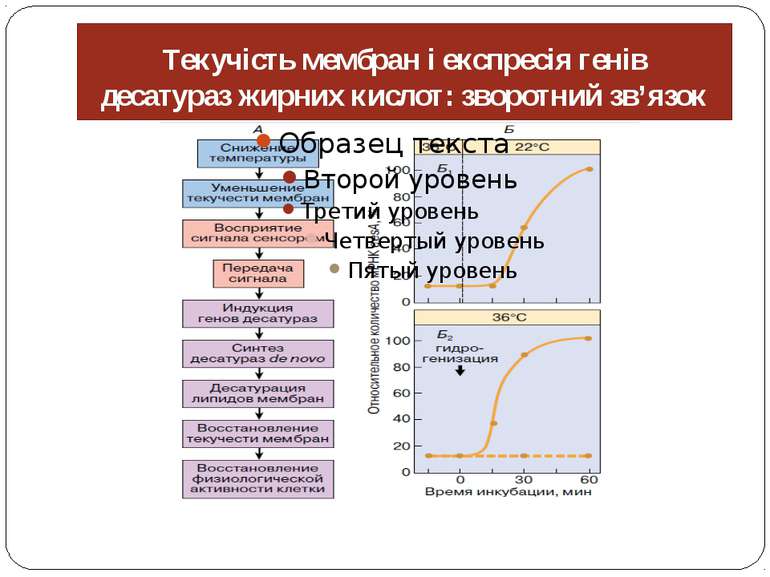
≪гомеовіскозна адаптація≫ зворотний зв'язок між текучістю мембран і компенсаторною експресією генів десатураз
індукція генів десатураз залежить не від абсолютної температури, а від різниці температур преадаптації й індукції Сенсор низьких температур, гістидин-кіназа Hik33, був ідентифікований у клітинах Synechocystis як регулятор низькотемпературної індукції експресії гена desb, що кодує ω 3-десатуразу жирних кислот. Наступний аналіз експресії генома показав, що Hik33 регулює експресію принаймні половини з 50 генів, що індукуються холодом
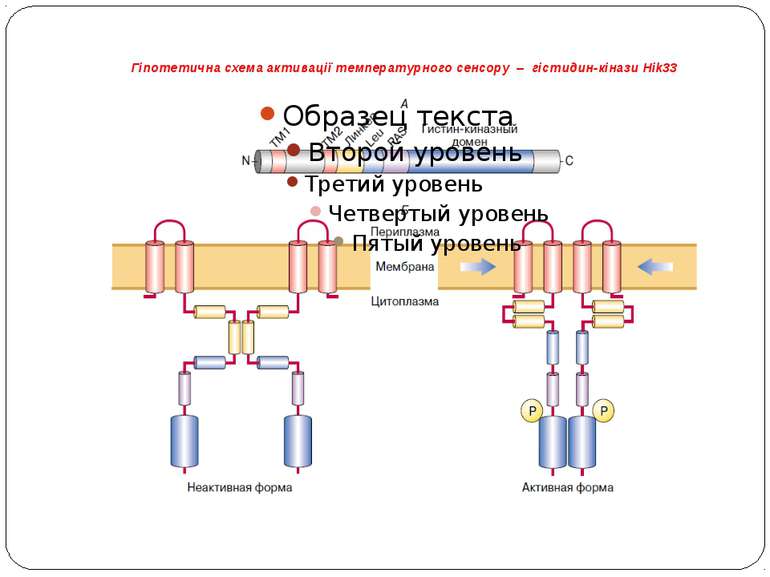
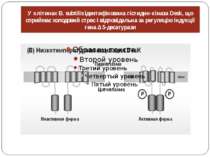
Гіпотетична схема активації температурного сенсору – гістидин-кінази Hik33 А – схематическое изображение доменов Hik33. ТМ1 и ТМ2 – трансмембранные домены, специфическая линкерная последовательность, Leu – “лейциновая молния”, PAS-домен, гистидин-киназный домен; Б – возможный механизм активации Hik33. При нормальной температуре димер Hik33 находится в неактивной форме. При снижении температуры текучесть мембран уменьшается и за счет сближения молекул липидов происходит сближение трансмембранных доменов Hik33 (показано стрелками). Это приводит к конформационным изменениям на участке белка, соответствующего линкеру. В результате происходит автофосфорилирование сенсорного белка. Далее фосфатная группа передается на белок – регулятор ответа, которым, возможно, является Rer1
Структура системи терморегуляції Вважається, що система сприйняття сигналу про зниження температури є або бікомпонентною (Hik33 і Rer1), або трикомпонентною (Hik33, Hik19 і Rer1).
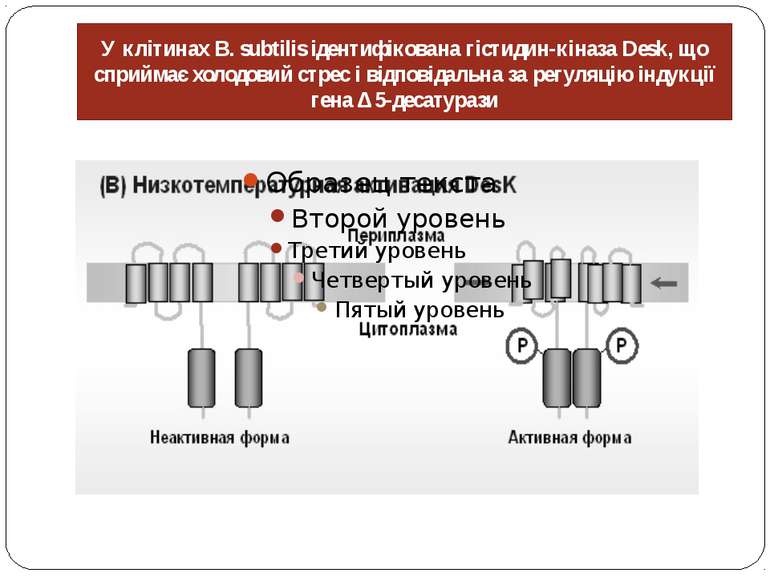
У клітинах B. subtilis ідентифікована гістидин-кіназа Desk, що сприймає холодовий стрес і відповідальна за регуляцію індукції гена Δ 5-десатурази Каждый мономер DesK имеет четыре трансмембранных домена и гистидин-киназный домен. В отличие от Hik33, DesK не несет PAS-домена и лейциновой молнии. Ген desK формирует оперон с геном desR, который кодирует регулятор ответа, специфически связывающийся с промоторной областью гена десатуразы. Индукция экспрессии гена десатуразы через двухкомпонентную систему регуляции DesK-DesR ингибируется добавлением экзогенных ненасыщенных жирных кислот [28, 53], что свидетельствует о наличии обратной связи между сенсором и степенью ненасыщенности мембранных липидов.
Високотемпературний стрес Сенсор? обробка кліток бензиловим спиртом (і, очевидно, іншими хімічними агентами, що збільшують текучість мембран) не відтворює адекватну картину теплового стресу. А отже, проблема сприйняття високих температур через зміну текучості мембран поки ще має ряд протиріч, що вимагають додаткових досліджень
Дослідження стресової відповіді гена hspa, що кодує низькомолекулярний білок теплового шоку HspА в Synechocystis Даний білок індукується при підвищенні температури й зв'язується з ліпідами мембран, запобігаючи в такий спосіб їх дезінтеграцію. Експресія гена hspА активувалася як тепловим впливом, так і пом’якшувачами мембран бензиловим спиртом при нормальній температурі Високотемпературний стрес
У клітинах E. coli тепловий сигнал передається частково через двокомпонентну систему CpxА-CpxR CpxА є гістидинкіназою із двома трансмембранними ділянками, а CpxR являє собою регулятор відповіді генів, що індукуються теплом. Активність CpxA залежить від складу ліпідів мембран, а отже, цей сенсор може вловлювати зміни текучості. Ця регуляторна система була виявлена тільки в клітинах E. coli, Salmonella typhi і Yersinia pestis
Інші типи теплорегуляторів В Myxococcus xanthus у якості системи сприйняття й передачі теплового стресу ідентифіковані гістидин-кіназа HsfA і регулятор відповіді. У цьому випадку HsfA виявилася розчинним білком з доменом одержання фосфату, а виходить, швидше за все цей білок є передавачем сигналу, а не сенсором
Схожі презентації
Категорії