Презентація на тему:
будова органів дихання
Завантажити презентацію
будова органів дихання
Завантажити презентаціюПрезентація по слайдам:
Проблема Що відбувається з хімічними речовинами під час хімічних реакцій? Чи змінюються маси речовин у хімічних реакціях?
Тема уроку : «Закон збереження маси речовини.» Епіграф «Доводи, до яких людина додумалась сама, зазвичай переконують її більше, ніж ті, які прийшли в голову іншим»
Цілепокладання: 1.Історія відкриття закону збереження маси речовин. 2.Закон збереження маси речовин. 3.Суть хімічної реакції на підставі закону. Хімічні рівняння. Правила складання хімічних рівнянь. 4.Яке значення закону збереження маси?
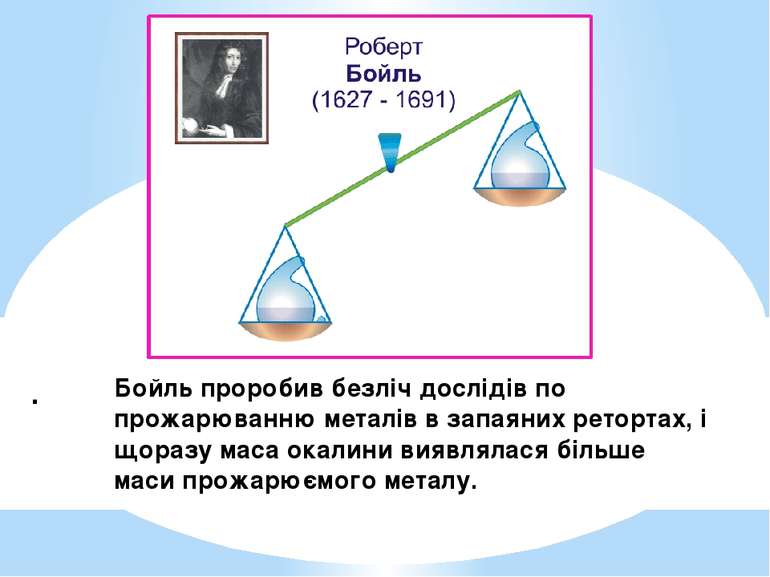
Відкриття закону збереження маси речовини 1789г. Роберт Бойль 1673г. 1748г. М. В. Ломоносов Антуан Лавуазье
. Бойль проробив безліч дослідів по прожарюванню металів в запаяних ретортах, і щоразу маса окалини виявлялася більше маси прожарюємого металу.
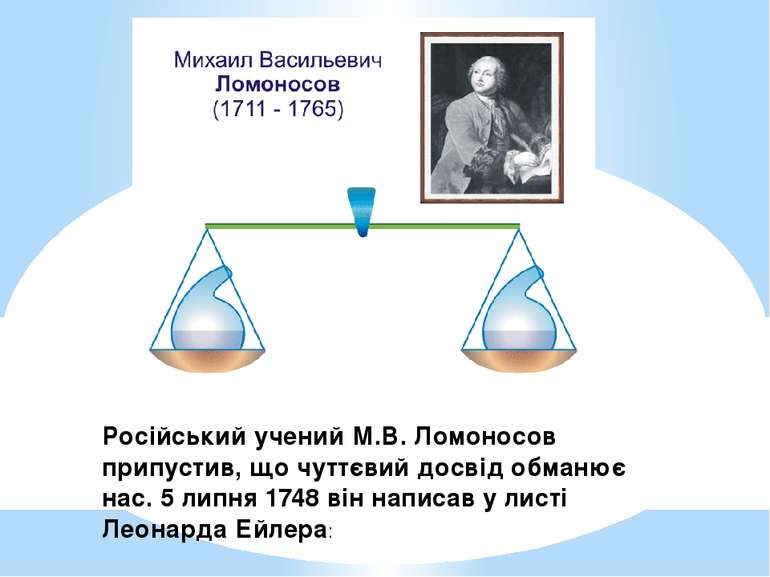
Російський учений М.В. Ломоносов припустив, що чуттєвий досвід обманює нас. 5 липня 1748 він написав у листі Леонарда Ейлера:
Михайло Васильович Ломоносов (1711-1765) Усі зміни в натурі, які трапляються такого суть стану, що скільки в одного тіла забирається, стільки додається до іншого; так, коли де убуде трохи матерії, то збільшиться в іншому місці... (1748р.)
«Маса речовин, що вступили в реакцію, дорівнює масі речовин,що утворилися в результаті реакції» - сучасне формулювання закону збереження маси речовин. Закон збереження маси речовини (1789 р.)
Маса ніколи не створюється й не знищується, а тільки переходить від однієї речовини до іншої. Антуан Лоран Лавуазьє (1743-1794)
Дайте, будь ласка, відповідь: Чи можна експериментально перевірити цей закон? Яку ознаку хімічної реакції ми спостерігаємо?( у даному досліді)
Символи хімічних елементів — це літери хімічної мови Формули сполук — це слова Рівняння реакцій — ? Проблемне питання.
Як ви вважаєте? Чи є закон збереження маси речовин основою для складання рівнянь хімічних реакцій?
Al + O2 → Al O Al + O2 → Al+3 O-2 Al + O2 → Al2O3 Al + 3O2 → 2Al2O3 4Al + 3O2 → 2Al2O3 4Al + 3O2 → 2Al2O3
Fe(OH)3→ Fe2O3 + H2O 2Fe(OH)3 → Fe2O3 + H2O 2Fe(OH)3 → Fe2O3 + 3H2O 2Fe(OH)3 = Fe2O3 +3 H2O
Підрахувати кількість атомів кожного елементу в правій і лівій частині рівняння хімічної реакції. Визначити, у якого елементу кількість атомів змінюється, знайти НСК. Розділити НСК на індекси - отримати коефіцієнти. Поставити їх перед формулами. Перерахувати кількість атомів, при необхідності дію повторити. Останнім перевірити кількість атомів кисню Алгоритмом розстановки коефіцієнтів у рівняннях хімічних реакцій?
Тож дайте відповідь на проблемне питання: Чи є закон збереження маси речовин основою для складання рівнянь хімічних реакцій?
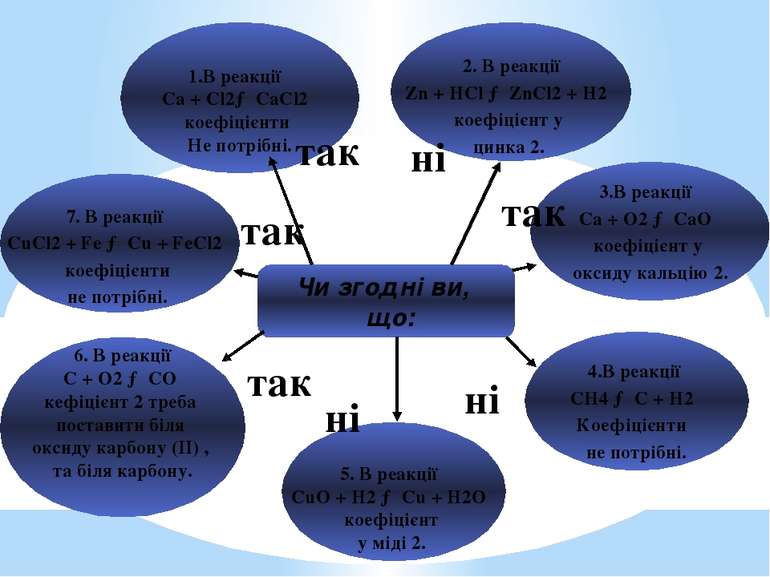
Чи згодні ви, що: 1.В реакції Ca + Cl2→ CaCl2 коефіцієнти Не потрібні. 2. В реакції Zn + HCl → ZnCl2 + H2 коефіцієнт у цинка 2. 3.В реакції Ca + O2 → CaO коефіцієнт у оксиду кальцію 2. 4.В реакції CH4 → C + H2 Коефіцієнти не потрібні. 5. В реакції CuO + H2 → Cu + H2O коефіцієнт у міді 2. 6. В реакції C + O2 → CO кефіцієнт 2 треба поставити біля оксиду карбону (II) , та біля карбону. 7. В реакції CuCl2 + Fe → Cu + FeCl2 коефіцієнти не потрібні. так ні ні ні так так так
Розставляючи коефіцієнти, слід пам'ятати такі правила: 1. коефіцієнт показує число молекул або окремих атомів у рівнян¬ні реакції; 2. коефіцієнт ставиться тільки перед хімічною формулою; 3. коефіцієнт стосується всіх атомів, із яких складається молеку¬ла, перед якою він стоїть: 4. індекс показує число атомів елемента (або груп атомів) у складі молекули; 5. коефіцієнт 1, як і індекс 1, не записується. Пам’ятка №1
У написаннi хімічних рівнянь не можна: а) ставити коефiцiєнти в середину формули: Н2 + О2 = Н22О; б) мiняти iндекси у формулi : Н2 + О2 = Н2О2; в) ставити коефiцiєнти в декiлька раз бiльше: 4Н2 + 2О2 = 4Н2О. Пам’ятка №2
Розставте коефіцієнти в схемах хімічних рівнянь 1) Fe + Cl2 → FеСІ2 2) Na + Сl2 →NaСl 3) Аg + S →Аg2 S 4) Аl + О2→Аl2О3 5) НgО → Нg + О2 6) Na + О2→ Nа2О
Значення закону Використовуючи закон збереження маси речовин, можна : написати рівняння хімічних реакцій; розв’язати хімічні задачі, навіть виробничого характеру.
Підбиття підсумків уроку. Закінчити речення: На уроці я : дізнався… зрозумів... навчився… Найбільше труднощів я відчув… Не вмів, а тепер умію… На наступному уроці я хочу...
Рефлексія: Продовжіть ланцюжок: Я знаю ….. Я вмію ….. Я використовую …… Мені це буде необхідно для ….. Я навчився …… Я набув вміння …….
Таблиця настрою . Мені було на уроці комфортно, я отримав відповідь на всі цікаві для мене питання На уроці я досяг цілі наполовину. Мені на уроці було не цікаво, я нічого не взнав нового. F F F
Схожі презентації
Категорії