Презентація на тему:
Апоптоз_Некроз
Завантажити презентацію
Апоптоз_Некроз
Завантажити презентаціюПрезентація по слайдам:
Механізми апоптозу Морфологічні особливості: А) відділення клітин від позаклітинного матриксу; Б) конденсація ядра; В) зморщення цитоплазматичної мембрани; Г) утворення апоптозних тілець; На молекулярному рівні: А) розриви ниток ДНК між нуклеосомами Б) концентрування фосфатидилсерину на зовнішній стороні плазматичної мембрани (макрофаги виділяють специфічний глікопротеїн MFG-E8-milk fat globule-EGF-factor 8, який мітить ФС),
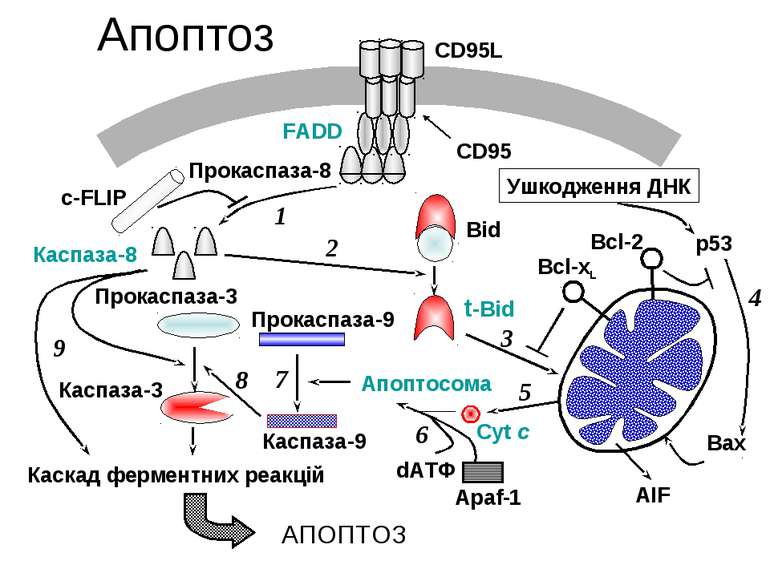
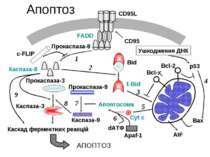
В біохімічному механізмі апоптозу виділяють чотири основні компоненти: 1.Cys-Asp протеази (КАСПАЗИ) Рецептори “смерті” на поверхні клітин (Fas чи TNF (tumor necrosis factor) 3.Активація мітохондрій та вихід цитохрому С 4.Про- та антиапоптозні білки КАСПАЗИ В цілому у ссавців розрізняють 14 членів родини каспаз Задіяні в апоптозі наступні: -ініціаторні (8, 2, 10, 9) -еффекторні каспази (3, 7, 6). Існують в клітинах у вигляді прокаспаз з м.м. 32–56 кДа містять 4 домени: N-кінцевий домен містить велику (17–21 кДа) та малу (10–13 кДа) субодиниці та короткий зв’язуючий домен між ними При активації N-кінцевий та зв’язуючий домен між субодиницями відщеплюються, в результаті чого формується гетеродимер Активна каспаза – це тетрамер, який складається із двох гетеродимерів Каскад каспаз починається із автокаталітичної активації ініціаторної каспази, яка в свою чергу активує ефекторні каспази, які розщеплюють актинові філаменти. Інгібірують біосинтез білків та активують ДНКазу Ряд каспаз в апоптозі не приймають участі (розвиток запалення, проліферація лімфоцитів та термінальне диференціювання
Позаклітинні сигнальні комплекси смерті А)FAS Б)TNF (tumor necrosis factor) Комплекс (А, Б) з TNF-receptors, адаптерні білки TRADD (TNFR1-associated protein with death domain) або FADD (Fas-associated protein with death domain) та профермент каспази-8. Активована каспаза 8 вивільняється в цитоплазму і там ініціює протеазний каскад, в результаті чого активуються ефекторні каспази, зокрема каспаза 3, яка знаходиться на пересіченні рецепторного та мітохондріального шляху активації каспаз
Мітохондрії Екзогенні та ендогенні проапоптичні сигнали сходяться на мітохондріях: Підвищується проникність мембран Знижується мембранний потенціал Вивільнюються проапоптичні білки: -Фактор індукції апоптозу (AIF), -SMAC (second mitochondria-derived activator of caspases) -Деякі прокаспази із міжмебранного простору мітохондрій
Вивільнення цих білків відбувається внаслідок відкриття високопроникного каналу –мітохондріальної пори, яка складається із 30 кДа транслокатора аденінових нуклеотидів, 32 кДа-потенціалзалежного аніонового каналу (порину) та18 кДа- бензодиазепінового рецептору зовнішньої мембрани мітохондрій. З мітохондріальною порою асоційовані інші білки - члени родини Bcl-2, циклофілін Д та ферменти енергетичного метаболізму – гексокіназа та креатинкіназа. При зв’язуванні іонів Са2+ цей комплекс утворює мембранну пору діаметром 2,6–2,9 нм, здатною пропускать низькомолекулярні речовини з м.м. 1500, що приводить до швидкого вивільнення Са2+, зниження ΔΨm та високоамплітудного набухання мітохондрій. Відкриття пори стимулюють: неорганічний фосфат, прооксиданти, SH-реагенти зниження мітохондріального пулу АТР. Закриття пори індукують: Mg2+, аденінові нуклеотиди, антиоксиданти, спермін, циклоспорін А.
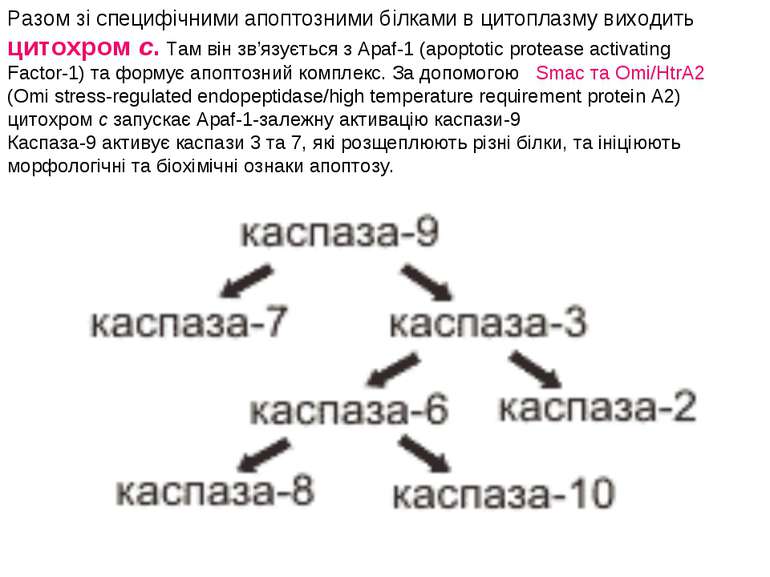
Разом зі специфічними апоптозними білками в цитоплазму виходить цитохром c. Там він зв’язується з Apaf-1 (apoptotic protease activating Factor-1) та формує апоптозний комплекс. За допомогою Smac та Omi/HtrA2 (Omi stress-regulated endopeptidase/high temperature requirement protein A2) цитохром с запускає Apaf-1-залежну активацію каспази-9 Каспаза-9 активує каспази 3 та 7, які розщеплюють різні білки, та ініціюють морфологічні та біохімічні ознаки апоптозу.
Цитохром с зв’язаний з внутрішньою мембраною мітохондрій негативно заряженими фосфоліпідами (кардіоліпін). Цей зв’язок обумовлений електростатичними взаємодіями між позитивно заряженими залишками лізину в цитохромі с та негативно заряженими фосфатними групами в кардіоліпіні; з іншого боку – гідрофобною взаємодією між вуглеводним залишком кардіоліпіну та гідрофобними участками молекули цитохрому с, що обумовлює її часткове погруження в мембрану. Тобто, для виходу цитохрому с лише порушення цілісності мембрани недостатньо. Електростатично зв’язаний цитохром с мобілізується при змінах іонної сили щільності поверхневого заряду або рН, а гідрофобно зв’язаний – при окислювальній модифікації мітохондріальних ліпідів. Однак цитохром с не завжди є необхідною ланкою апоптозу (в кардіоміоцитах він не виходить з міжмембранного простору; каспаза-12 може активувати каспазу-9 без його участі). На ізольованих мітохондріях гепатоцитів показано, що вихід цитохрома с може бути Са2+-залежним и та Са2+-незалежним. В першому випадку, підвищення внутрімітохондріальної концентрації Са2+ викликає відкривання пори, що приводить до вивільнення цитохрому с. Са2+-незалежний вихід цитохрома с контролюється білками родини Bcl-2
Родина білків BCL 2, р53, катепсин В Антиапоптичні - Bcl2, BclxL, Bclw, Mcl1, A1, Boo Проапоптичні Bax, Bad, Bok, BclxS, Bak, Bid(p22), Bik Р53 – запускає апоптоз, викликаний ушкодженнями ДНК (активує PUMA p53 upregulated modulator of apoptosis) Катепсін В активується каспазою 8 та стимулює вихід цитохрому с із мітохондрій Кальпоніни – специфічно розщеплюють білки, які містять Asp- Ser- Tre –багаті участки PAST-мотиви Активні форми кисню – можуть продукуватись при апоптозі, як на початку, так і в кінці регуляторної ланки апоптозу NO- блокує апоптоз опосередковано нітрозилюванням ефекторних каспаз
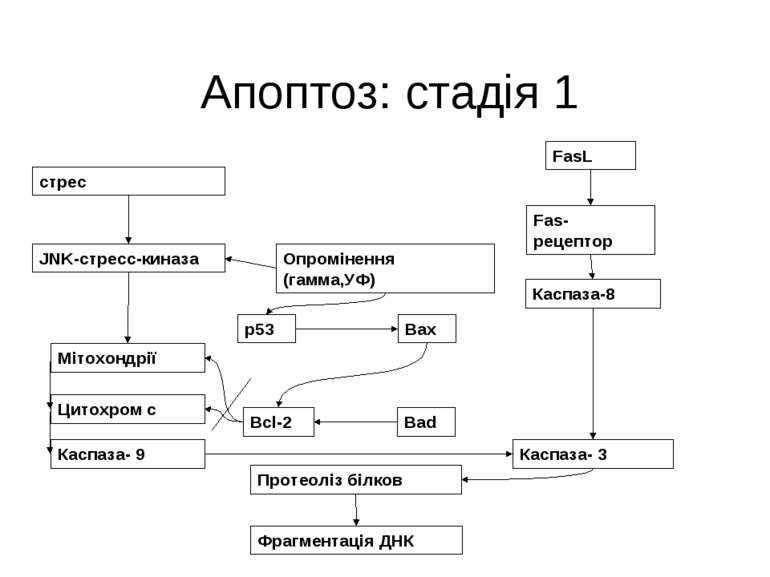
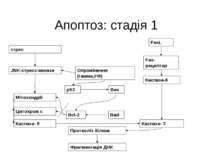
Апоптоз: стадія 1 стрес FasL Fas-рецептор Каспаза-8 JNK-стресс-киназа Опромінення (гамма,УФ) Мітохондрії p53 Цитохром с Каспаза- 9 Каспаза- 3 Bcl-2 Bad Bax Протеоліз білков Фрагментація ДНК
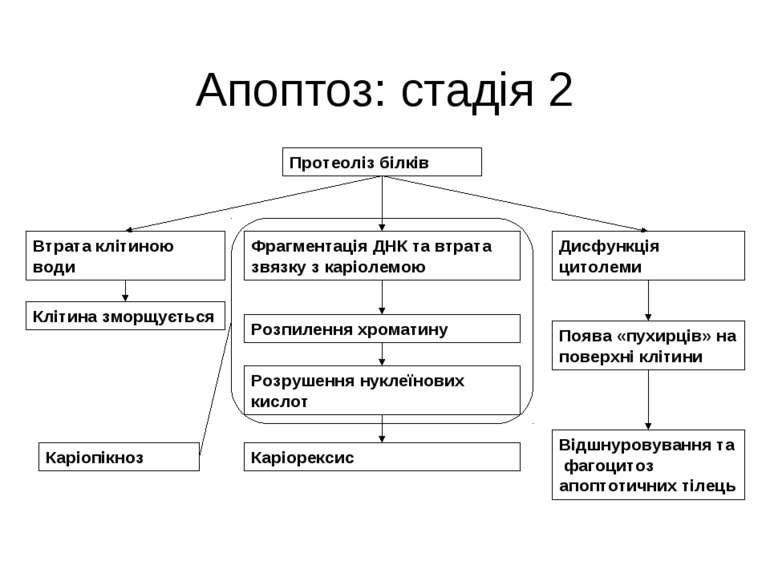
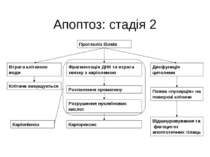
Апоптоз: стадія 2 Протеоліз білків Втрата клітиною води Фрагментація ДНК та втрата звязку з каріолемою Дисфункція цитолеми Розпилення хроматину Каріорексис Розрушення нуклеїнових кислот Каріопікноз Клітина зморщується Поява «пухирців» на поверхні клітини Відшнуровування та фагоцитоз апоптотичних тілець
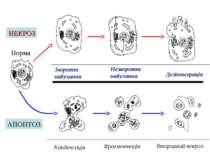
НЕКРОЗ –змертвіння, відмирання частини тканини або органу живого організму, що супроводжується незворотнім припиненням їх життєдіяльності. Незворотні дистрофічні зміни, що передують некрозу називають некробіозом, а некробіоз, який перебігає протягом тривалого періоду, — патобіозом Причини виникнення поділяють на екзогенні та ендогенні: Екзогенні — механічна травма, вплив крайніх температур, електричного струму, іонізуючого випромінювання, кислот, лугів, солей важких металів, мікроорганізмів та ін. Ендогенні- порушення судинного, нейрогуморального, алергічного і метаболічного характеру За природою виникнення поділяють -фізичні (вогнепальне поранення, обмороження, опік, радіація) -токсичні (кислоти, луги, солі важких металів, ферменти, лікарські засоби, органічні розчинники) -біологічні (бактерії віруси) -алергічні (аутоімунні захворювання) - Судинні (інфаркт-судинний некроз) -трофоневротичні (пролежні, трофічні язви)
В залежності від механізму дії розрізняють: прямий некроз, обумовлений прямою дією ушкоджуючого фактору та непрямий, який опосередковується через судинну та ендокринну систему. Морфологічні ознаки некрозу проявляються через 1-3 години після дії ушкоджуючого чинника. Основний ефектор, що викликає некроз – це приток іонів кальцію в клітину. В нормальній клітині внутрішньоклітинна концентрація кальцію складає приблизно 0,001 частину від концентрації в позаклітинному середовищі. Накопичення кальцію внутрі клітини спостерігається лише у випадку незворотніх змін Основою змін, які розвиваються в осередку некрозу є пригнічення анаболічних і посилення катаболічних процесів. При цьому відзначають роз’єднання дихання й фосфорилювання, перерозподіл іонів, денатурацію й коагуляцію білків, зникнення глікогену, інактивацію ферментів і їх вихід із клітини Некротичне ядро зменшується в розмірі – хроматин конденсується в глибки, забарвлюється в темно-синій колір гематоксиліном та підлягає каріолізису Цитоплазма стає гомогенною та виражено ацидофільною і зафарбовується еозином в розовий колір. Спеціалізовані органели в клітинах зникають (міофібрили). Мітохондрії набухають Зміна міжклітинних структур –ушкодження еластичних волокон
Класифікації некрозу побудовані з урахуванням стадії процесу, особливостей його виникнення (первинний, вторинний), поширеності (осередковий, тотальний), клінічної картини та ін. клініко-анатомічні форми некрозу: коагуляційний (сухий), коліквативний (вологий), гангрена, інфаркт. Особливості коагуляційного: процеси денатурації білків з утворенням важкорозчинних сполук (нирки, селезінка). Коліквативний - розплавлювання мертвої тканини часто з утворенням кіст (в головному і спинному мозку при атеро склерозі). У тканинах, які контактують з навколишнім середовищем, розвивається гангрена. При цьому внаслідок перетворення кров’яних пігментів і утворення сірчистого заліза змертвілі ділянки стають сіро-бурими або чорними. Різновидом гангрени є пролежні — змертвілі поверхневі ділянки тіла, які піддаються тиску, напр. шкіра і м’які тканини в ділянці крижа або великого вертлюга стегнової кісти. Інфаркт — вогнище некротичного органу, що виникає внаслідок раптового порушення місцевого кровообігу. У сприятливих умовах (обмежене вогнище некрозу достатнє кровопостачання, клітинний тип регенерації та ін.) загибла тканина заміщується вихідною, тобто настає її повне відновлення. Найчастіше на місці некротичних мас унаслідок їх організації розростається фіброзна тканина й утворюється рубець. При неповному розсмоктуванні некротичних мас вони відмежовуються сполучною тканиною, відбувається інкапсуляція. Некротизована тканина може відокремлюватися і знаходитися в організмі у вигляді секвестру або відриватися внаслідок мутиляції.
Чому на сьогодні схиляються до думки про програмованість некрозу? ПСК ІІІ типу (НЕКРОЗ): Факти: -Некроз відбувається як апоптоз у випадку енергодефіциту -Індуктори некрозу білок PARP, індуктори мітохондріального окислювального стресу; протеаза- omi, а також задіяні деякі каспази. Якщо раніше основна відмінність апоптозу та некрозу була характер індукторів (фізіологічні – апоптоз зверхфізіологічні – некроз); то зараз вважається –наслідки апоптозу (акуратна елімінація макрофагами та непаренхіматозними клітинами); наслідки некрозу –альтерація та запалення навколишніх тканин
Вваєжається, що імунологічна толерантність при апоптозі (вірусні та онкологічні захворювання) –зумовлена апоптичним механізмом загибелі клітин (перегляд стратегій лікування). Наявність колективного апоптозу- (кластери апоптозу), клітини, що гинуть продукують пероксид водню (метаморфоз у комах).
Ознака Апоптоз Некроз Індукція Активується фізіологічними або патологічними стимулами Різна в залежності від ушкоджуючого фактору Поширеність Окрема клітина Група клітин Біохімічні зміни Енергозалежна фрагментація ДНК ендогенними нуклеазами; лізосоми інтактні Порушення або припинення іонного обміну; із лізосом вивільняються ферменти Цілісність клітинної мембрани Збережена Порушена Морфологія Зморщування клітин та фрагментація з утворенням апоптичних тілець з ущільненим хроматином Набухання та лізис клітин Запалення Відсутнє Присутнє Розпад ДНК Внутріядерна конденсація з розщепленням на фрагменти Дифузна локалізація в некротизованій клітині Видалення клітин Фагоцитоз сусідніми клітинами Фагоцитоз нейтрофілами та макрофагами
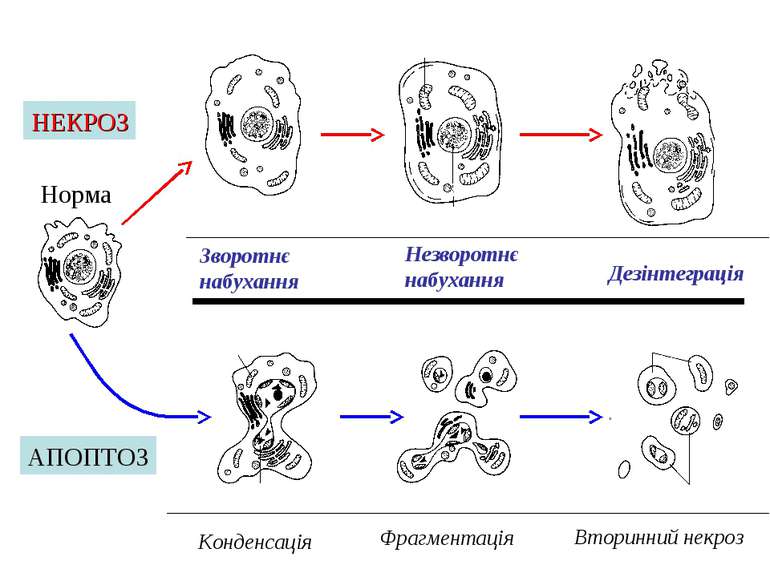
Зворотнє набухання Норма Збережена форма хроматину Мітохондрії змінені Розрив мембран Незворотнє набухання Дезінтеграція Конденсація Фрагментація Вторинний некроз збережена структура мітохондрій Інтактні мембрани Апоптичні тільця Ядро змінено АПОПТОЗ НЕКРОЗ
Аутофагія –альтернативний апоптозу варіант програмованої смерті клітин (ПСК –ІІ типу) Механізм оновлення органел (подібний фагоцитозу) включає: -мічення частини клітини, яка підлягає видаленню -оточення мембраною та утворення аутофагосом -злиття з лізосомами – утворення аутофаголізосом Аутофагія може бути індукована активними формами кисню, іонізуючою радіацією, протипухлинними препаратами, дефіцитом факторів росту, зниженням вмісту амінокислот та АТФ в цитозолі клітин Прозапальні цитокіни TNF-α IF-γ також викликають аутофагію Ядро не містить конденсованого хроматину та розривів ДНК як при апоптозі. Аутофагія може бути як самостійна танатогенна програма, а також як програма виживання клітин.
Молекулярний механізм аутофагії –гени родини ATG та AUT, які задіяні в формуванні аутофагосом: ATG система включає в себе білки Atg 5, 7, 10, 12 – Atg 7 та 10 є аналогами Е1 та Е2 убіквітинзалежного шляху деградації білків (регуляція клітинного циклу). Після стадії розпізнавання білку до даних білків приєднується комплекс Atg5-12, а потім на цьому комплексі йде мультимеризація Atg16. Такий комплекс необхідний для утворення аутофагосом. Наступна кон”югуюча система представлена білками Atg 3 та 4, які також виконують функцію Е1 та Е2, потім активується фермент Atg4 (autophagin-1)- каспаза. За рахунок злиття цих білків йде розширення аутофагосоми та її злиття з лізосомою Регуляція аутофагії – c-myc, mTOR, Atg1, PI-3K/PKB, Beclin1, PTEN, E2F. Ці білки впливають на різні етапи аутофагії Значення аутофагії: в процесах метаморфозу та ембріогенезу. Порушення механізмів регуляції аутофагії спостерігається при нейродегенеративних захворюваннях:хорея Гетінгтона, захворювання Альцгеймера та Паркінсона
Мітотична катастрофа- загибель клітин в результаті грубих порушень мітозу, відставання входження хромосом в мета- та анафазі, мультиполюсні та багатогрупові мета- та анафази Ключовою відмінністю мітотичної катастрофи від апоптозу є утворення одного та декількох мікроядер, в яких відсутня конденсація хроматину, відсутні розриви ДНК. За морфологічними ознаками мітотична катастрофа описується як некроз, хоча в деяких випадках описується як апоптоз через активацію каспази-2 (функціональний аналог каспази-8 за рахунок вивільнення із мітохондрій факторів, що формують апоптосому. Вперше мітотична катастрофа описана у дріждів, при виникненні мутації, викликаних зміною температури. Молекулярний механізм пов”язаний з порушеннями у 2 точці chekpoint обумовлені регуляцією cdk1, cdk2, p53, p21, або ж прямим інгібуванням формування мікротрубочок
Схожі презентації
Категорії