Презентація на тему:
ПОВЕРХНЕВІ ЯВИЩА. АДСОРБЦІЯ
Завантажити презентацію
ПОВЕРХНЕВІ ЯВИЩА. АДСОРБЦІЯ
Завантажити презентаціюПрезентація по слайдам:
Поверхневі явища Це процеси, які проходять на межі розділення фаз в гетерогенних системах. Властивості молекул в поверхневому шарі і в об’ємі системи істотно відрізняються між собою.
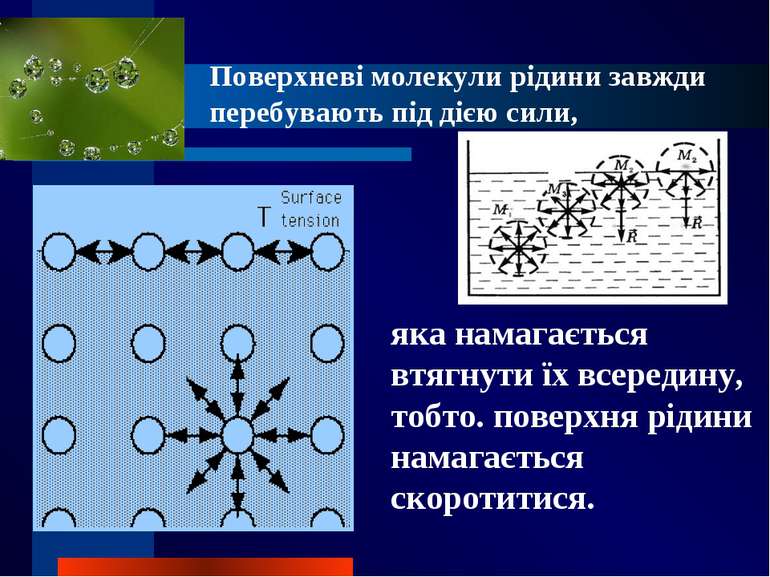
Поверхневі молекули рідини завжди перебувають під дією сили, яка намагається втягнути їх всередину, тобто. поверхня рідини намагається скоротитися.
Поверхнева енергія Gs Важливою характеристикою поверхневої фази є поверхнева енергія Gs – різниця середньої енергії частинки, яка знаходиться на поверхні, і частинки, що знаходиться в об’ємі фази G = σ S
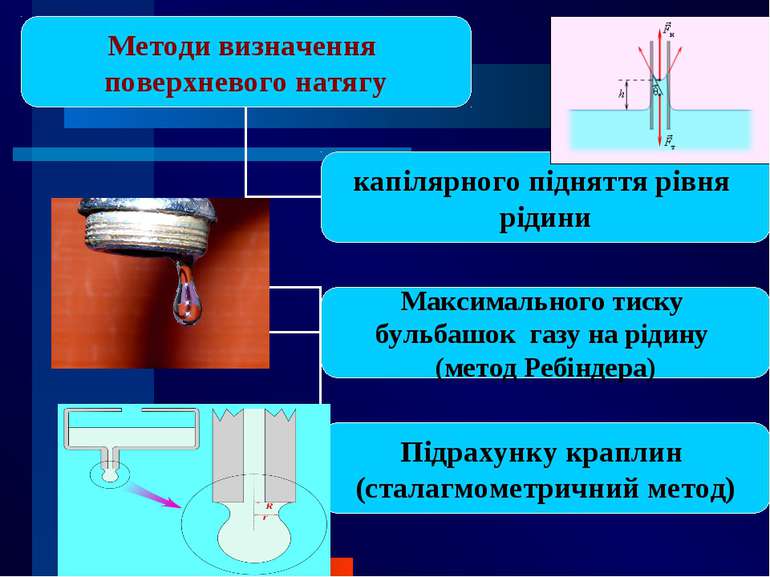
Поверхневий натяг σ Для характеристики поверхні поділу, що відділяє дану фазу від іншої, вводиться поверхневий натяг σ – відношення поверхневої енергії до площі поверхні поділу фаз
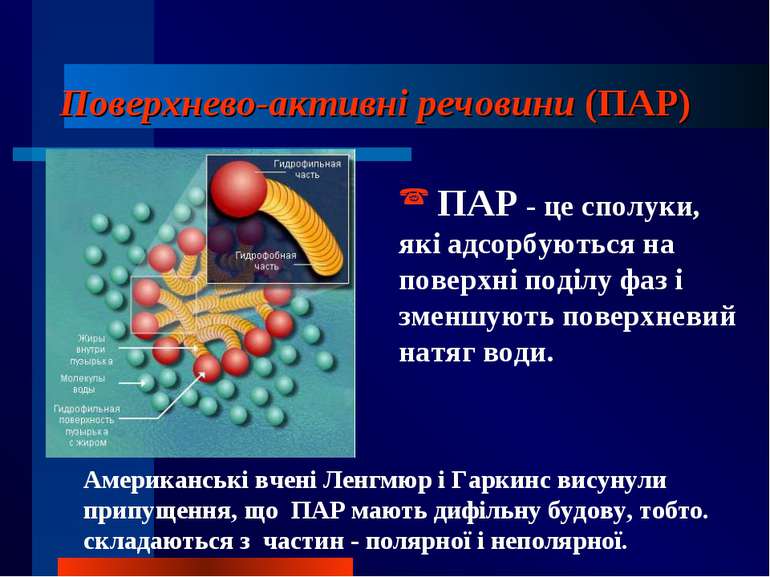
Поверхнево-активні речовини (ПАР) ПАР - це сполуки, які адсорбуються на поверхні поділу фаз і зменшують поверхневий натяг води. Американські вчені Ленгмюр і Гаркинс висунули припущення, що ПАР мають дифільну будову, тобто. складаються з частин - полярної і неполярної.
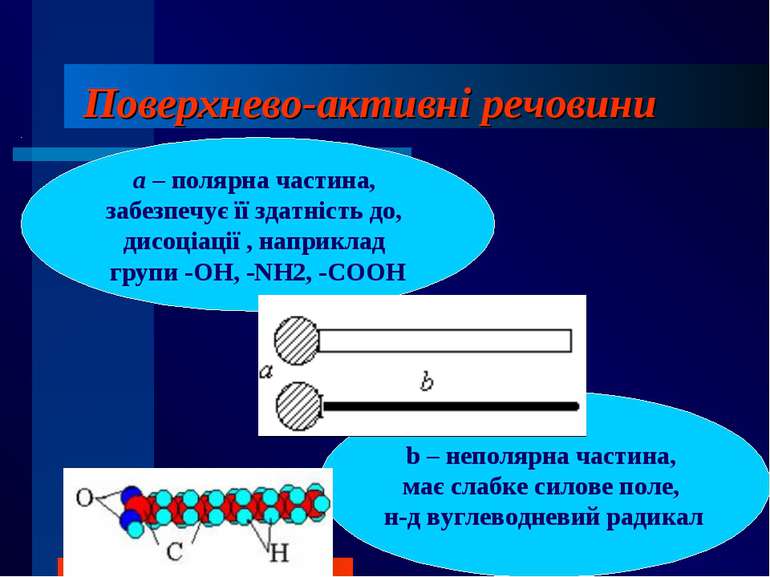
Поверхнево-активні речовини b – неполярна частина, має слабке силове поле, н-д вуглеводневий радикал а – полярна частина, забезпечує її здатність до, дисоціації , наприклад групи -ОН, -NH2, -СООН
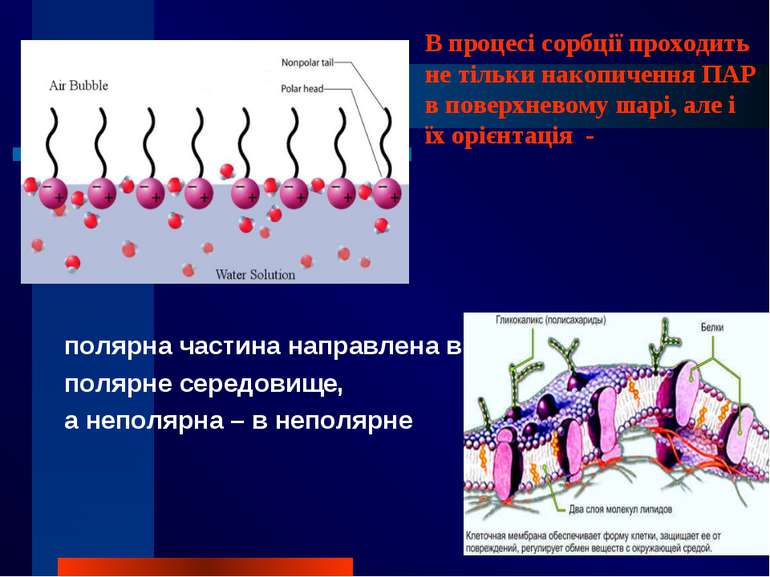
полярна частина направлена в полярне середовище, а неполярна – в неполярне В процесі сорбції проходить не тільки накопичення ПАР в поверхневому шарі, але і їх орієнтація -
Правило Дюкло -Траубе Поверхнева активність дифільних молекул зі збільшенням вуглецевого данцюга на одну групу СН2 підвищується в 2,5 – 3,5 рази.
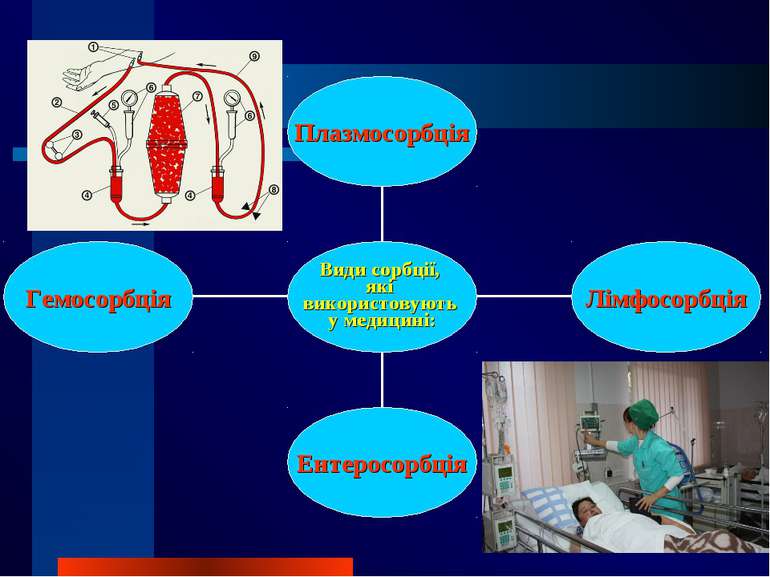
Сорбція поглинання однієї речовини іншою речовиною Адсорбція - зміна концентрації компонентів в поверхневому шарі порівняно з об’ємом фази. Адсорбція спостерігається на межі поділу різних фаз.
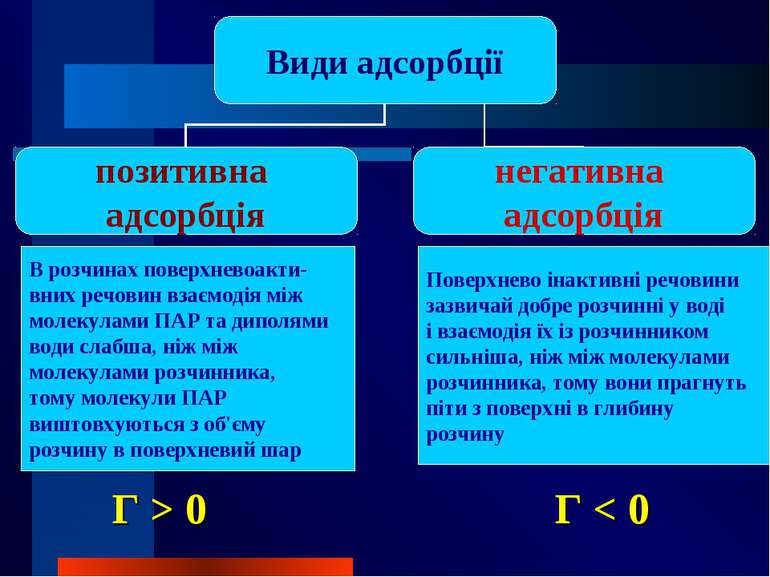
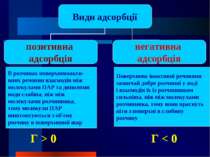
В розчинах поверхневоакти- вних речовин взаємодія між молекулами ПАР та диполями води слабша, ніж між молекулами розчинника, тому молекули ПАР виштовхуються з об'єму розчину в поверхневий шар Поверхнево інактивні речовини зазвичай добре розчинні у воді і взаємодія їх із розчинником сильніша, ніж між молекулами розчинника, тому вони прагнуть піти з поверхні в глибину розчину Г > 0 Г < 0
Рівняння Гіббса поверхнева активність Якщо поверхнева активність > 0, тоді адсорбція – негативна, якщо вона
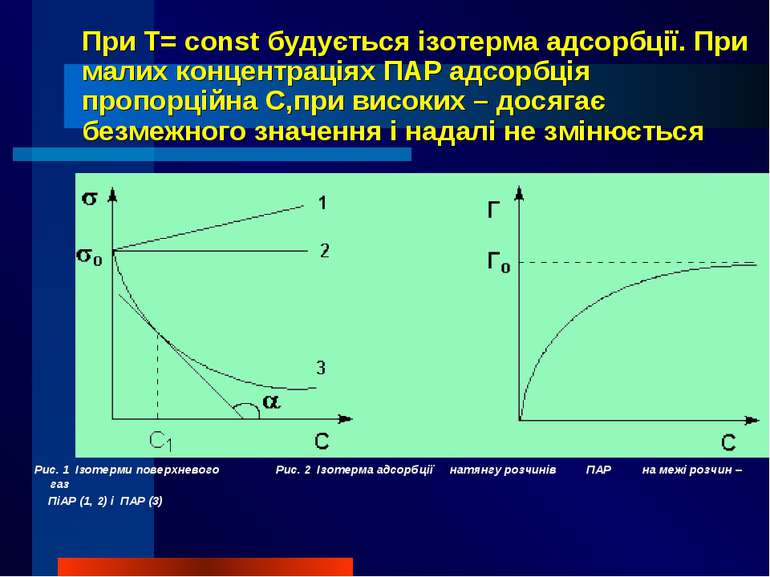
При T= const будується ізотерма адсорбції. При малих концентраціях ПАР адсорбція пропорційна С,при високих – досягає безмежного значення і надалі не змінюється Рис. 1 Ізотерми поверхневого Рис. 2 Ізотерма адсорбції натянгу розчинів ПАР на межі розчин – газ ПіАР (1, 2) і ПАР (3)
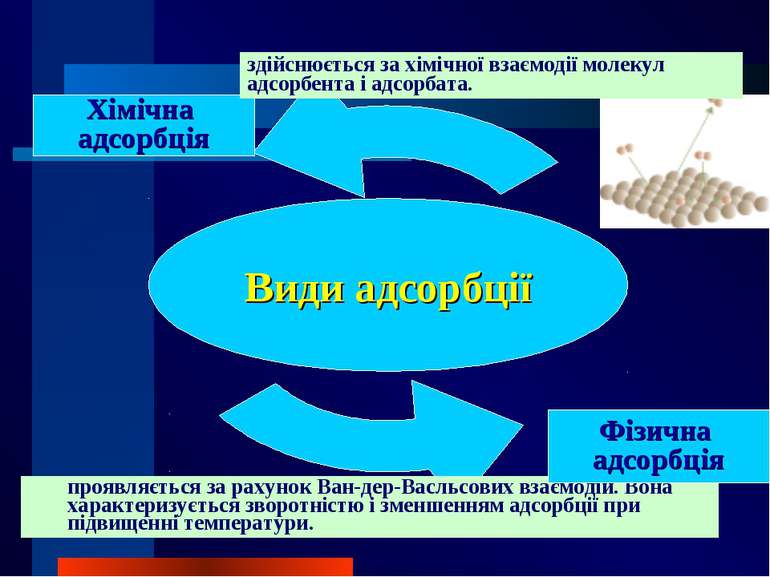
Хімічна адсорбція здійснюється за хімічної взаємодії молекул адсорбента і адсорбата. проявляється за рахунок Ван-дер-Васльсових взаємодій. Вона характеризується зворотністю і зменшенням адсорбції при підвищенні температури. Фізична адсорбція
Адсорбція газів на твердих поверхнях Виражають в молях адсорбтиву на одиницю маси адсорбента: Г = Х / m Х – кількість молей адсорбтиву m – маса адсорбента Адсорбція газів залежить від температури. Чим вища температура, тим менша адсорбція (молекули газу мають більшу кінетичну енергію та легше відриваються від молекули адсорбента).
Адсорбція з розчинів: Молекулярна – залежить від природи розчинника і адсорбента Іонна Адсорбенти, на яких проходить процес обміну іонів називають іонітами (іонообмінниками).
Правило вирівнювання полярності фаз (правило Ребіндера): Розчинена речовина тим краще адсорбується , чим більша різниця полярностей між нею та розчинником ПАР з водних розчинів добре адсорбуються на гідрофобних поверхнях, а з неполярних чи малополярних розчинників – на гідрофільних
Правило Пескова-Фаянса або правило вибіркової адсорбції Перше правило. На поверхні кристалічного твердого тіла з розчину електроліту специфічно адсорбується іон, який здатний добудовувати його кристалічну решітку або може утворювати з одним з іонів, що входить в склад кристалу, малорозчинну сполуку.
Правило Пескова-Фаянса Друге правило. На твердій поверхні адсорбента адсорбуються тільки ті іони, знак заряду яких протилежний знаку заряду поверхні адсорбента
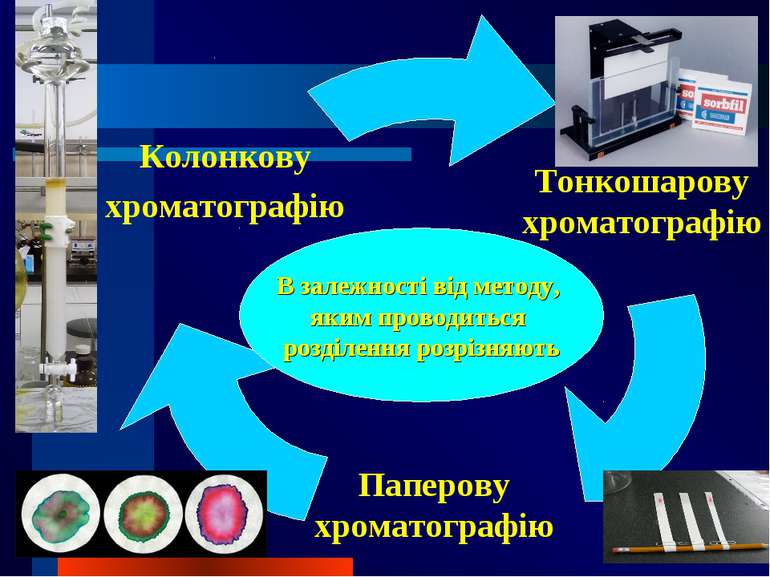
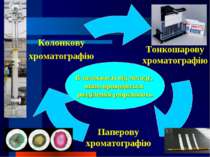
Хроматографічний метод Окрім свого головного завдання – якісного та кількісного аналізу складних сумішей, – хроматографічні методи вирішують і наступні завдання: концентрування речовини і її виділення з розведених розчинів чи сумішей випробовування речовини на однорідність, на чистоту очистка речовин від домішок розділення складних сумішей на окремі компоненти з препаративною метою ідентифікація речовин і встановлення відмінностей між ними
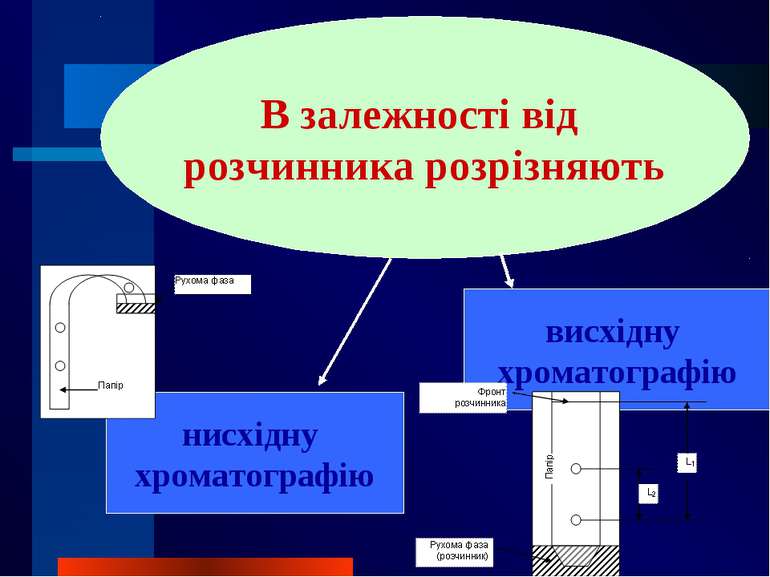
Залежно від агрегатного стану рухомої фази розрізняють рідинну хроматографію газову хроматографію
За механізмом розділення є такі види хроматографії: адсорбційна розподільна йонообмінна афінна
Схожі презентації
Категорії