Презентація на тему:
основний катаболізм
Завантажити презентацію
основний катаболізм
Завантажити презентаціюПрезентація по слайдам:
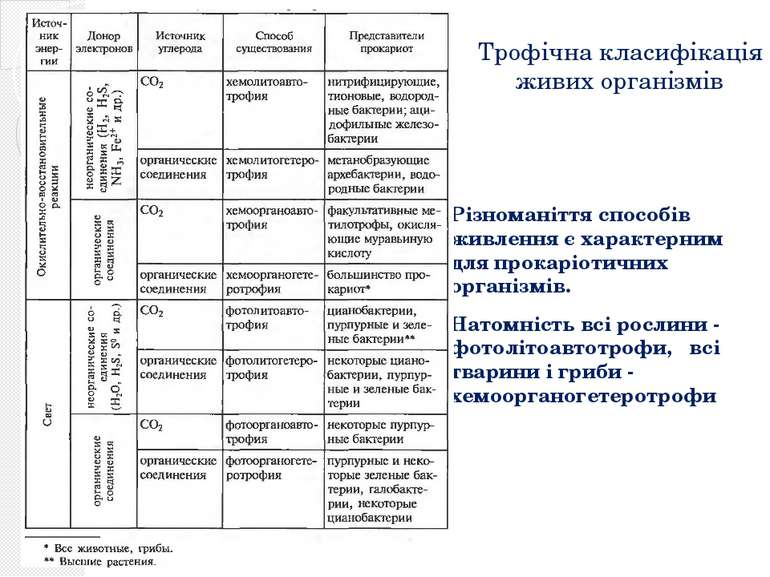
Трофічна класифікація живих організмів Різноманіття способів живлення є характерним для прокаріотичних організмів. Натомність всі рослини - фотолітоавтотрофи, всі тварини і гриби - хемоорганогетеротрофи
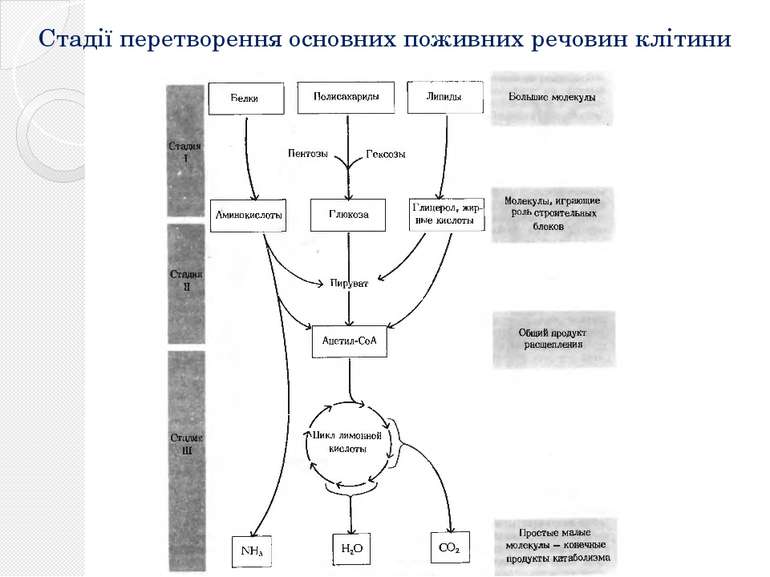
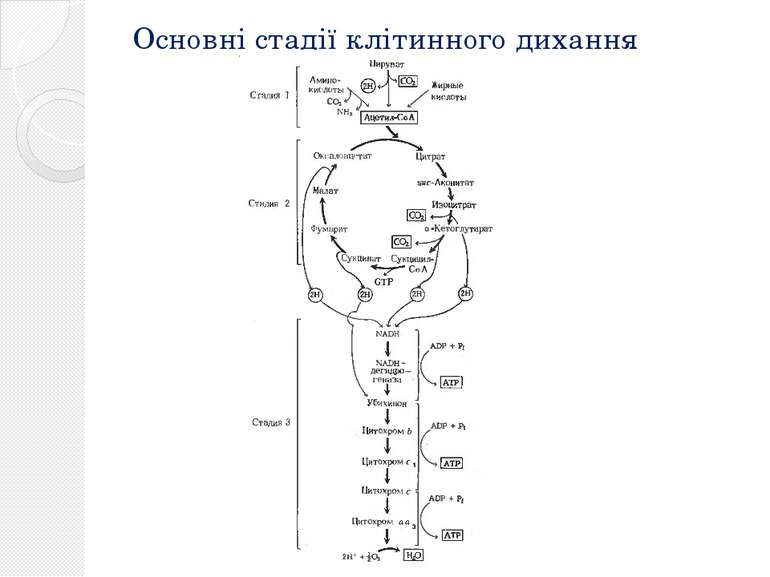
Стадії основного катаболічного шляху тваринної клітини Гліко лиз Окислювальне декарбоксилювання пірувата Цикл лимонної кислоти (цикл трикарбонових кислот, цикл Кребса) Окислювальне фосфорилювання
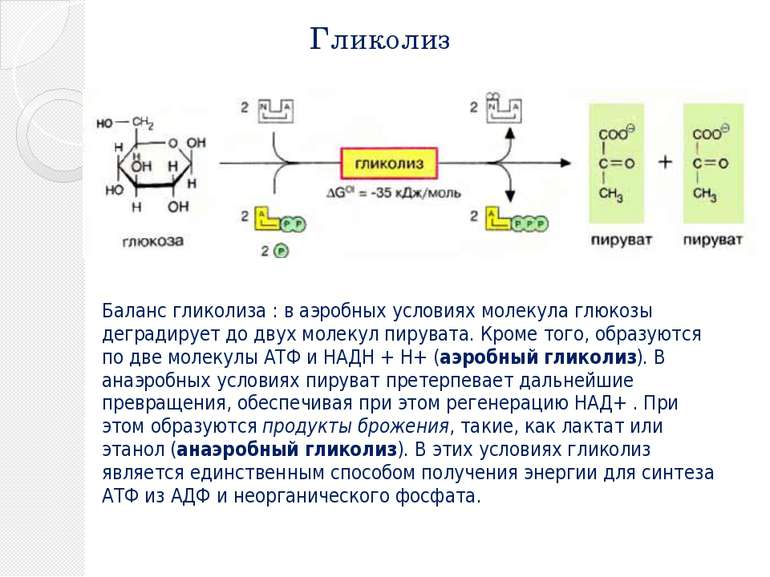
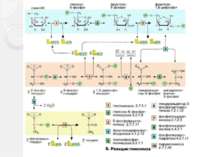
Гликолиз Глико лиз (фосфотриозный путь, или шунт Эмбдена — Мейерхофа, или путь Эмбдена-Мейергофа-Парнаса ) — ферментативный процесс последовательного расщепления глюкозы в клетках, сопровождающийся синтезом АТФ. Гликолиз при аэробных условиях ведёт к образованию пировиноградной кислоты (пирувата), гликолиз в анаэробных условиях ведёт к образованию молочной кислоты (лактата). Гликолиз является основным путём катаболизма глюкозы в организме животных. Осуществляется в цитоплазме.
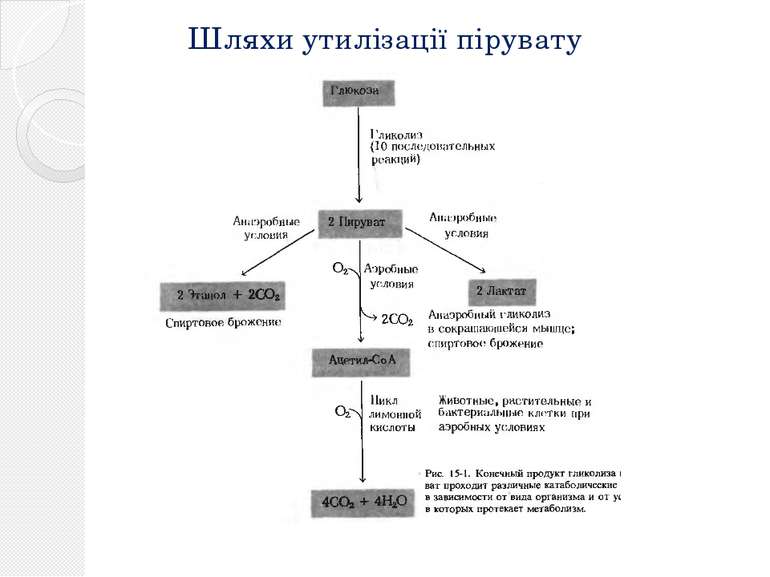
Гликолиз Баланс гликолиза : в аэробных условиях молекула глюкозы деградирует до двух молекул пирувата. Кроме того, образуются по две молекулы АТФ и НАДН + H+ (аэробный гликолиз). В анаэробных условиях пируват претерпевает дальнейшие превращения, обеспечивая при этом регенерацию НАД+ . При этом образуются продукты брожения, такие, как лактат или этанол (анаэробный гликолиз). В этих условиях гликолиз является единственным способом получения энергии для синтеза АТФ из АДФ и неорганического фосфата.
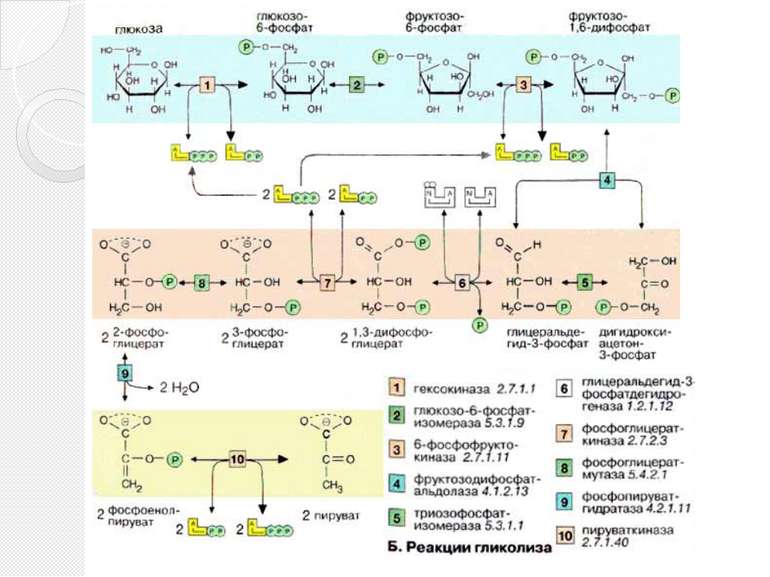
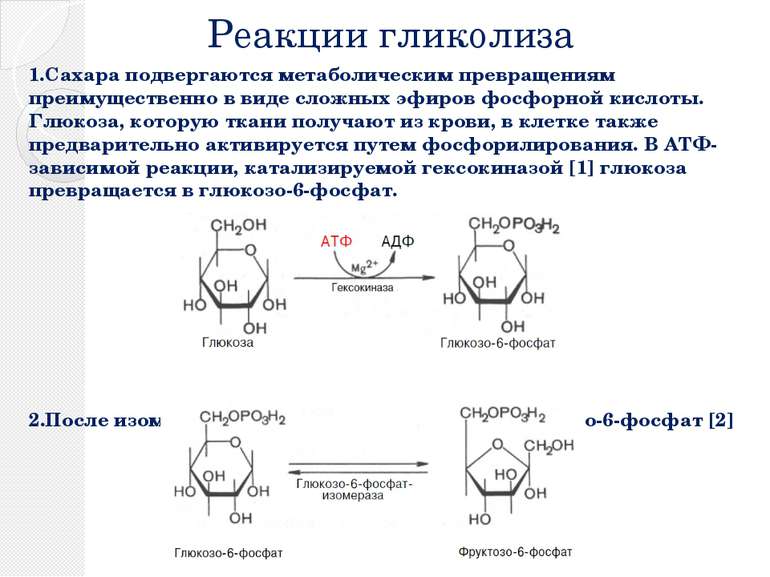
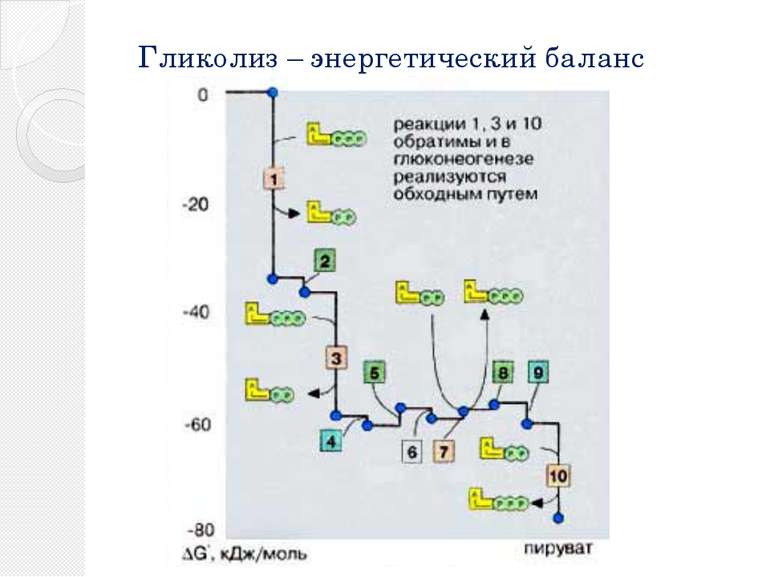
Реакции гликолиза 1.Сахара подвергаются метаболическим превращениям преимущественно в виде сложных эфиров фосфорной кислоты. Глюкоза, которую ткани получают из крови, в клетке также предварительно активируется путем фосфорилирования. В АТФ-зависимой реакции, катализируемой гексокиназой [1] глюкоза превращается в глюкозо-6-фосфат. 2.После изомеризации глюкозо-6-фосфата в фруктозо-6-фосфат [2]
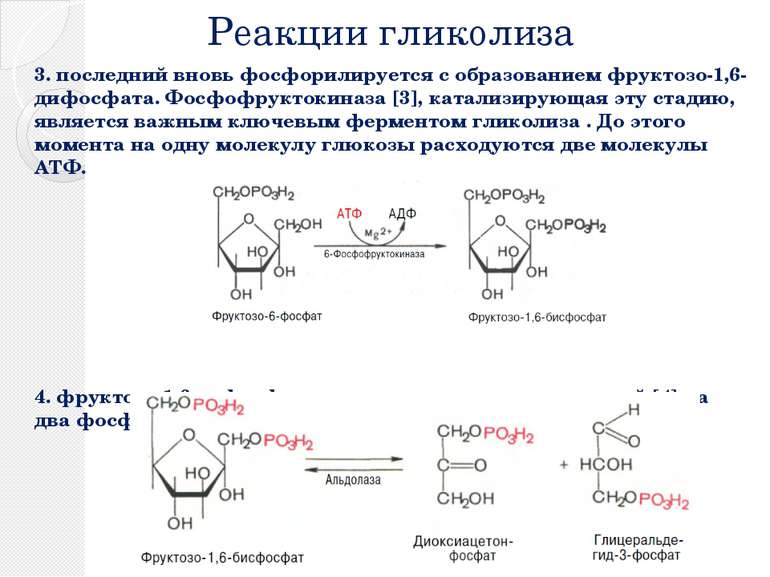
Реакции гликолиза 3. последний вновь фосфорилируется с образованием фруктозо-1,6-дифосфата. Фосфофруктокиназа [3], катализирующая эту стадию, является важным ключевым ферментом гликолиза . До этого момента на одну молекулу глюкозы расходуются две молекулы АТФ. 4. фруктозо-1,6-дифосфат расщепляется далее альдолазой [4] на два фосфорилированных С3-фрагмента.
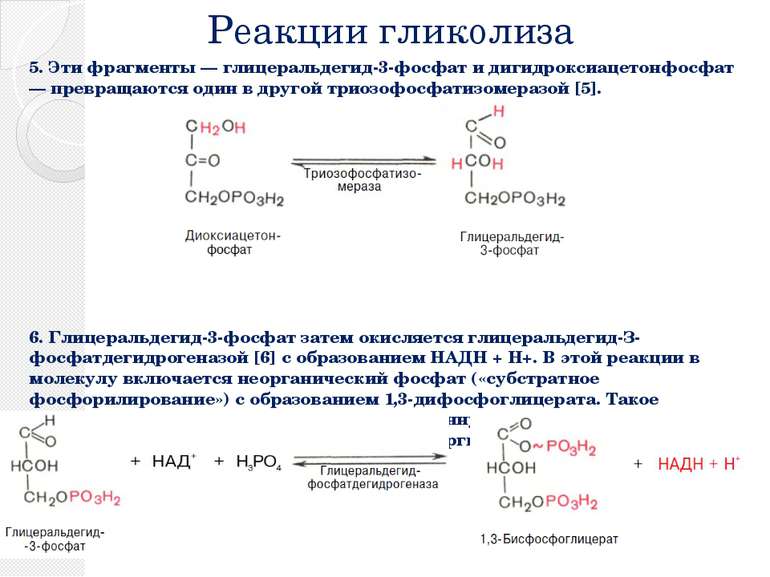
Реакции гликолиза 5. Эти фрагменты — глицеральдегид-3-фосфат и дигидроксиацетонфосфат — превращаются один в другой триозофосфатизомеразой [5]. 6. Глицеральдегид-3-фосфат затем окисляется глицеральдегид-З-фосфатдегидрогеназой [6] с образованием НАДН + Н+. В этой реакции в молекулу включается неорганический фосфат («субстратное фосфорилирование») с образованием 1,3-дифосфоглицерата. Такое промежуточное соединение содержит смешанную ангидридную связь, расщепление которой является высоко экзоэргическим процессом.
Реакции гликолиза 7.На следующей стадии (катализируемой фосфоглицераткиназой [7]) гидролиз этого соединения сопряжен с образованием АТФ. 8. Следующий промежуточный продукт, гидролиз которого может быть сопряжен с синтезом АТФ, образуется в реакции изомеризации 3-фосфоглицерата, полученного в результате реакции [7], в 2-фосфоглицерат (фермент: фосфоглицератмутаза [8]) .
Реакции гликолиза 9. и последующего отщепления воды (фермент: енолаза [9]). Продукт представляет собой сложный эфир фосфорной кислоты и енольной формы пирувата и потому называется фосфоенолпируватом (PEP). 10. На последней стадии, которая катализируется пируваткиназой [10], образуются пируват и АТФ. Наряду со стадией [6] и тиокиназной реакцией в цитратном цикле это третья реакция, позволяющая клеткам синтезировать АТФ независимо от дыхательной цепи. Несмотря на образование АТФ она высоко экзоэргична и потому необратима.
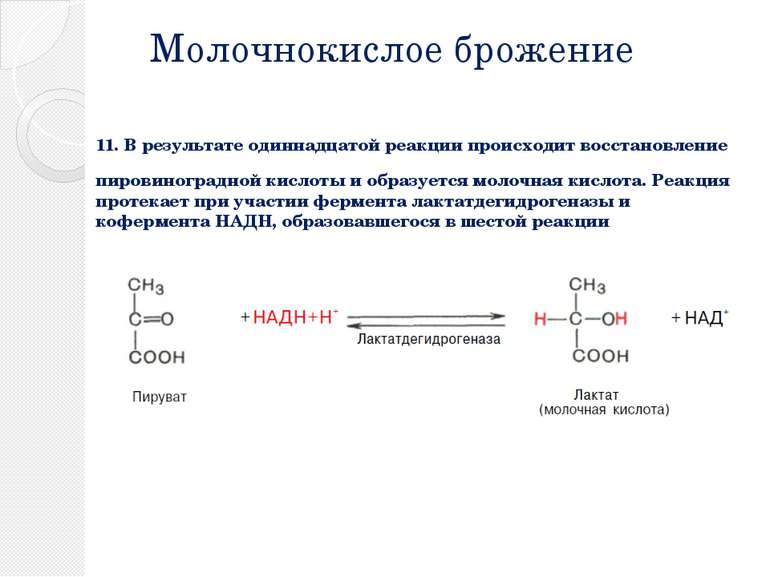
Молочнокислое брожение 11. В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции
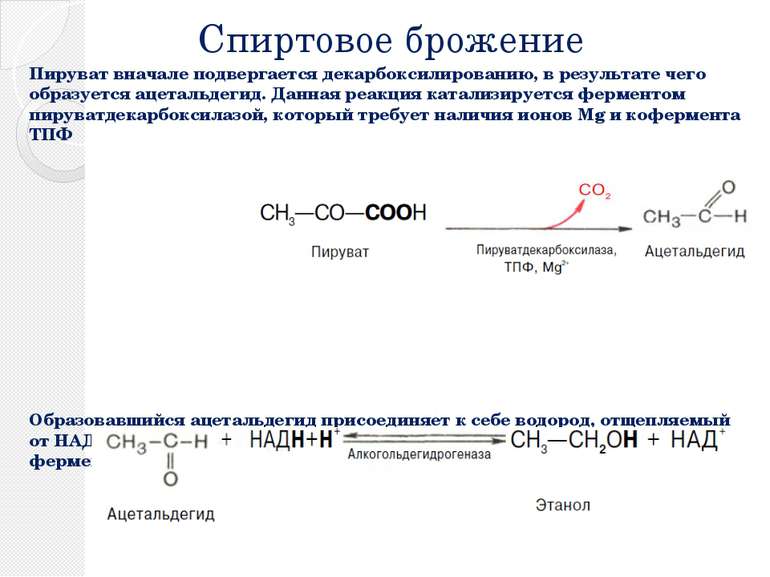
Спиртовое брожение Пируват вначале подвергается декарбоксилированию, в результате чего образуется ацетальдегид. Данная реакция катализируется ферментом пируватдекарбоксилазой, который требует наличия ионов Mg и кофермента ТПФ Образовавшийся ацетальдегид присоединяет к себе водород, отщепляемый от НАДН, восстанавливаясь при этом в этанол. Реакция катализируется ферментом алкогольдегидрогеназой
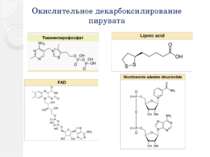
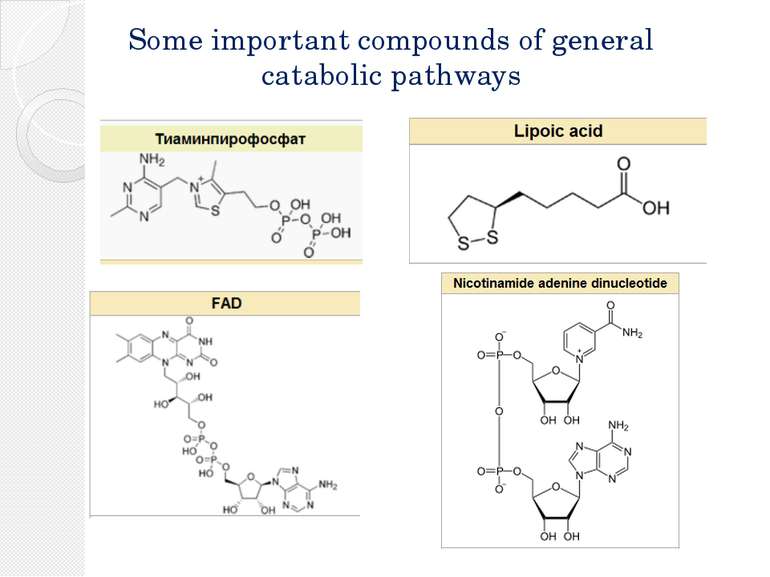
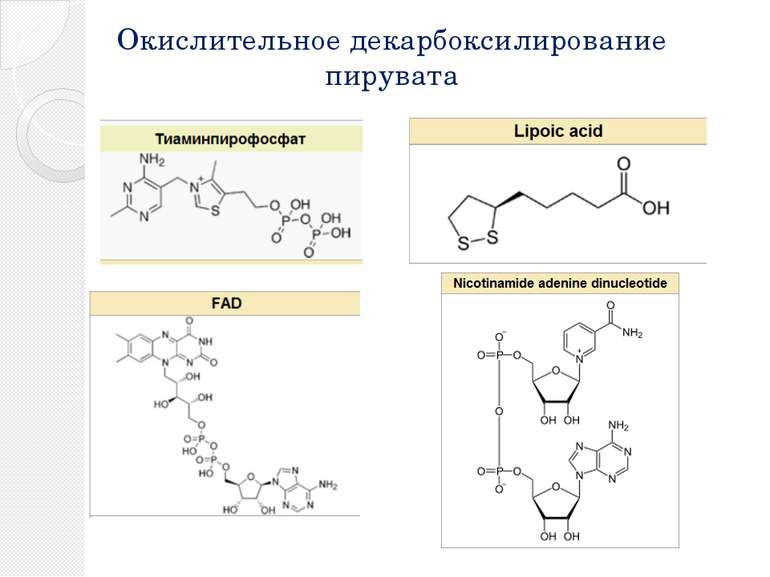
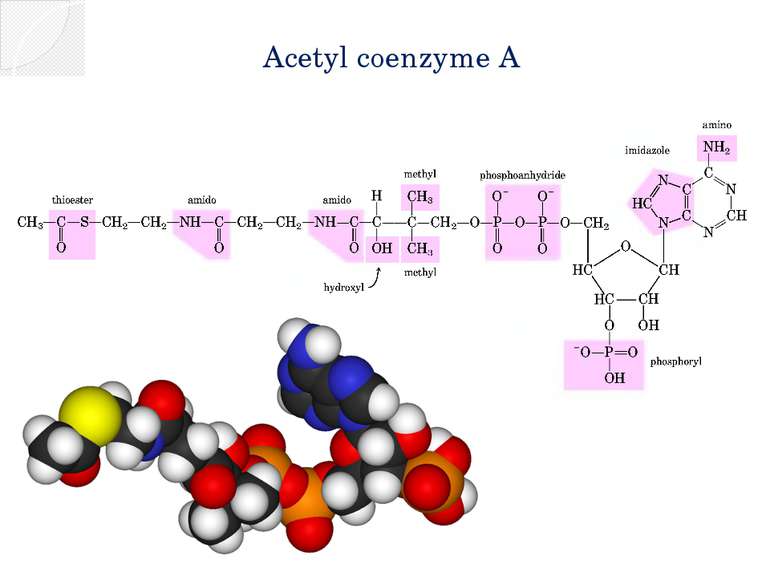
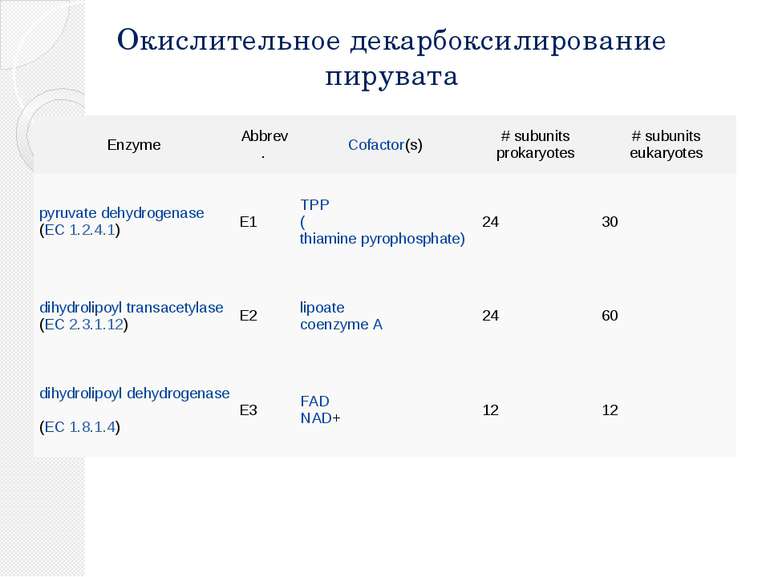
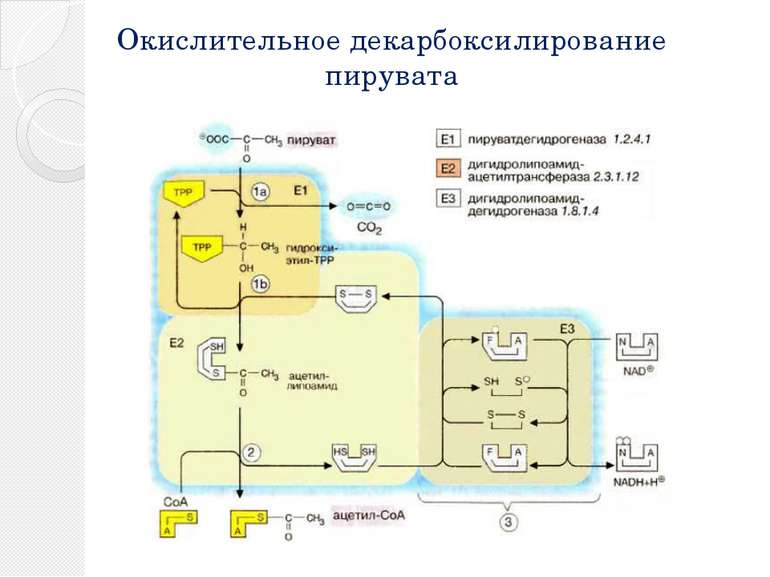
Окислительное декарбоксилирование пирувата Пируватдегидрогеназный комплекс включает в себя 3 фермента, 3 кофактора (простетическая группа, связанная с апоферментом прочно ковалентно), 2 кофермента (простетическая группа, связанная с апоферментом непрочно нековалентно): Е1 — пируватдегидрогеназа декарбоксилирующая. Кофактором является активная формавитамина В1 — тиаминпирофосфат. Е2 — дигидролипоилацетилтрансфераза. Кофактором является витаминоподобное вещество — липоевая кислота, которая присоединив 2 атома водорода может превращаться в дигидролипоил. Коферментом является активная формапантотеновой кислоты — НS-КоА, она принимает ацетильный остаток от липоевой кислоты. Е3 — дигидролипоилдегидрогеназа . Кофактором является флавинадениндинуклеотид (ФАД) — активная форма витамина В2. Коферментом является активная форма витамина PP — никотинамидадениндинуклеотид (НАД+).
Окислительное декарбоксилирование пирувата Enzyme Abbrev. Cofactor(s) # subunits prokaryotes # subunits eukaryotes pyruvate dehydrogenase (EC 1.2.4.1) E1 TPP (thiamine pyrophosphate) 24 30 dihydrolipoyl transacetylase (EC 2.3.1.12) E2 lipoate coenzyme A 24 60 dihydrolipoyl dehydrogenase (EC 1.8.1.4) E3 FAD NAD+ 12 12
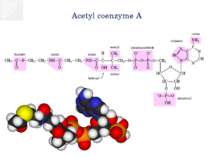
Реакции окислительного декарбоксилирования пирувата Пируватдегидрогеназа (Е1) катализирует декарбоксилирование пирувата, перенос образованного гидроксиэтильного остатка на тиаминдифосфат (TPP, 1а), а также окисление гидроксиэтильной группы с образованием ацетильного остатка. Этот остаток и полученные восстановительные эквиваленты переносятся на липоамид . Следующий фермент, дигидролипоамидацетилтрансфераза (Е2) переносит ацетильный остаток с липоамида на кофермент А (2), при этом липоамид восстанавливается до дигидролипоамида. Последний снова окисляется до липоамида третьим ферментом, дигидролипоамиддегидрогеназой (Е3) с образованием НАДН + Н+ (NADH + Н+) (3). Электроны переносятся на растворимый НАД+ через ФАД и каталитически активный дисульфидный мостик субъединицы Е3.
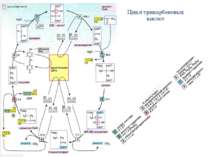
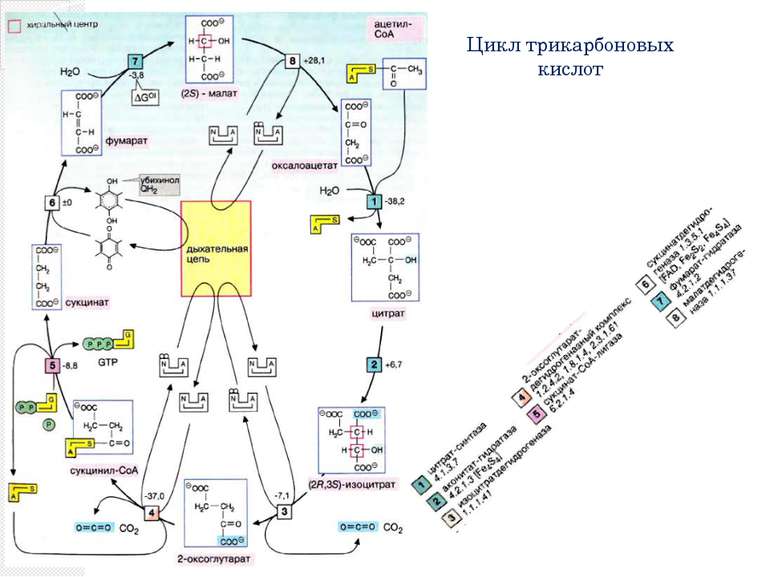
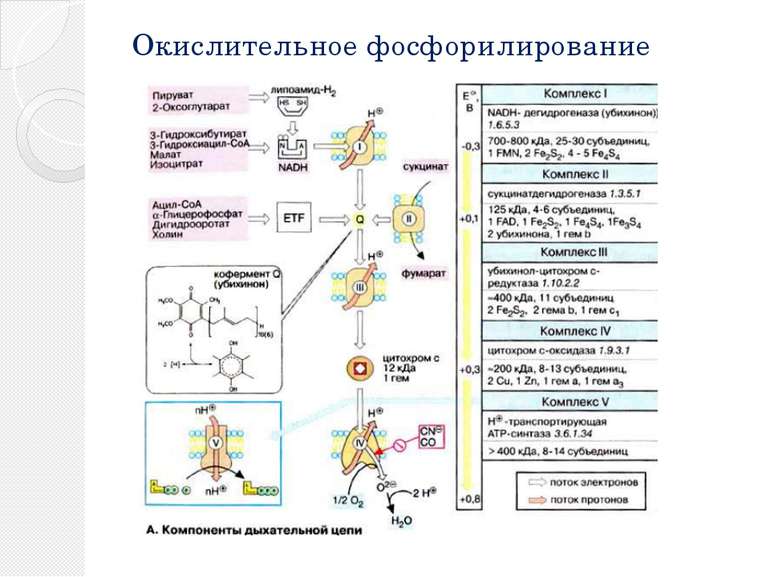
Цикл трикарбоновых кислот Ацетил-КоА под действием цитратсинтазы передаёт ацетильную группу оксалоацетату с образованием лимонной кислоты, которая поcтупает в цикл трикарбоновых кислот (цикл Кребса). В ходе одного оборота цикла лимонная кислота несколько раз дегидрируется и дважды декарбоксилируется с регенерацией оксалоацетата и образованием одной молекулы ГТФ (способом субстратного фосфорилирования), трёх НАДН и ФАДН2. Суммарное уравнение реакций: Ацетил-КоА + 3НАД+ + ФАД + ГДФ + Фн + 2H2O + КоА-SH = 2КоА-SH + 3НАДH + 3H+ + ФАДН2 + ГТФ + 2CO2 У эукариот ферменты цикла находятся в свободном состоянии в матриксе митохондрий, только сукцинатдегидрогеназавстроена во внутреннюю митохондриальную мембрану. .
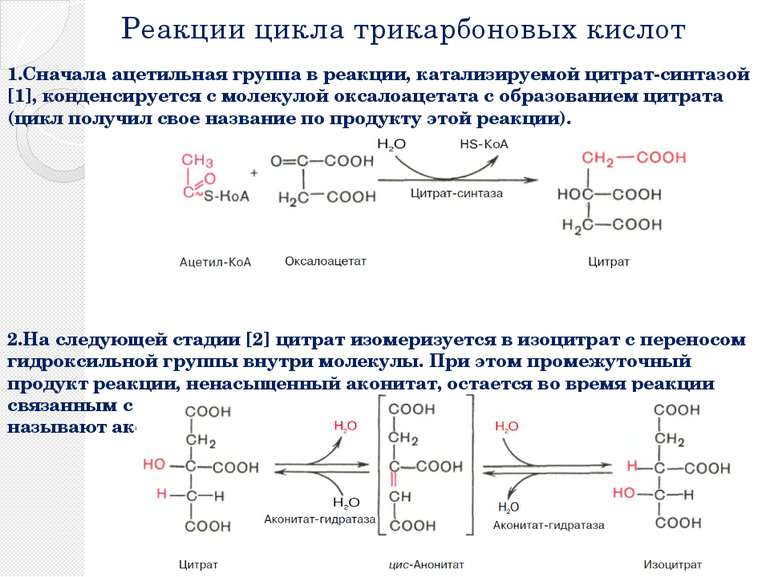
Реакции цикла трикарбоновых кислот 1.Сначала ацетильная группа в реакции, катализируемой цитрат-синтазой [1], конденсируется с молекулой оксалоацетата с образованием цитрата (цикл получил свое название по продукту этой реакции). 2.На следующей стадии [2] цитрат изомеризуется в изоцитрат с переносом гидроксильной группы внутри молекулы. При этом промежуточный продукт реакции, ненасыщенный аконитат, остается во время реакции связанным с ферментом. Поэтому фермент, катализирующий реакцию, называют аконитат-гидратазой [2] («аконитазой»).
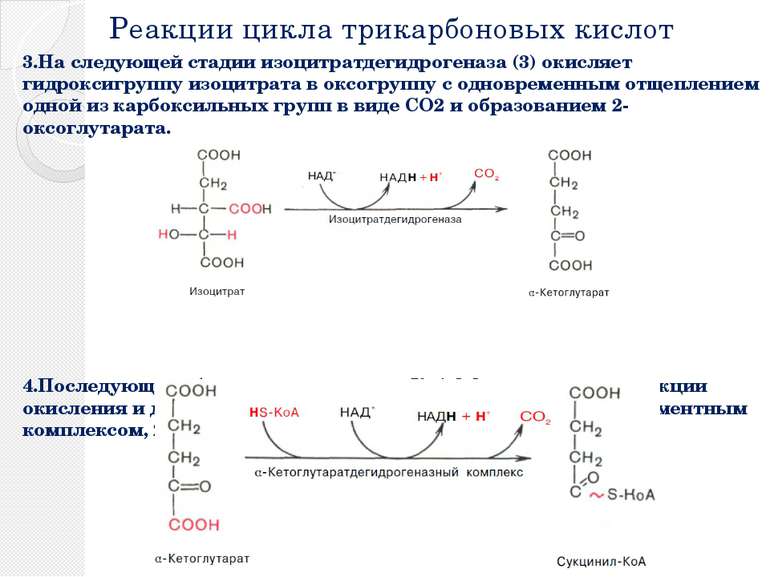
Реакции цикла трикарбоновых кислот 3.На следующей стадии изоцитратдегидрогеназа (3) окисляет гидроксигруппу изоцитрата в оксогруппу с одновременным отщеплением одной из карбоксильных групп в виде CO2 и образованием 2-оксоглутарата. 4.Последующее образование сукцинил-КоА [4], включающее реакции окисления и декарбоксилирования, катализируется мультиферментным комплексом, 2-оксоглутаратдегидрогеназой
Реакции цикла трикарбоновых кислот 5. Расщепление тиолсложноэфирной связи сукцинил-КоА с образованием сукцината и кофермента А, катализируемое сукцинат-КоА-лигазой («тиокиназой» (5)], — высокоэкзоэргическая реакция, энергия которой используется для синтеза фосфоангидридной связи («субстратного фосфорилирования»). В цитратном цикле синтезируется не АТФ, как в большинстве таких реакций, а гуанозинтрифосфат [ГТФ (GTP)], который легко превращается в АТФ нуклеозиддифосфаткиназой.
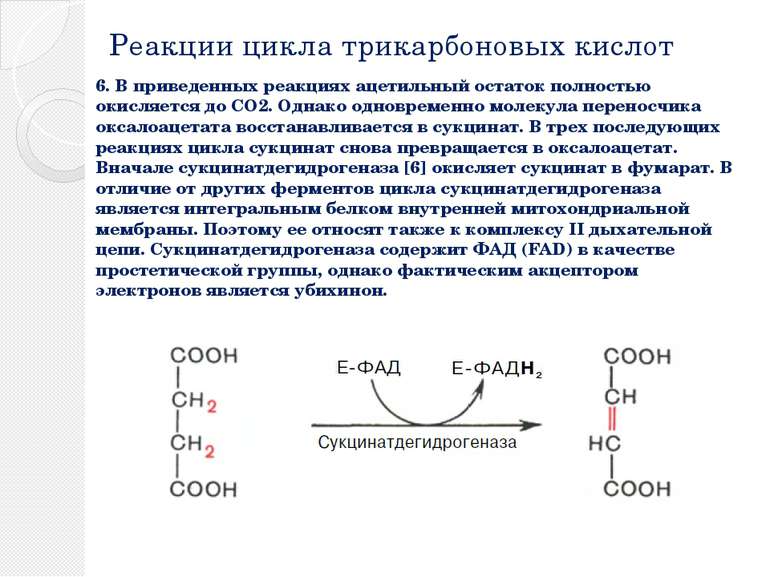
Реакции цикла трикарбоновых кислот 6. В приведенных реакциях ацетильный остаток полностью окисляется до CO2. Однако одновременно молекула переносчика оксалоацетата восстанавливается в сукцинат. В трех последующих реакциях цикла сукцинат снова превращается в оксалоацетат. Вначале сукцинатдегидрогеназа [6] окисляет сукцинат в фумарат. В отличие от других ферментов цикла сукцинатдегидрогеназа является интегральным белком внутренней митохондриальной мембраны. Поэтому ее относят также к комплексу II дыхательной цепи. Сукцинатдегидрогеназа содержит ФАД (FAD) в качестве простетической группы, однако фактическим акцептором электронов является убихинон.
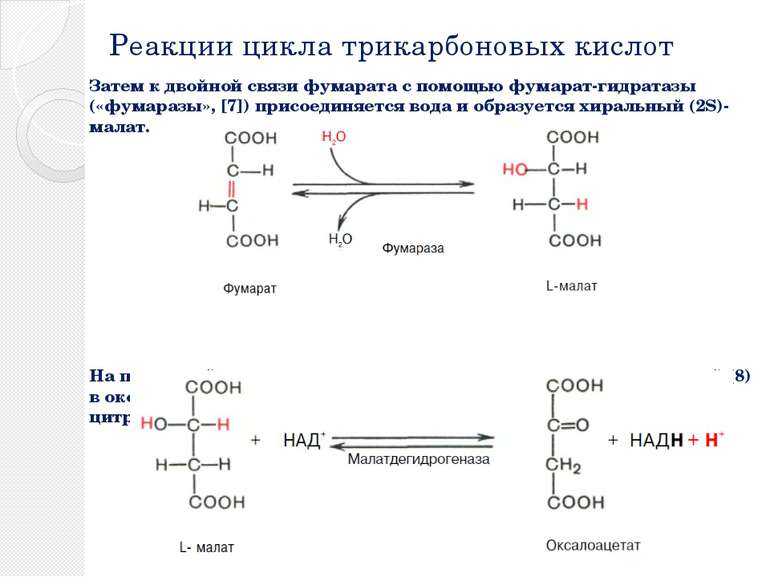
Реакции цикла трикарбоновых кислот Затем к двойной связи фумарата с помощью фумарат-гидратазы («фумаразы», [7]) присоединяется вода и образуется хиральный (2S)-малат. На последней стадии цикла малат окисляется малатдегидрогеназой (8) в оксалоацетат с образованием НАДН + Н+. Эта реакция замыкает цитратный цикл.
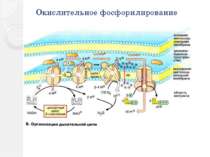
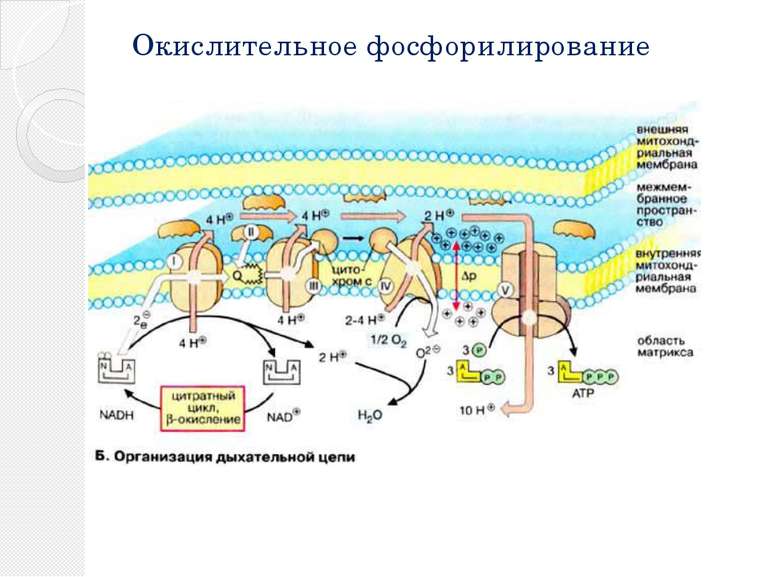
Окислительное фосфорилирование Основное количество молекул АТФ вырабатывается по способу окислительного фосфорилирования на последней стадии клеточного дыхания: в электронтранспортной цепи. Здесь происходит окисление НАД∙Н и ФАДН2, восстановленных в процессах гликолиза, β-окисления, цикла Кребса и т. д.. Энергия, выделяющаяся в ходе этих реакций, благодаря цепи переносчиков электронов, локализованной во внутренней мембране митохондрий (у прокариот — в цитоплазматической мембране), трансформируется в трансмембранный протонный потенциал. Фермент АТФ-синтаза использует этот градиент для синтеза АТФ, преобразуя его энергию в энергию химических связей. Подсчитано, что молекула НАД∙Н может дать в ходе этого процесса 2.5 молекулы АТФ, ФАДН2 — 1.5 молекулы. Конечным акцептором электрона в дыхательной цепи аэробов является кислород.
Общее уравнение дыхания, баланс АТФ Стадия Выход кофермента Выход АТФ (ГТФ) Способ получения АТФ Первая фаза гликолиза −2 Фосфорилирование глюкозы и фруктозо-6-фосфата с использованием 2 АТФ из цитоплазмы. Вторая фаза гликолиза 4 Субстратное фосфорилирование 2 НАДН 5 Окислительное фосфорилирование. Декарбоксилирова-ниепирувата 2 НАДН 5 Окислительное фосфорилирование Цикл Кребса 2 Субстратное фосфорилирование 6 НАДН 15 Окислительное фосфорилирование 2 ФАДН2 3 Окислительное фосфорилирование Общий выход 30 (32)АТФ При полном окислении глюкозы до углекислого газа и окислении всех образующихся коферментов.
Схожі презентації
Категорії




![Реакции гликолиза 9. и последующего отщепления воды (фермент: енолаза [9]). П... Реакции гликолиза 9. и последующего отщепления воды (фермент: енолаза [9]). П...](https://svitppt.com.ua/images/26/25467/770/img15.jpg)


















![Реакции гликолиза 9. и последующего отщепления воды (фермент: енолаза [9]). П... Реакции гликолиза 9. и последующего отщепления воды (фермент: енолаза [9]). П...](https://svitppt.com.ua/images/26/25467/210/img15.jpg)