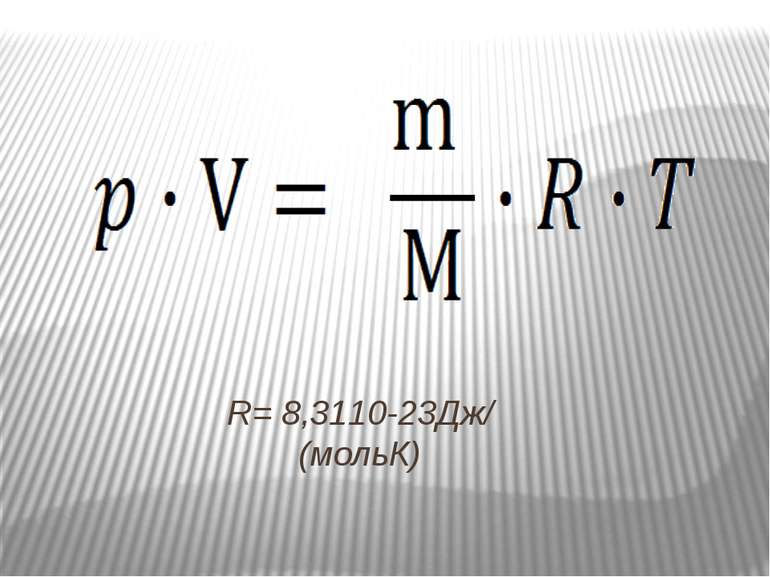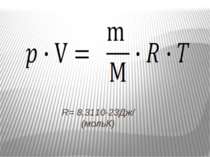Презентація на тему:
"Газові закони"
Завантажити презентацію
"Газові закони"
Завантажити презентаціюПрезентація по слайдам:
Рівняння, що встановлює зв’язок між трьома параметрами, які характеризують стан газу: тиском р, об'ємом V і температурою T . Тому рівняння називається рівнянням стану ідеального газу
Найпростіші процеси, які відбуваються зі зміною лише двох параметрів, а третій залишається сталим дістали назву – ізопроцеси.
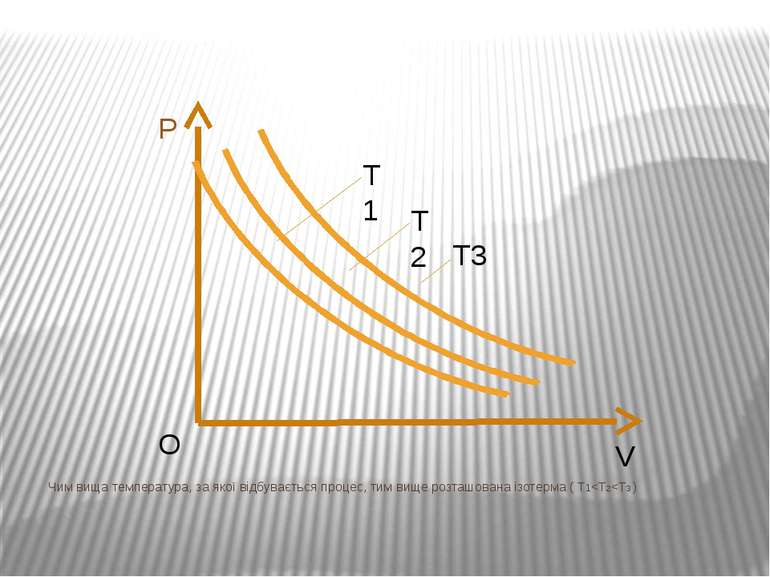
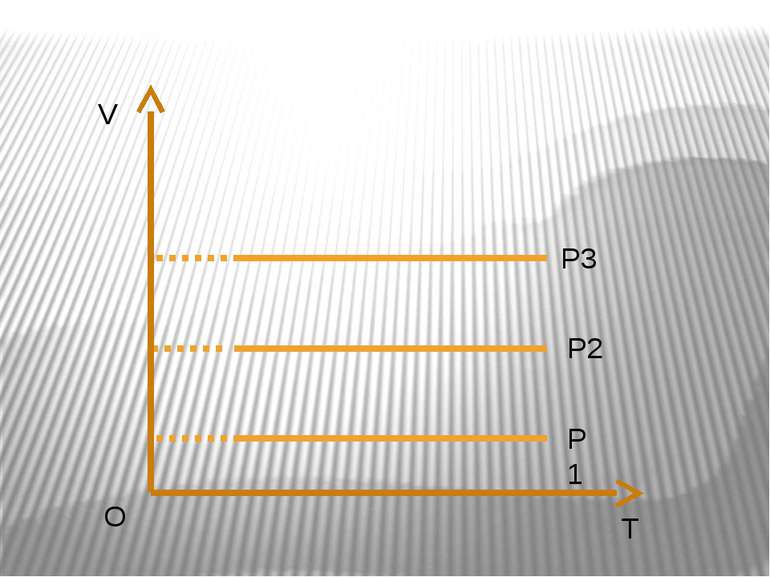
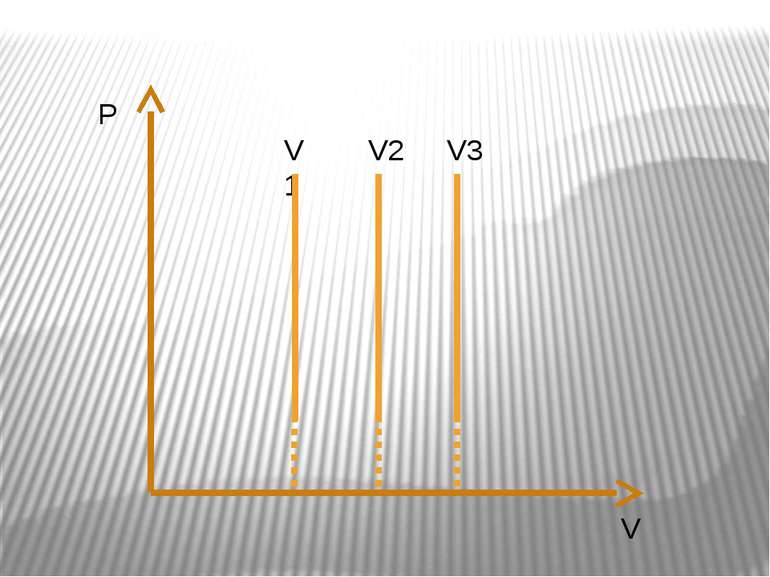
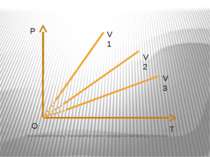
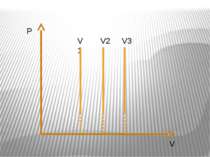
Ізотермічний процес – процес зміни стану макроскопічної системи мікроскопічних тіл, що відбувається за сталої температури. Закон Бойля-Маріотта. Добуток тиску даної маси газу на об’єм, що його займає газ за сталої температури, є величиною сталою pV=const.
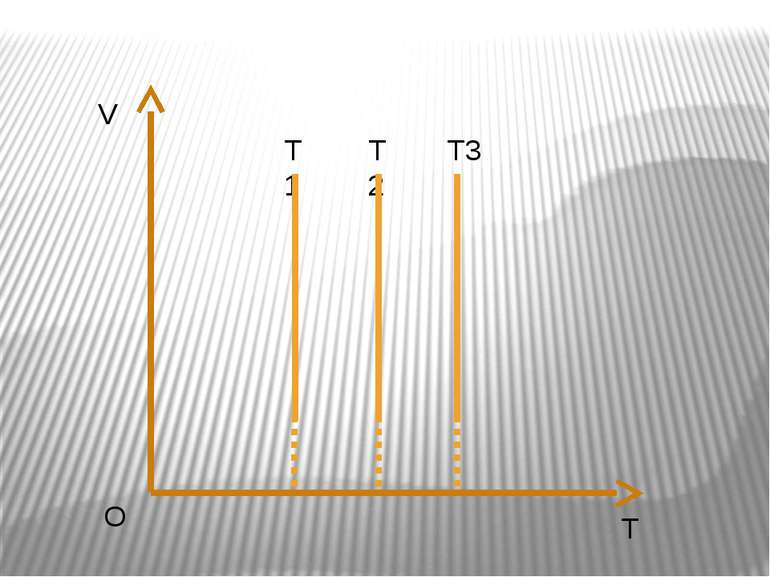
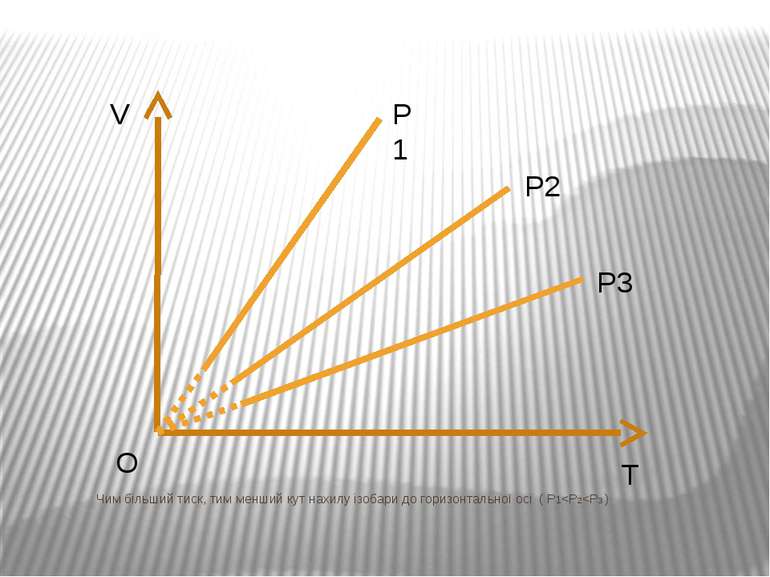
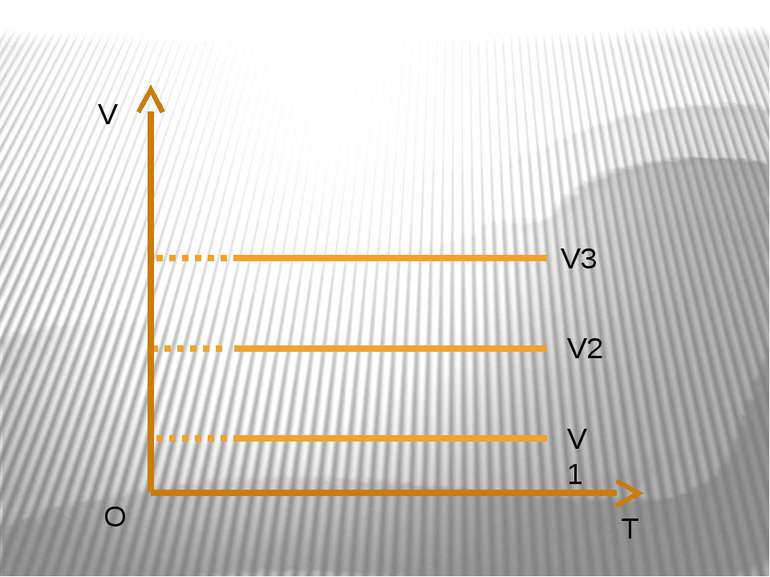
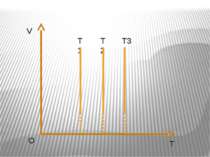
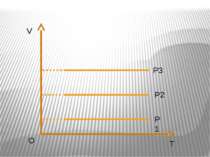
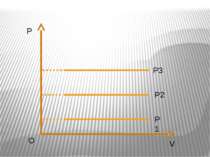
Ізобарний процес – процес зміни стану макроскопічної системи мікроскопічних тіл, що відбувається за сталого тиску. Закон Гей-Люссака. За незмінної маси газу і сталогo тиску об’єм газу прямo пропорційний абсолютний температурі. V/T=const
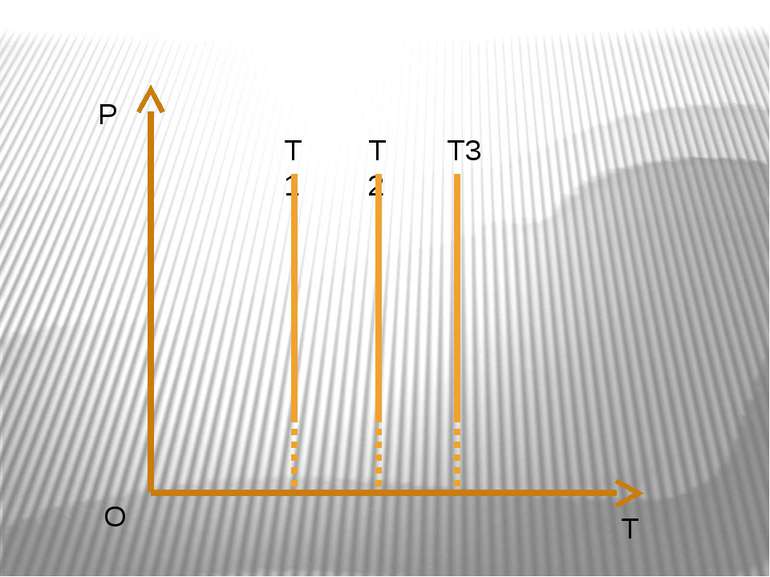
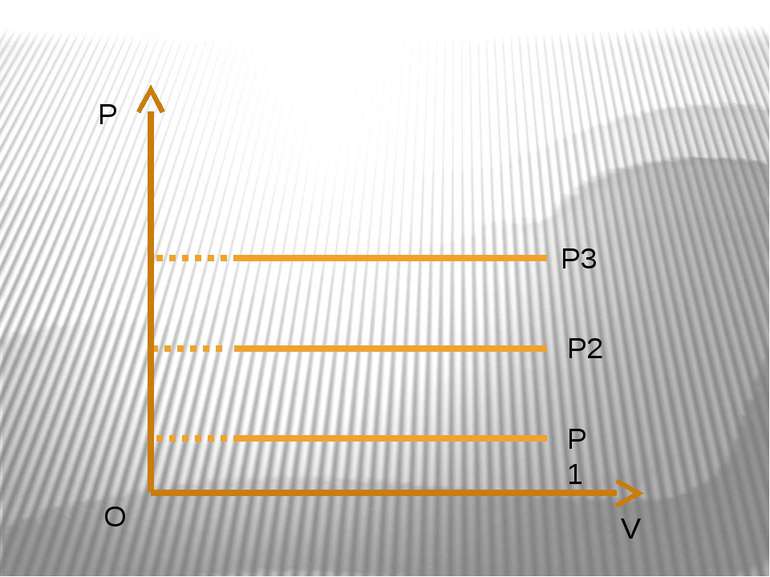
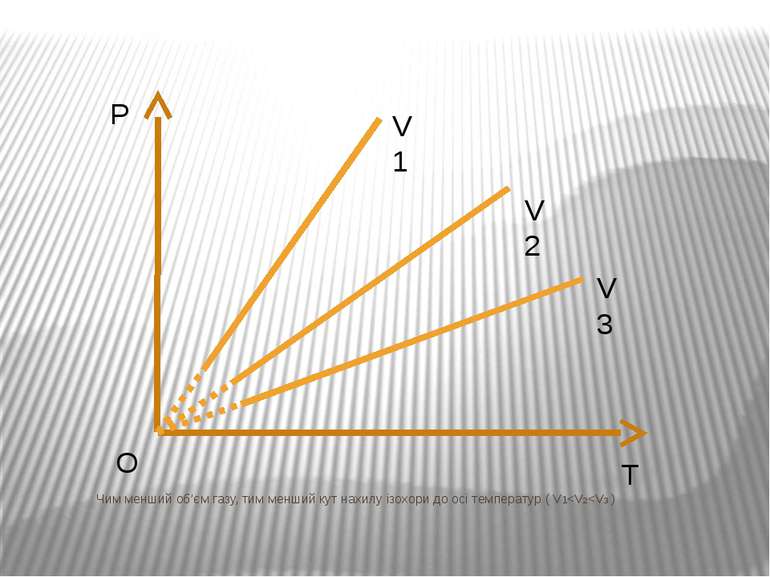
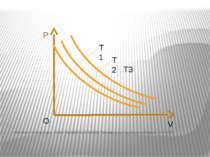
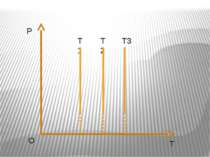
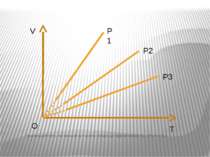
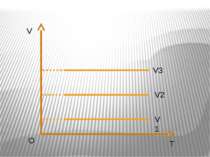
Ізохорний процес – процес зміни стану макроскопічної системи мікроскопічних тіл, що відбувається за сталого об’єму. Закон Ж.Шарля За сталого об’єму тиск газу прямо пропорційний його абсолютній температурі. Р/T=const
Схожі презентації
Категорії