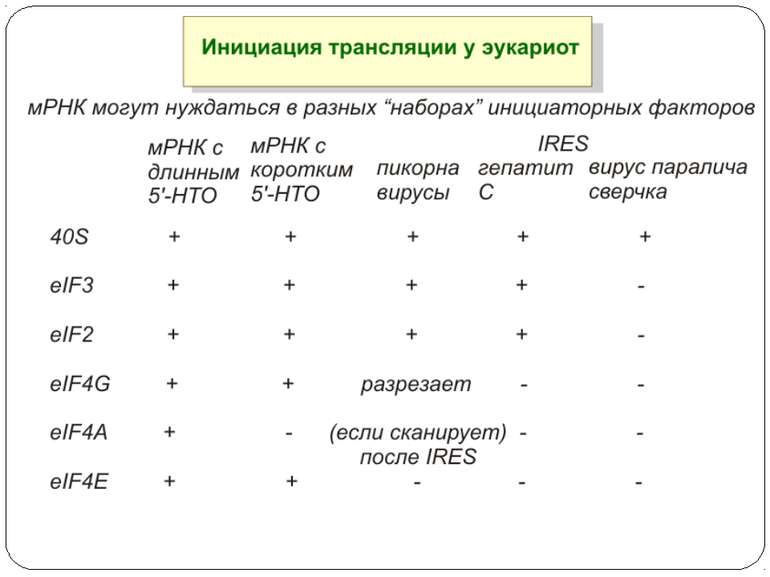
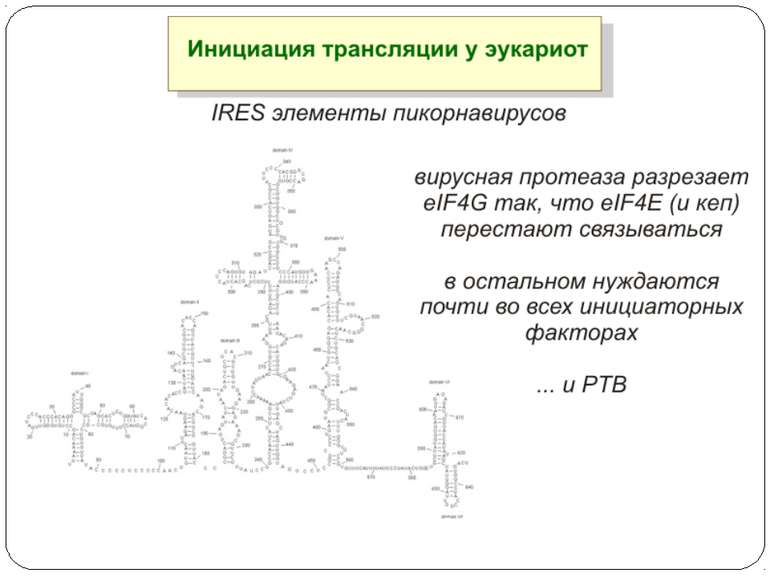
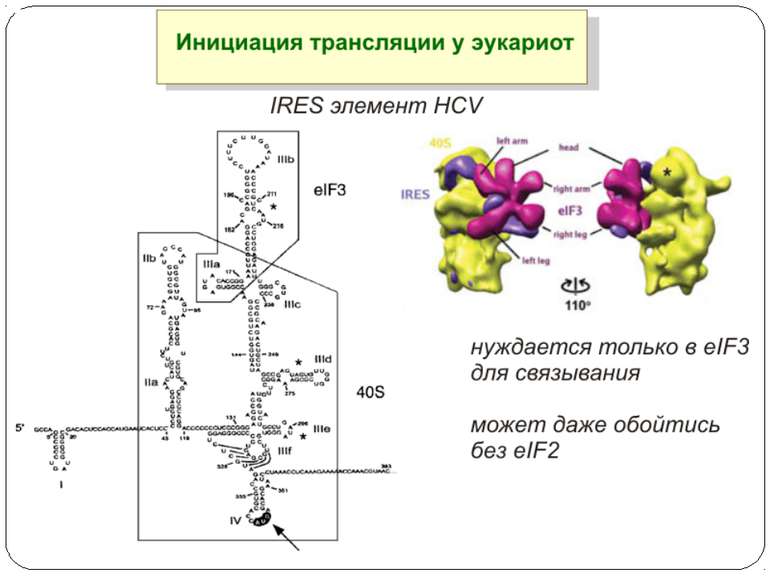
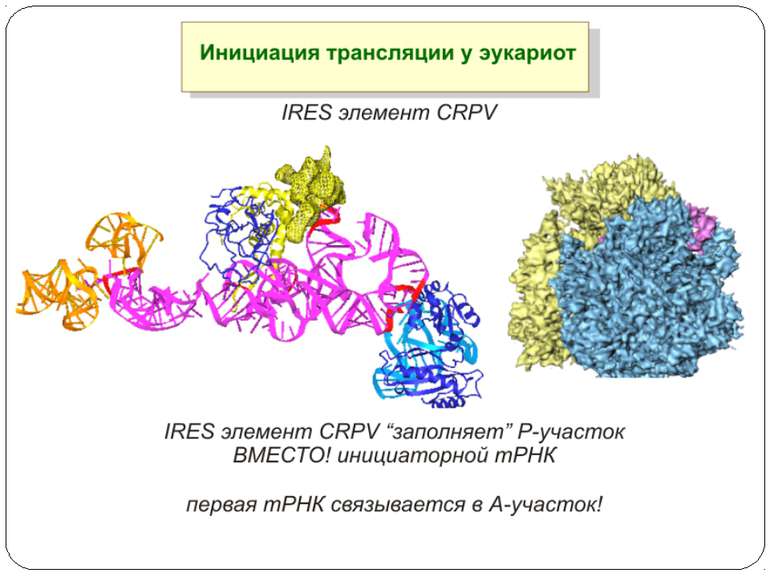
Презентація на тему:
Translation_control_eucariot_1 11 11
Завантажити презентацію
Translation_control_eucariot_1 11 11
Завантажити презентаціюПрезентація по слайдам:
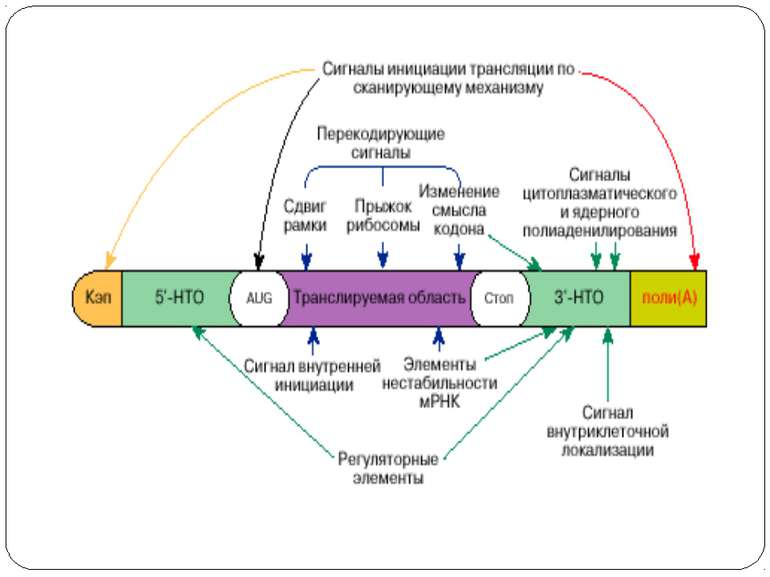
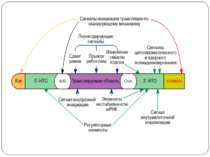
Основні шляхи регуляції трансляції Контроль процесінга мРНК Регуляція стабільності мРНК Регуляція трансляції індивідуальних мРНК Тотальна регуляція трансляції усієї сукупності мРНК : Модифікація факторів трансляції Білок p50 як регулятор трансляції Короткі ОРС як регулятори трансляції
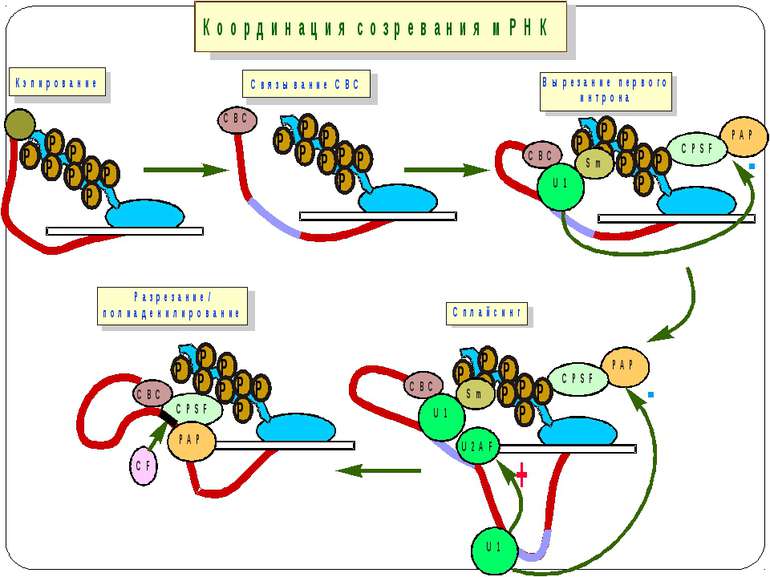
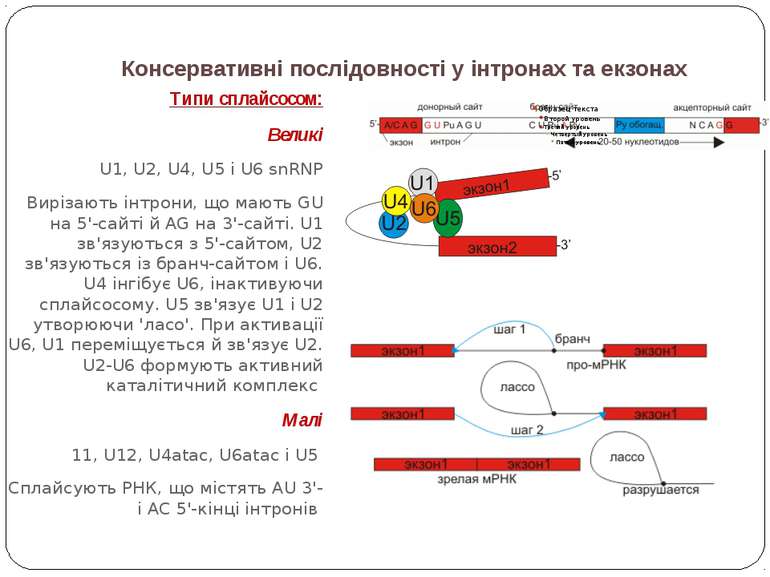
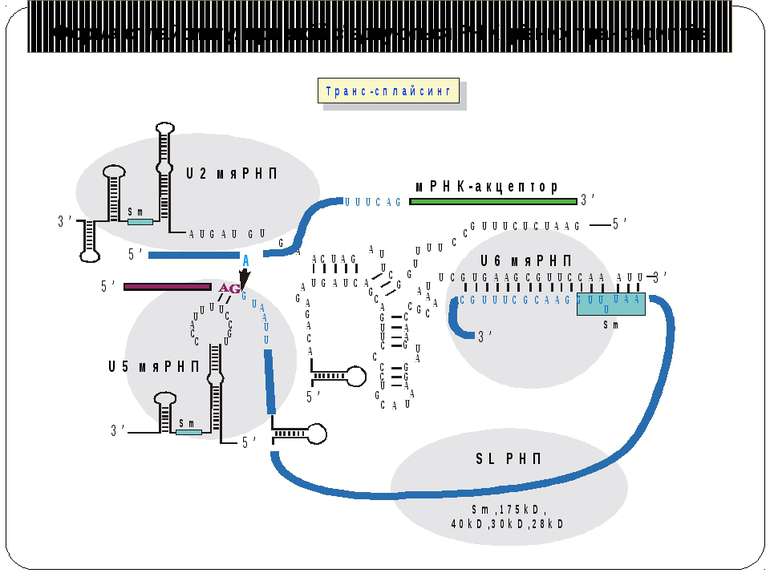
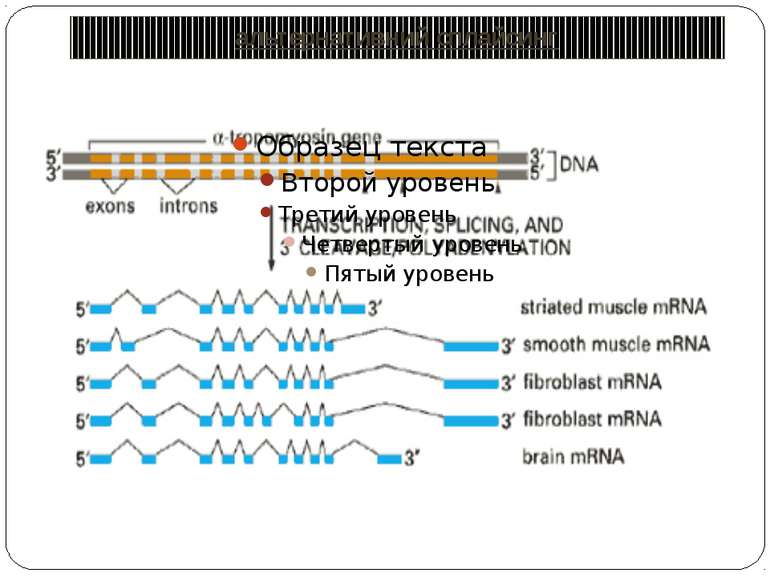
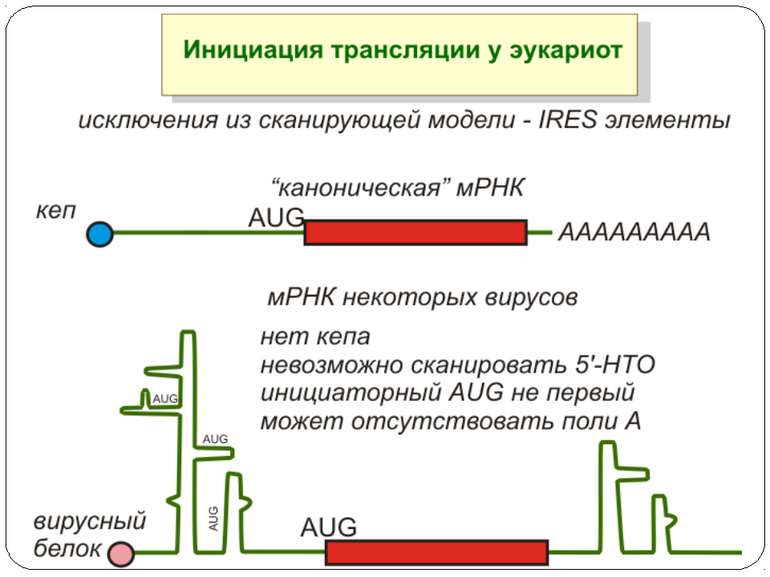
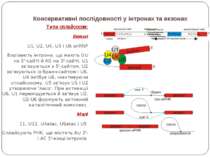
Консервативні послідовності у інтронах та екзонах Типи сплайсосом: Великі U1, U2, U4, U5 і U6 snRNP Вирізають інтрони, що мають GU на 5'-сайті й AG на 3'-сайті. U1 зв'язуються з 5'-сайтом, U2 зв'язуються із бранч-сайтом і U6. U4 інгібує U6, інактивуючи сплайсосому. U5 зв'язує U1 і U2 утворюючи 'ласо'. При активації U6, U1 переміщується й зв'язує U2. U2-U6 формують активний каталітичний комплекс Малі 11, U12, U4atac, U6atac і U5 Сплайсують РНК, що містять AU 3'- і AC 5'-кінці інтронів
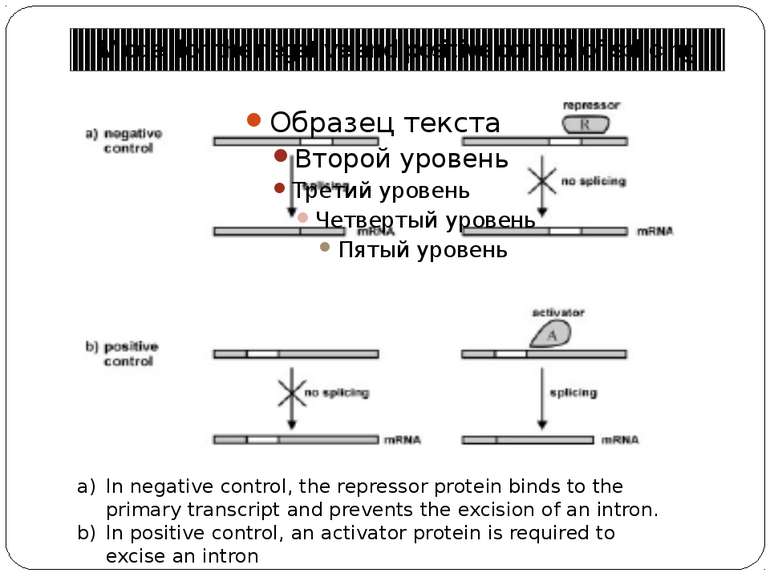
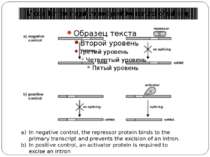
Model for the negative and positive control of splicing In negative control, the repressor protein binds to the primary transcript and prevents the excision of an intron. In positive control, an activator protein is required to excise an intron
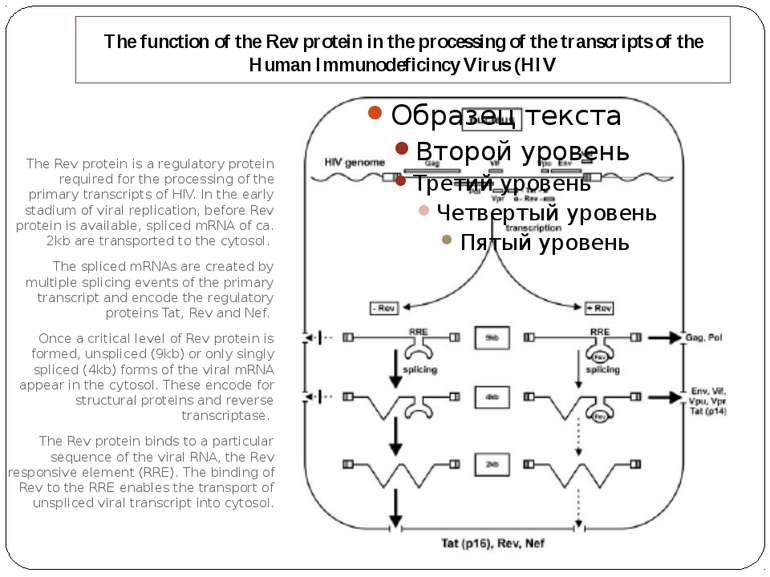
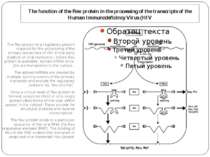
The function of the Rev protein in the processing of the transcripts of the Human Immunodeficincy Virus (HIV The Rev protein is a regulatory protein required for the processing of the primary transcripts of HIV. In the early stadium of viral replication, before Rev protein is available, spliced mRNA of ca. 2kb are transported to the cytosol. The spliced mRNAs are created by multiple splicing events of the primary transcript and encode the regulatory proteins Tat, Rev and Nef. Once a critical level of Rev protein is formed, unspliced (9kb) or only singly spliced (4kb) forms of the viral mRNA appear in the cytosol. These encode for structural proteins and reverse transcriptase. The Rev protein binds to a particular sequence of the viral RNA, the Rev responsive element (RRE). The binding of Rev to the RRE enables the transport of unspliced viral transcript into cytosol.
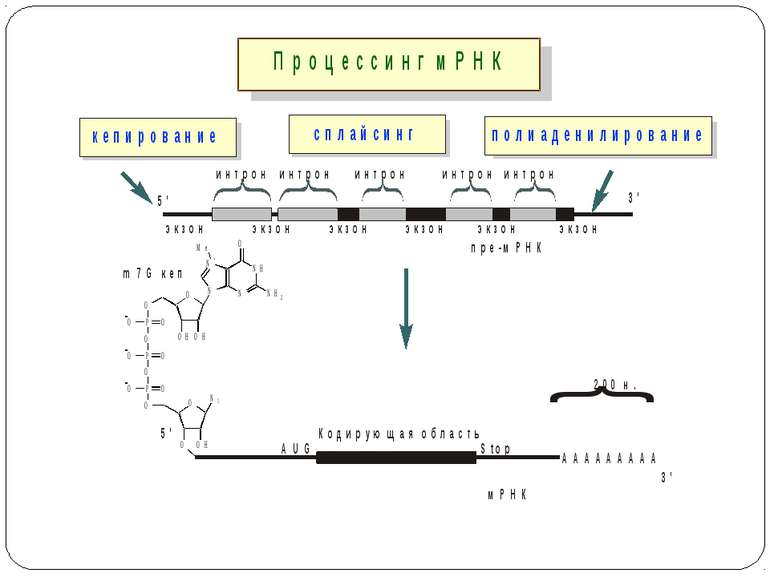
Поліаденілювання Прокаріоти Еукаріоти Сприяє деградації мРНК, створюючи одноланцюгову “площадку” для посадки екзонуклеаз Захист від деградації
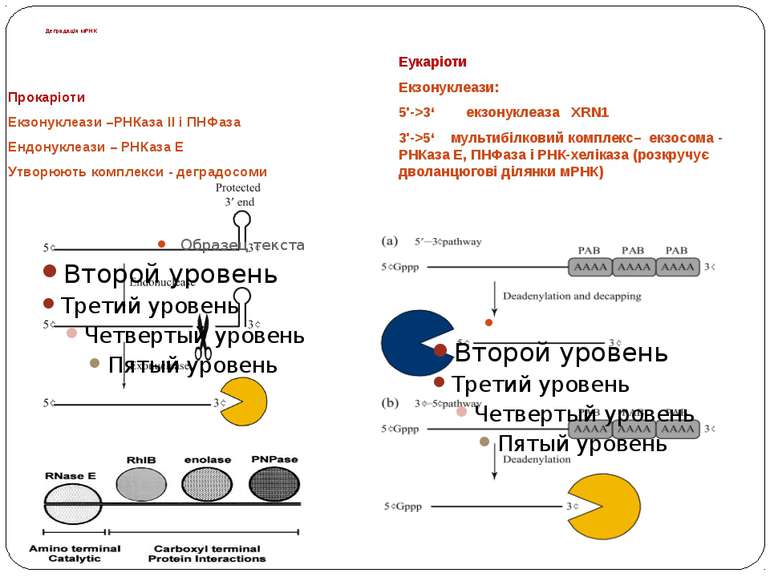
Деградація мРНК Прокаріоти Екзонуклеази –РНКаза ІІ і ПНФаза Ендонуклеази – РНКаза Е Утворюють комплекси - деградосоми Еукаріоти Екзонуклеази: 5'->3‘ екзонуклеаза XRN1 3'->5‘ мультибілковий комплекс– екзосома - РНКаза Е, ПНФаза і РНК-хеліказа (розкручує дволанцюгові ділянки мРНК)
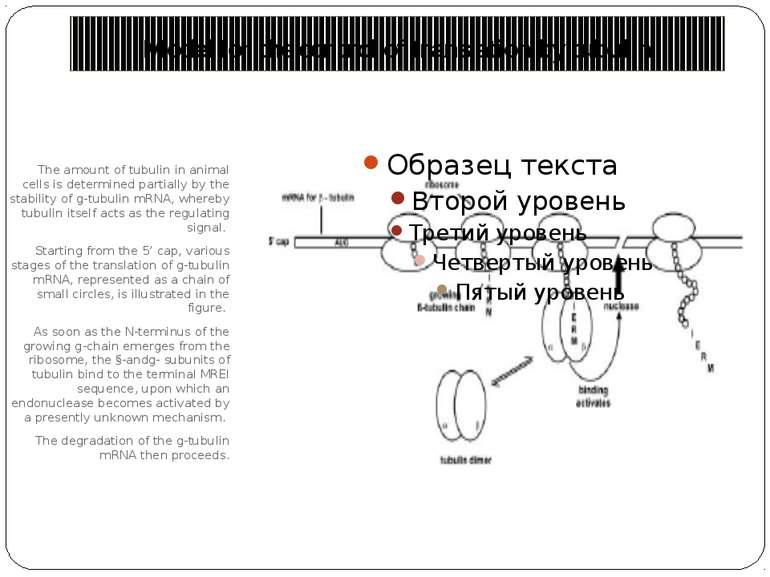
Model for the control of translation by tubulin The amount of tubulin in animal cells is determined partially by the stability of g-tubulin mRNA, whereby tubulin itself acts as the regulating signal. Starting from the 5’ cap, various stages of the translation of g-tubulin mRNA, represented as a chain of small circles, is illustrated in the figure. As soon as the N-terminus of the growing g-chain emerges from the ribosome, the §-andg- subunits of tubulin bind to the terminal MREI sequence, upon which an endonuclease becomes activated by a presently unknown mechanism. The degradation of the g-tubulin mRNA then proceeds.
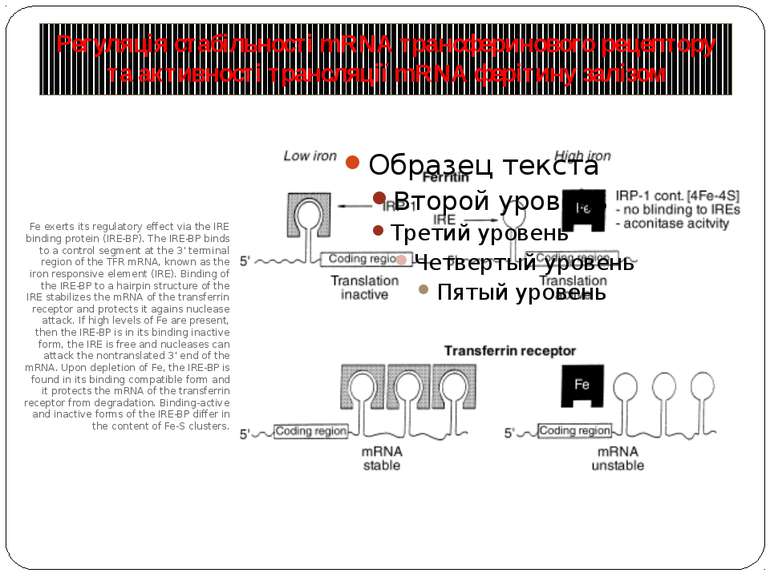
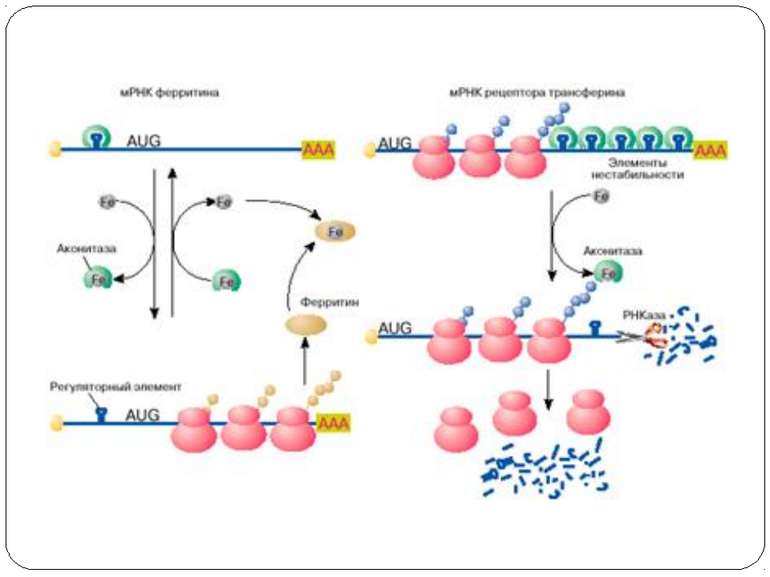
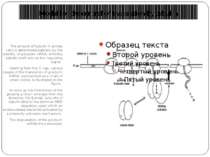
Регуляція стабільності mRNA трансферинового рецептору та активності трансляції mRNA ферітину залізом Fe exerts its regulatory effect via the IRE binding protein (IRE-BP). The IRE-BP binds to a control segment at the 3’ terminal region of the TFR mRNA, known as the iron responsive element (IRE). Binding of the IRE-BP to a hairpin structure of the IRE stabilizes the mRNA of the transferrin receptor and protects it agains nuclease attack. If high levels of Fe are present, then the IRE-BP is in its binding inactive form, the IRE is free and nucleases can attack the nontranslated 3’ end of the mRNA. Upon depletion of Fe, the IRE-BP is found in its binding compatible form and it protects the mRNA of the transferrin receptor from degradation. Binding-active and inactive forms of the IRE-BP differ in the content of Fe-S clusters.
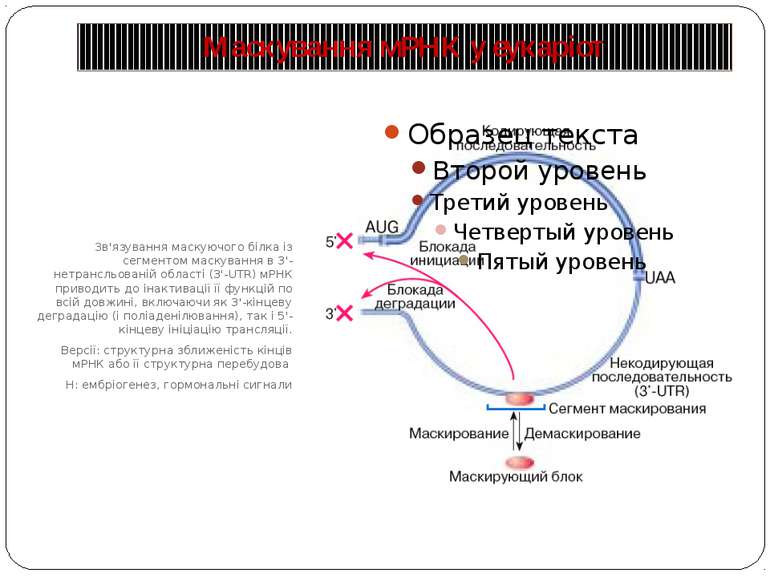
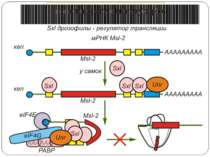
Маскування мРНК у еукаріот Зв'язування маскуючого білка із сегментом маскування в 3'-нетрансльованій області (3'-UTR) мРНК приводить до інактивації її функцій по всій довжині, включаючи як 3'-кінцеву деградацію (і поліаденілювання), так і 5'-кінцеву ініціацію трансляції. Версії: структурна зближеність кінців мРНК або її структурна перебудова Н: ембріогенез, гормональні сигнали
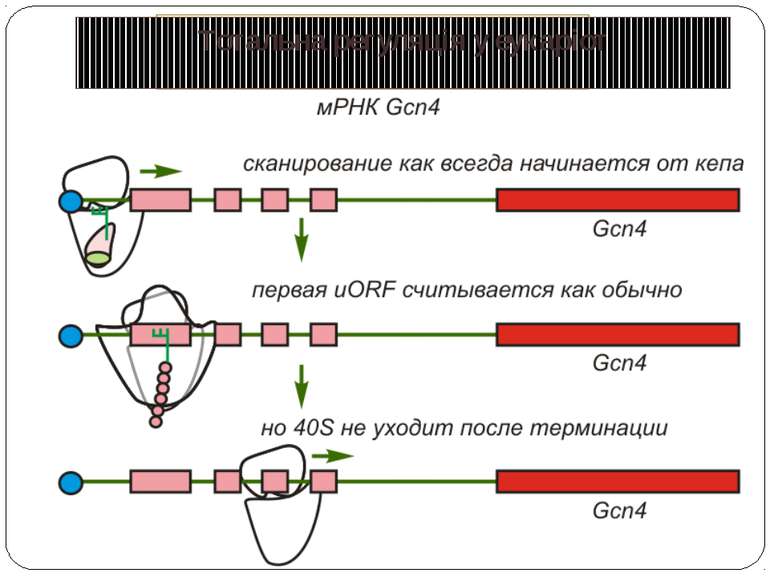
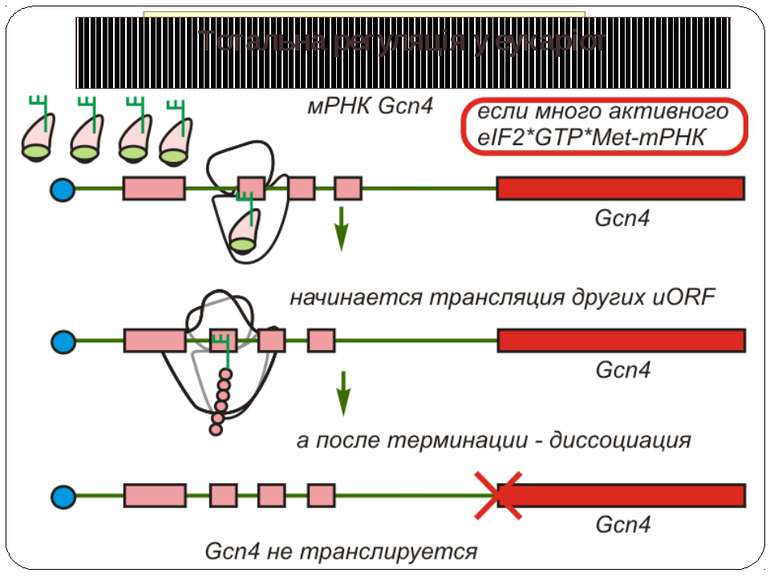
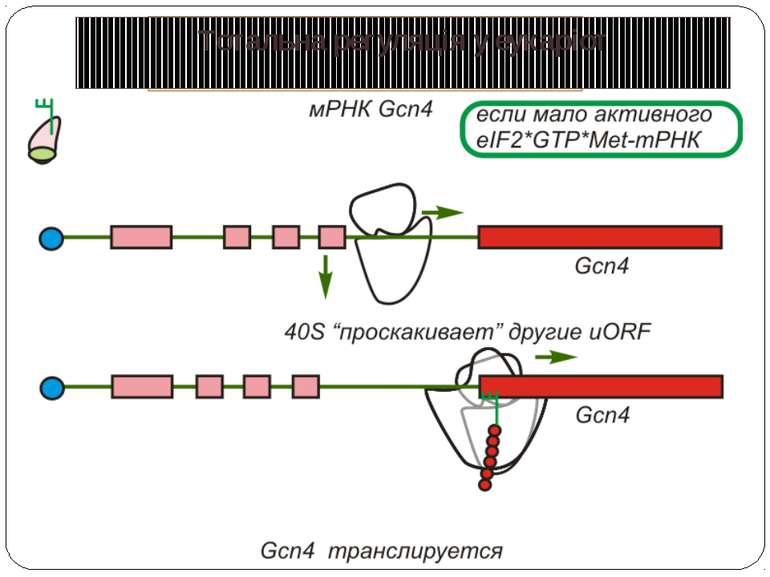
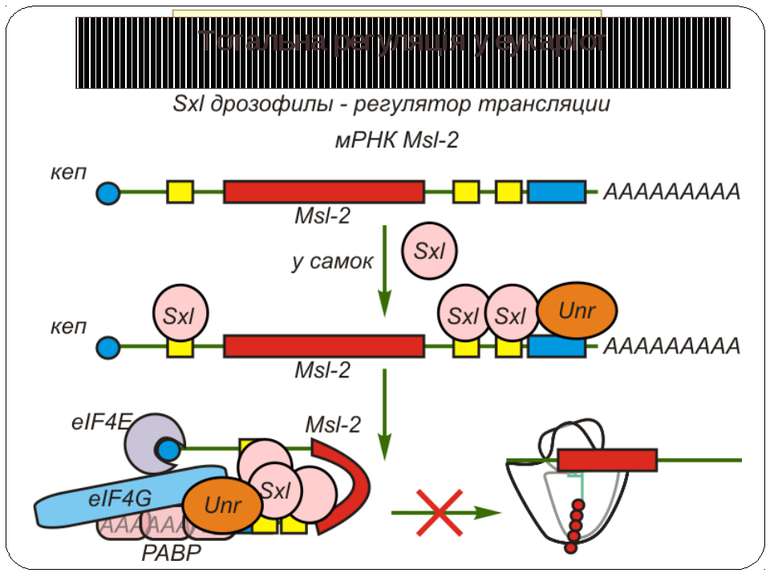
Тотальна регуляція трансляції усієї сукупності мРНК Модифікація факторів трансляції Білок p50 як регулятор трансляції Короткі ОРС як регулятори трансляції
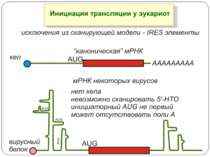
eIF4E Фактор eIF4E розпізнає кеп-структури мРНК в складі багатокомпонентного фактору ініціації eIF4F , що є необхідним етапом об’єднання мРНК з 40S субодиницею рибосоми. Фактор eIF4E лімітує ініціацію трансляції.
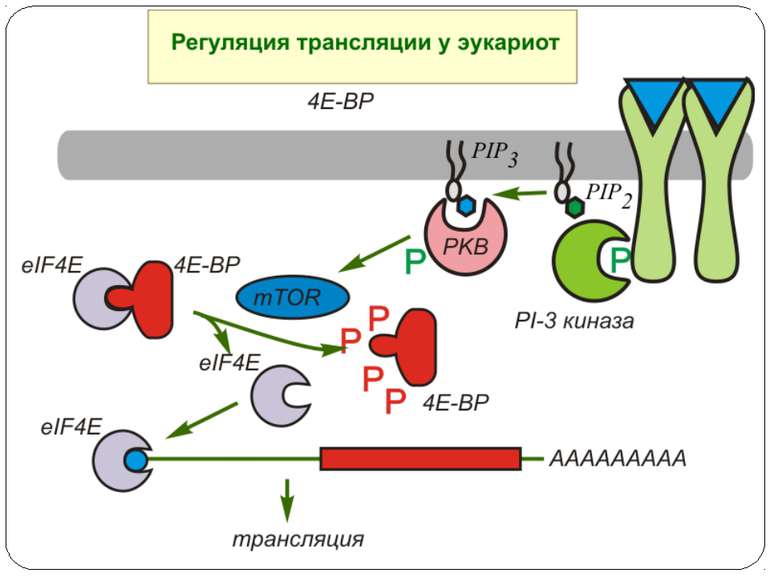
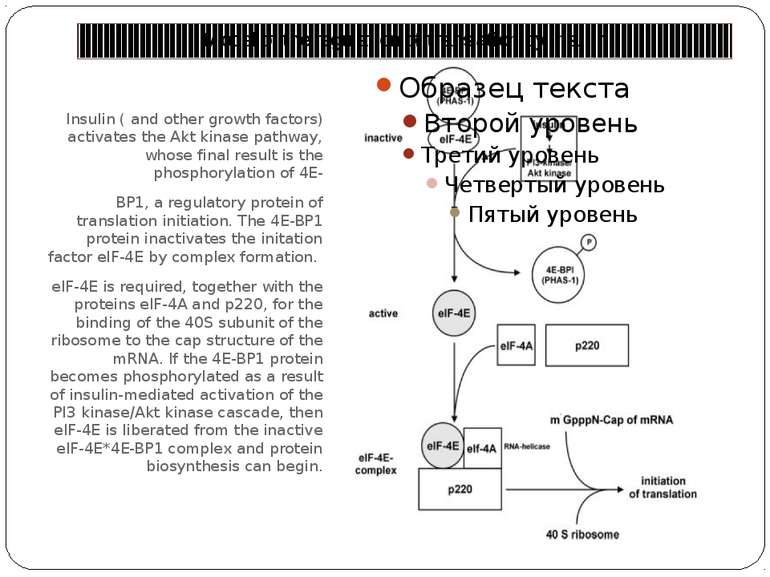
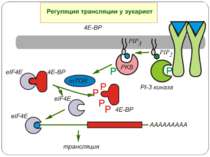
Model of the regulation of translation by insulin Insulin ( and other growth factors) activates the Akt kinase pathway, whose final result is the phosphorylation of 4E- BP1, a regulatory protein of translation initiation. The 4E-BP1 protein inactivates the initation factor eIF-4E by complex formation. eIF-4E is required, together with the proteins eIF-4A and p220, for the binding of the 40S subunit of the ribosome to the cap structure of the mRNA. If the 4E-BP1 protein becomes phosphorylated as a result of insulin-mediated activation of the PI3 kinase/Akt kinase cascade, then eIF-4E is liberated from the inactive eIF-4E*4E-BP1 complex and protein biosynthesis can begin.
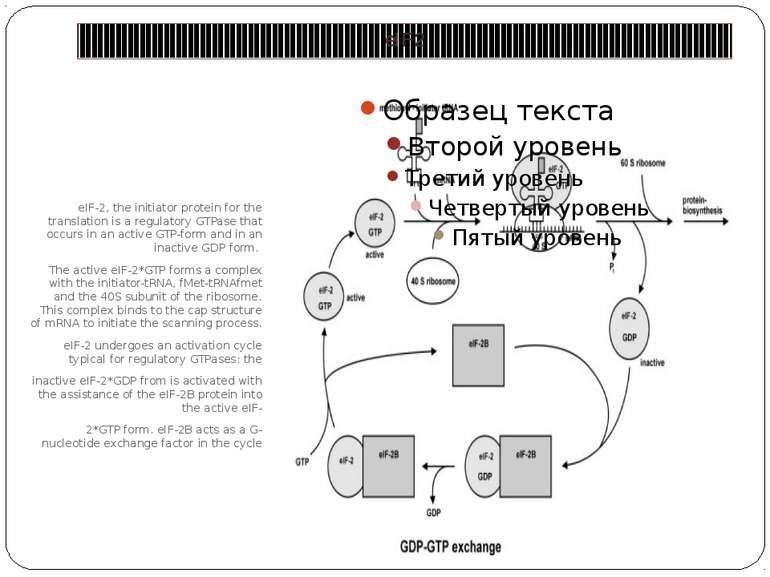
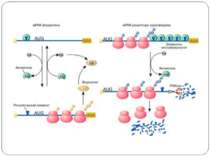
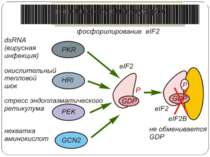
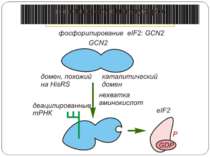
eIF2 eIF-2, the initiator protein for the translation is a regulatory GTPase that occurs in an active GTP-form and in an inactive GDP form. The active eIF-2*GTP forms a complex with the initiator-tRNA, fMet-tRNAfmet and the 40S subunit of the ribosome. This complex binds to the cap structure of mRNA to initiate the scanning process. eIF-2 undergoes an activation cycle typical for regulatory GTPases: the inactive eIF-2*GDP from is activated with the assistance of the eIF-2B protein into the active eIF- 2*GTP form. eIF-2B acts as a G-nucleotide exchange factor in the cycle
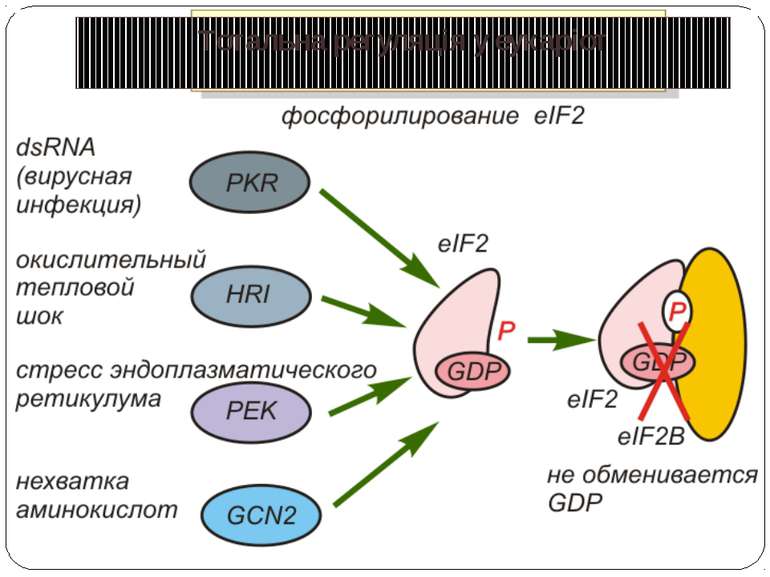
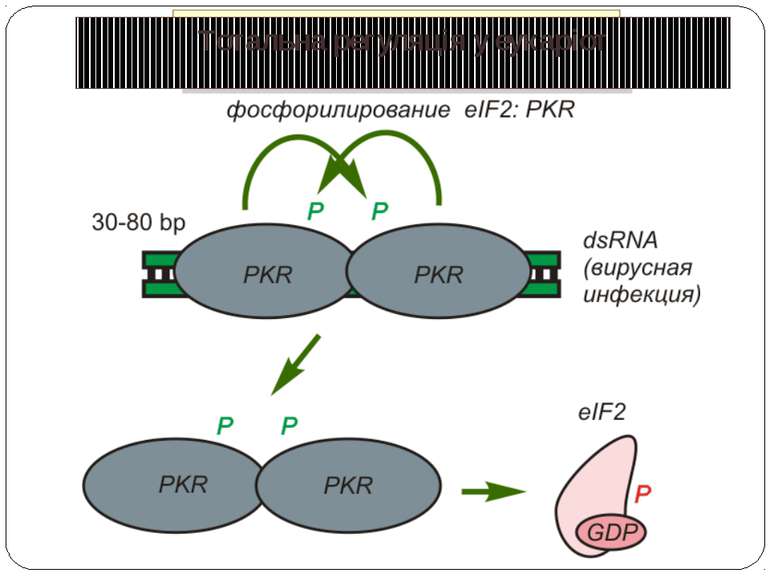
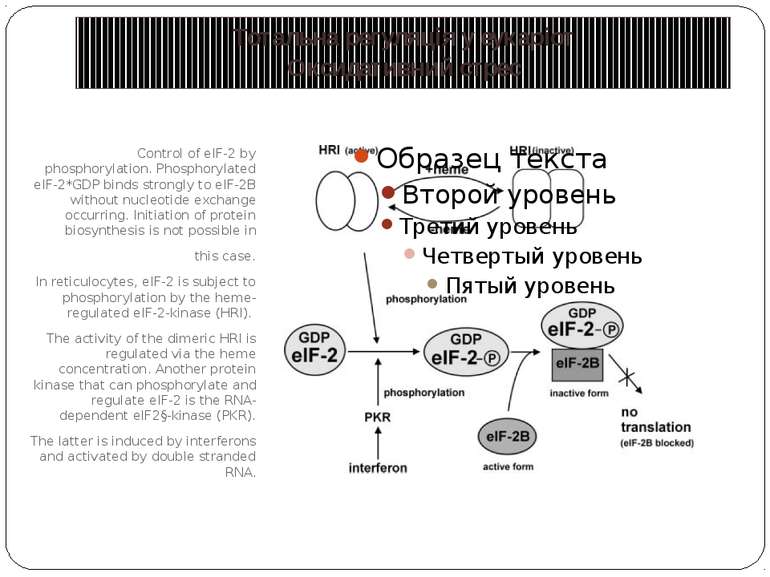
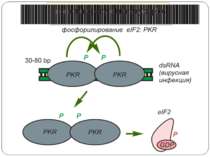
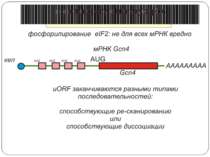
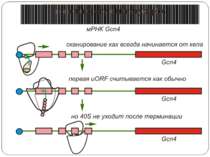
Control of eIF-2 by phosphorylation. Phosphorylated eIF-2*GDP binds strongly to eIF-2B without nucleotide exchange occurring. Initiation of protein biosynthesis is not possible in this case. In reticulocytes, eIF-2 is subject to phosphorylation by the heme-regulated eIF-2-kinase (HRI). The activity of the dimeric HRI is regulated via the heme concentration. Another protein kinase that can phosphorylate and regulate eIF-2 is the RNA-dependent eIF2§-kinase (PKR). The latter is induced by interferons and activated by double stranded RNA. Тотальна регуляція у еукаріот Оксидативний стрес
Білок p50 як регулятор трансляції На відміну від білка PABP , переважно асоційованого з функціонуючими полісомами , білок p50 є основным компонентом як неактивних, так і акивних мРНП, які беруть участь в синтезі білка. Білок p50 ретикулоцитів кролів виявляє до 98% гомології з факторами транскрипції тварин, які взаємодіють з Y-боксом (цис-регуляторною послідовністю ДНК CTATTGGC/TC/TAA). Фактори цієї родини переважно зв’язують одноланцюгову і апуринізовану ДНК, трьохланцюгову H-ДНК і РНК. Білок p50 може виступати як інгібітор і як активатор біосинтезу білка. При високому відношенні p50/мРНК (5-10 молекул білка на молекулу мРНК) відбувається інгібування трансляції, при низькому (до 4-х молекул p50 на молекулу мРНК) - активація. Можливо, при високих концентраціях білка відбувається вивільнення його С-кінцевих частин від контактів з РНК, що приводить до мультимеризації білка і переходу мРНП в конденсований стан. Білок p50 виступает в якості фактору трансляції в полісомах, що активно синтезують білок. Вважають, що в цьому випадку він може полегшувати ініціацію трансляції, запобігаючи неспецифічній взаємодії мРНК з факторами трансляції, а також забезпечуючи формування у мРНК оптимальної просторової структуры. Оскільки в p50 виявлено РНК- розплітаюча активність, він може сприяти скануванню 5'UTR мРНК преініціюючим комплексом.
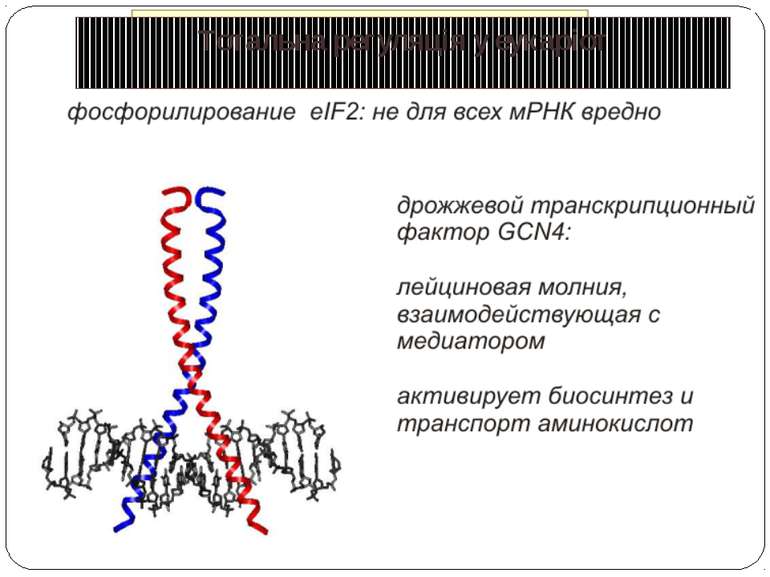
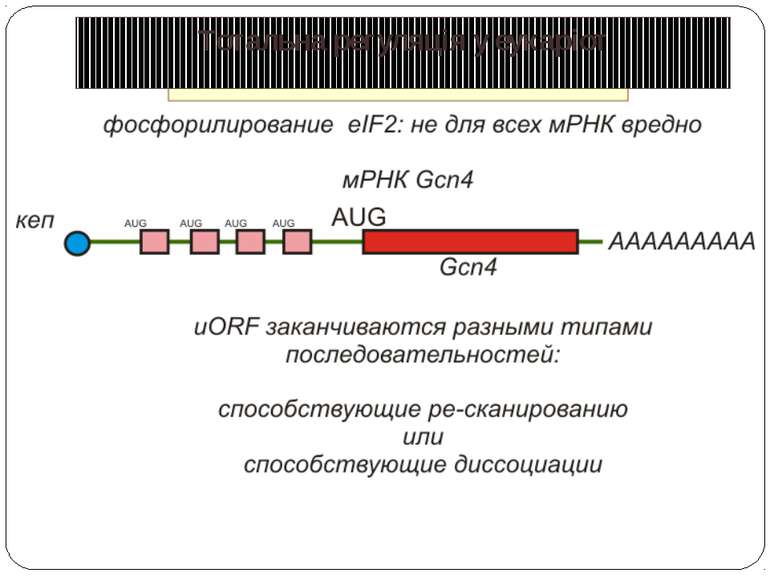
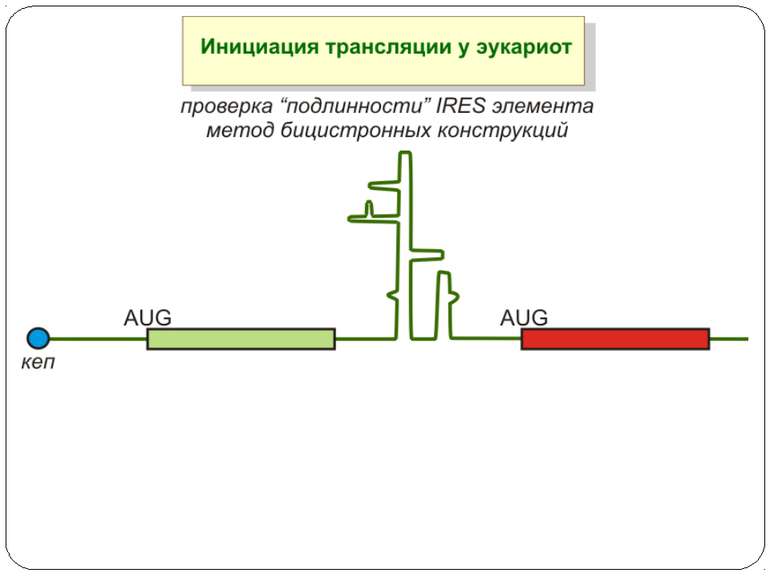
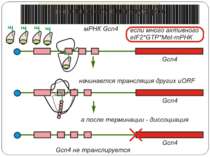
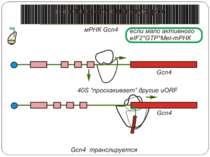
Короткі ОРС как регулятори трансляції Близько 10% мРНК рослин містять в своїх 5'-кінцевих лідерних послідовностях більш за один AUG-кодон. Деякі з них видаляються за допомогою альтернативного сплайсингу. Інші виникають в результаті використання РНК-полімеразами альтернативних промоторів при ініціації транскрипції відповідних генів. Присутність коротких ОРС в лідерних послідовностях мРНК, як правило, супроводжується зниженням ефективності трансляції таких матриць. Функціонування цього механізму виявлене в клітинах ссавців, рослин і дріжджів. Вплив коротких ОРС на трансляцію розташованих нижче послідовностей нуклеотидів мРНК досліджений з використанням штучних генно-інженерних конструкцій, у яких змінювали довжину й число потенційних сайтів ініціації трансляції, що передували генам-репортерам. Виявилося, що інгібуючий вплив коротких ОРС зростає зі збільшенням їх довжини. Навіть одиночний AUG- кодон знижує рівень трансляції нижче розташованих послідовностей у два рази. Короткі ОРС проміжної довжини (близько 30 кодонів) інгібували рівень трансляції в 5 разів, а протяжні ОРС (>100 кодонів) повністю пригнічували трансляцію наступних за ними послідовностей. Механізм інгібуючої дії коротких ОРС пов'язаний з тим, що вони транслюються, що знижує ймовірність ініціації трансляції на ініціюючих кодонах, розташованих слідом за ними, оскільки процес реініціації трансляції вимагає надходження нових факторів ініціації трансляції в ініціаторний комплекс.
eIF4E: регуляция биосинтеза на уровне транскрипции В ответ на действие сыворотки или факторов роста происходит многократное возрастание внутриклеточного содержания eIF4E-мРНК. Промотор гена этого фактора содержит два сайта связывания фактора транскрипции Myc , которые функционируют в искусственных гибридных генах. Повышенный уровень экспрессии гена c-myc сопровождается возрастанием внутриклеточного содержания eIF4E-мРНК. Известно, что белок Myc участвует в регуляции пролиферации клеток. Поскольку фактор eIF4E сам по себе является ключевым регулятором роста и деления клеток, полагают, что его ген может быть одной из основных мишеней регуляторного воздействия белка Myc.
eIF4E: регулируемое фосфорилирование Фосфорилированное состояние полипептидной цепи фактора eIF4E коррелирует с повышенной скоростью трансляции. В митозе, характеризуемом низкой скоростью трансляции, уровень фосфорилирования eIF4E минимален. Количество фосфорилированных молекул возрастает в ответ на внеклеточные воздействия гормонами, факторами роста, митогенами и цитокинами, а также в условиях повышенной нагрузки на сердце. У млекопитающих в ответ на стимулы фосфорилирование полипептидной цепи происходит в основном в положении S209 (нумерация по полипептиду мышей). Остаток Thr в положении 210 фосфорилируется значительно реже. В клетках, трансформированных онкогенами ras и src , наблюдается усиление фосфорилирования eIF4E, поэтому полагают, что в этом процессе участвуют MAP(ERK)-киназы (MAPK/ERK). Это участие может быть косвенным, так как в системах in vitro киназы ERK не обладают способностью фосфорилировать eIF4E. Показано, что общим субстратом протеинкиназ p38MAPK и ERK является протеинкиназа фактора eIF4E, названная MNK1 (MAP kinase interacting kinase 1), которая в активном состоянии фосфорилирована. Поскольку MNK1 эффективно и специфически фосфорилирует фактор eIF4E in vitro по остатку Ser в положении 209, ее рассматривают в качестве основного кандидата, модифицирующего этот фактор в живой клетке, после активации каскадов реакций с участием киназ ERK и p38 MAPK.
eIF4E: семейство белков-репрессоров 4EBP Обнаружены небольшие белки (молекулярная масса около 12 кДа), названные 4E-BP (eIF4E-binding proteins ), 4E-BP1 , 4E-BP2 и 4E-BP3, ингибирующие кэп-зависимую трансляцию после прямого взаимодействия с eIF4E. Образование комплекса eIF4E-4E-BP не изменяет сродство фактора к кэп-структуре, однако предотвращает его взаимодействие с eIF4G. Белки-ингибиторы 1, 2 и фактор eIF4G обладают гомологичной последовательностью аминокислот YXXXXLA, где X - любая аминокислота, а A-алифатический аминокислотный остаток. Сродство ингибиторов семейства 4E-BP к фактору eIF4E регулируется через их фосфорилирование. Ингибитор 4E-BP1 был вначале идентифицирован как основной полипептид, фосфорилируемый под действием инсулина. Фосфорилирование полипептидных цепей ингибиторов предотвращает образование белок-белковых комплексов и происходит в присутствии гормонов ( инсулин, ангиотензин, гастрин ), факторов роста ( EGF , PDGF , NGF , IGFI , IGFII ), цитокинов ( IL-3, GMCSF ), митогенов ( TPA ) и во время аденовирусной инфекции. В то же время в клетках некоторых типов тепловой шок и полиовирусная инфекция сопровождаются снижением уровней фосфорилирования ингибиторов. Все это указывает на прямое участие ингибиторов 4E-BP в регуляции трансляции у эукариот через взаимодействие с фактором eIF4E. По крайней мере, ингибиторы 4E-BP1 и 4E-BP2 являются субстратами протеинкиназы FRAP/mTOR - очень большого белка, принадлежащего к семейству киназ PIK, киназам фосфатидилинозитола. Каскад реакций, завершающихся фосфорилированием этой киназы и, в конечном счете, белковых ингибиторов трансляции, запускается в ответ на внеклеточные стимулы киназой PIK3, фосфорилирующей OH- группу фосфоинозитида в положении 3.
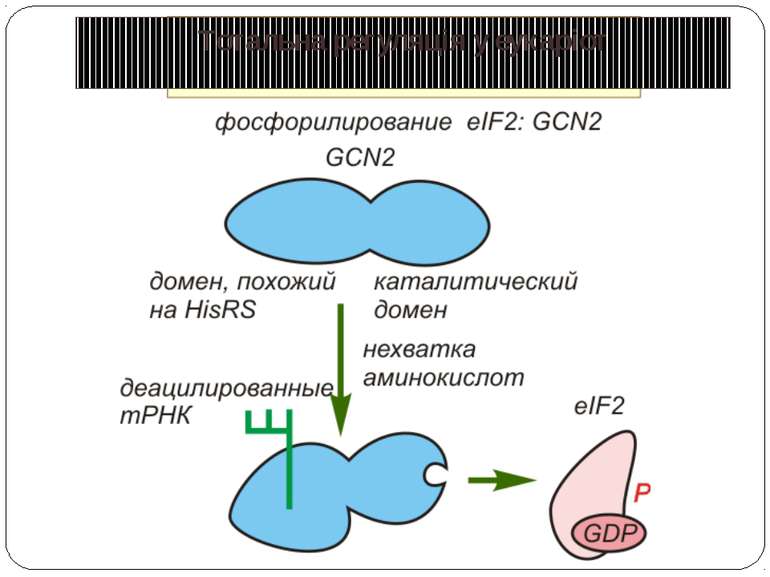
eIF2 Фактор eIF2 представляет собой гетеротримерный белковый комплекс. Его альфа-субъединица фосфорилируется тремя киназами эукариот: у животных - HRI и PKR, а у дрожжей - GCN2. Фосфорилирование фактора предотвращает обмен GDP на GTP, опосредованный фактором eIF2B, и ингибирует трансляцию. Поскольку фосфорилированная форма eIF2 обладает повышенным сродством к eIF2B, последний становится эффективным конкурентным ингибитором формирования активного комплекса eIF2-GTP-Met-тРНКi. Примером изменения эффективности трансляции мРНК через фосфорилирование фактора инициации eIF2 является механизм контроля биосинтеза гемоглобина под действием гема. Трансляция глобиновой мРНК в бесклеточной системе биосинтеза белка из ретикулоцитов кроликов в отсутствие гемина (окисленной формы гема) сопровождается быстрым прекращением включения аминокислот в растущие полипептидные цепи, т.е. остановкой трансляции. Оказалось, что в отсутствие гемина специфическая протеинкиназа фосфорилирует фактор инициации трансляции eIF2, который в фосфорилированном состоянии прочно взаимодействует с фактором инициации eIF2B и в составе комплекса остается в связанном с рибосомами состоянии. В результате трансляция глобиновой мРНК останавливается. Гемин, находящийся в избытке в системе трансляции, взаимодействует с протеинкиназой и инактивирует ее. Протеинкиназа утрачивает способность фосфорилировать фактор eIF2 и блокировать трансляцию. Координация синтеза глобинов на уровне трансляции происходит и в других случаях. В диплоидной клетке человека имеются четыре активных альфа-глобиновых и два экспрессирующихся бета-глобиновых гена. Правильная сборка молекул гемоглобина предполагает участие эквимолярных количеств полипептидных цепей альфа- и бета-глобина, поэтому необходима координация биосинтеза этих белков, которая осуществляется на уровне инициации трансляции. Альфа-глобиновая мРНК конкурирует с бета-глобиновой мРНК за факторы инициации трансляции, однако бета-глобиновая мРНК обладает большим сродством к факторам, что приводит к более высокой эффективности ее трансляции по сравнению с альфа-глобиновой мРНК. В качестве фактора инициации трансляции, ответственного за предпочтительную трансляцию бета-глобиновой мРНК, выступает кэп-связывающий белок.
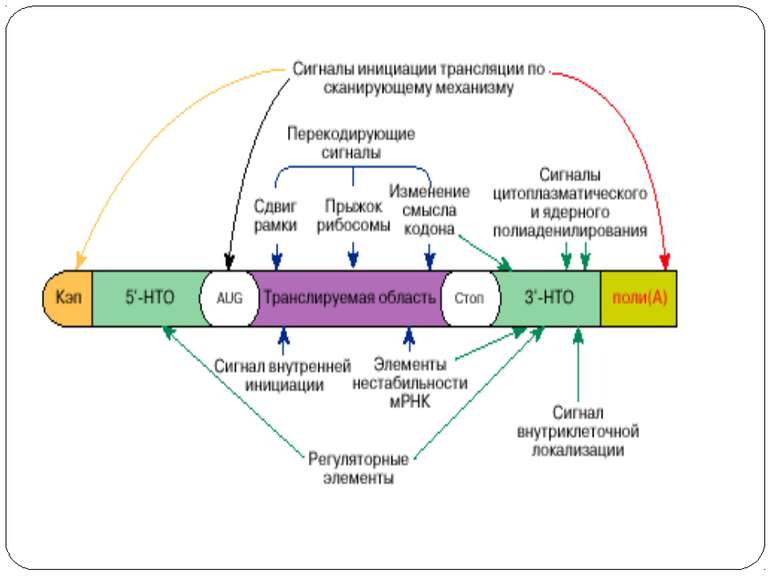
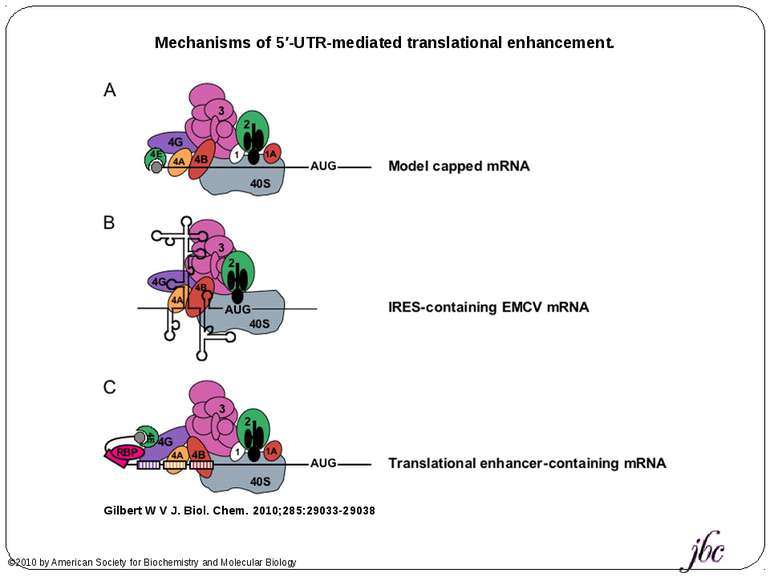
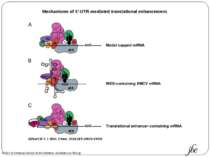
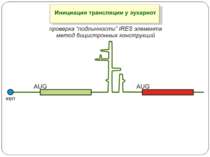
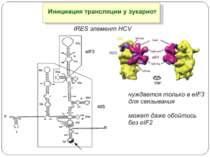
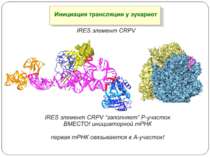
Mechanisms of 5′-UTR-mediated translational enhancement. Gilbert W V J. Biol. Chem. 2010;285:29033-29038 ©2010 by American Society for Biochemistry and Molecular Biology Mechanisms of 5′-UTR-mediated translational enhancement. A, according to the canonical model of cap-dependent eukaryotic ribosome recruitment, the only specific point of contact between the 5′-UTR and the translation machinery is the m7G cap, which is bound by eIF4E. B, other eIFs, including eIF4G, eIF4A, and eIF4B, have RNA-binding activity, which viral IRESs such as EMCV exploit for efficient cap-independent ribosome recruitment. C, cellular 5′-UTRs may also use translational enhancer elements (shown as color-coded boxes along the RNA) to recruit the translation machinery via either cap-stimulated or cap-independent pathways. Sequence-specific RBPs can bridge interactions between 5′-UTR elements and general translation factors.
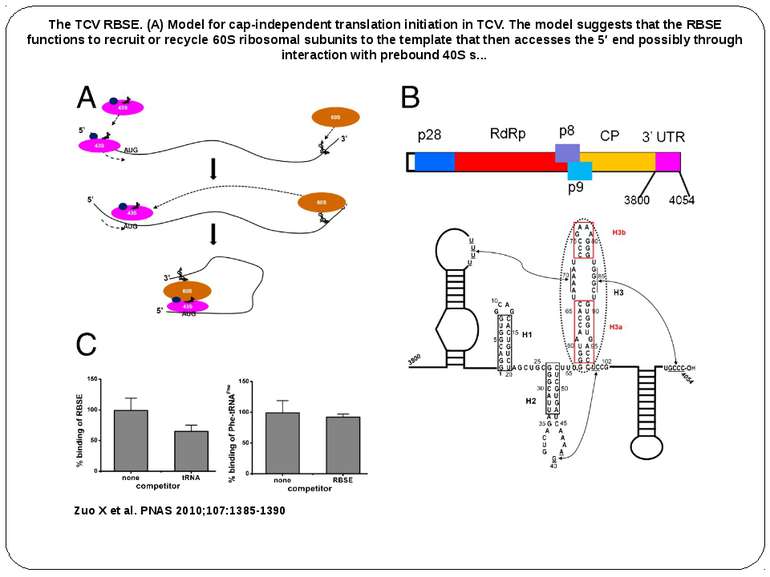
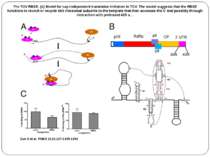
The TCV RBSE. (A) Model for cap-independent translation initiation in TCV. The model suggests that the RBSE functions to recruit or recycle 60S ribosomal subunits to the template that then accesses the 5′ end possibly through interaction with prebound 40S s... Zuo X et al. PNAS 2010;107:1385-1390 The TCV RBSE. (A) Model for cap-independent translation initiation in TCV. The model suggests that the RBSE functions to recruit or recycle 60S ribosomal subunits to the template that then accesses the 5′ end possibly through interaction with prebound 40S subunits. (B) Schematic drawing of the genome organization of TCV and the secondary structure of the RBSE. The secondary structure of RBSE was verified by imino-NOE walks of this construct and a number of mutants (see SI Text ). The hairpins are labeled as H1, H2 and H3, which consists of H3a, H3b and an internal loop (the nomenclature is simplified from previous nomenclature [(7) for this report]. The pseudoknot formed between the residues in the H2 loop and the residues at the 3′ end was previously determined (10). The cis-acting sequences, external to the RBSE on both the 5′ and 3′ ends of the TCV 3′ UTR are also shown. The italic numbers are those of the genome and smaller numbers are those for RBSE starting from position 1. (C) RBSE ribosome binding competition experiments. Deacylated tRNAphe can compete with binding of RBSE to the P site of yeast ribosomes (Left), and RBSE does not compete with acylated Phe-tRNAphe for binding to the A site of ribosomes (Right).
Схожі презентації
Категорії