Презентація на тему:
Применение методов флуоресцентной спектроскопии в биохимии
Завантажити презентацію
Применение методов флуоресцентной спектроскопии в биохимии
Завантажити презентаціюПрезентація по слайдам:
Применение методов флуоресцентной спектроскопии в биохимии зав.лаборатории оптических методов исследования Института биохимии им. А.В.Палладина НАН Украины канд.физ.-мат. наук Горчев В.Ф.
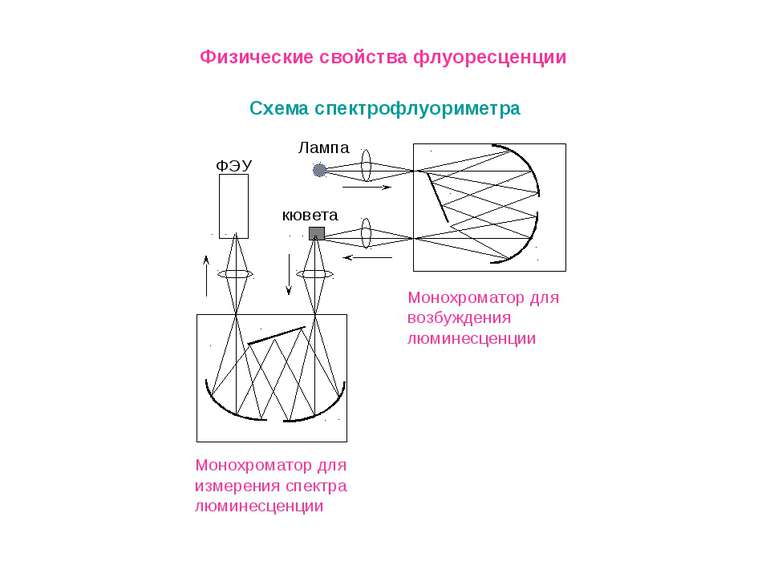
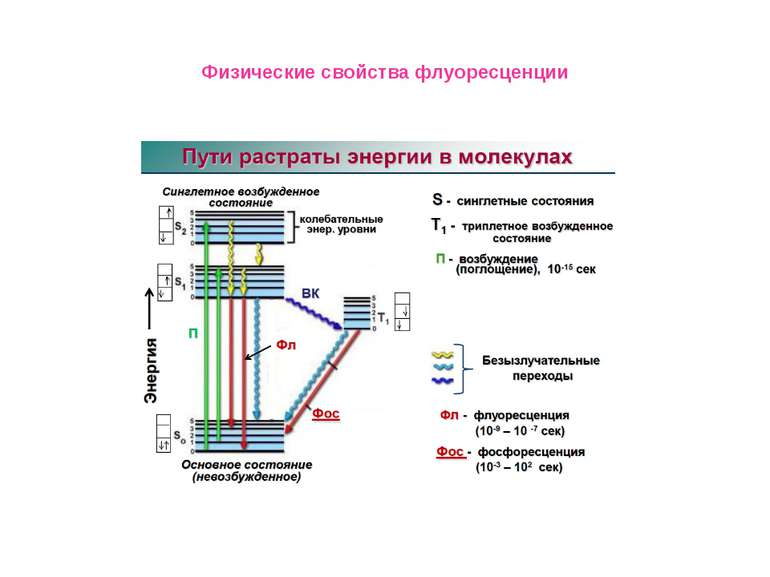
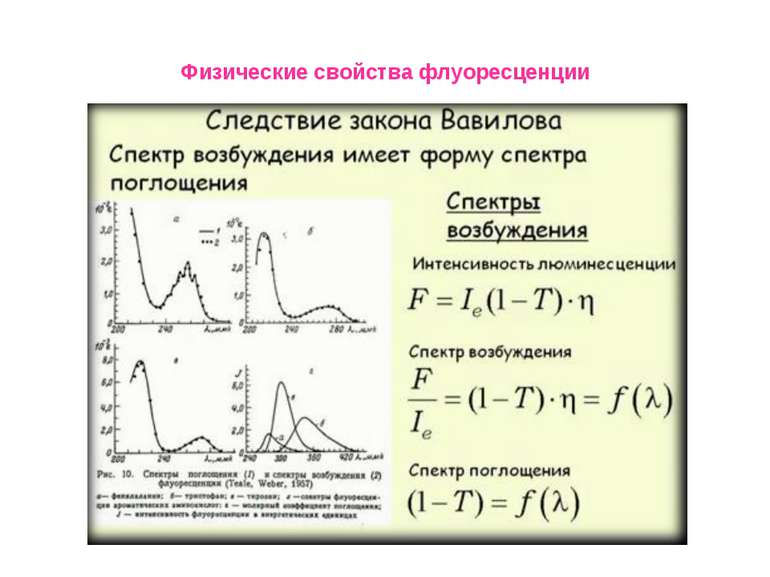
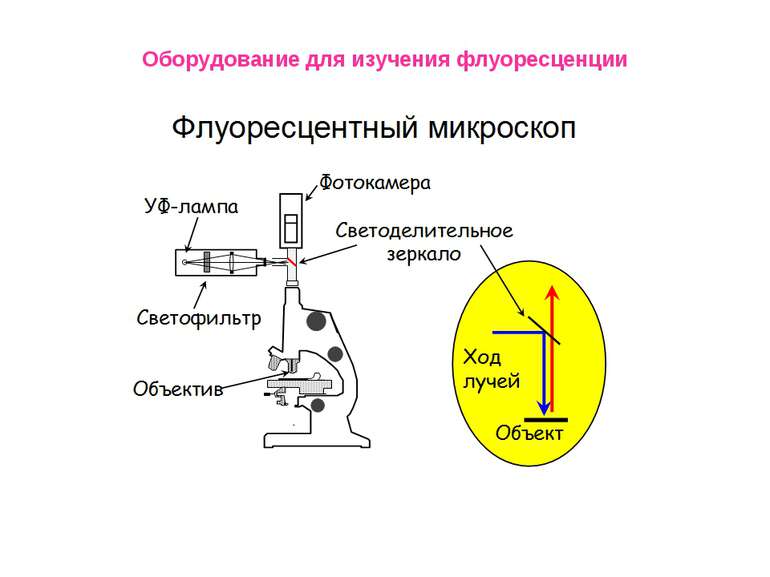
Физические свойства флуоресценции Флуоресцентный (люминесцентный) метод анализа Первое описание люминесценции как специфического свечения раствора оставил в 1577 г. испанский врач и ботаник Николас Монардес. В 1852 г. Стокс установил связь между интенсивностью люминесценции и концентрацией вещества. Он же предложил использовать флуоресценцию как метод химического анализа. Первый пример практического определения Al (III) по люминесценции его комплексов с морином опубликовал Гоппельшредер в 1867 г. Он же вел и термин «люминесцентный анализ». Это свойство – излучать свет при определенных условиях, оказалось удобным для решения задач, где приходится работать с малыми количествами вещества – порядка наномолей и меньше.
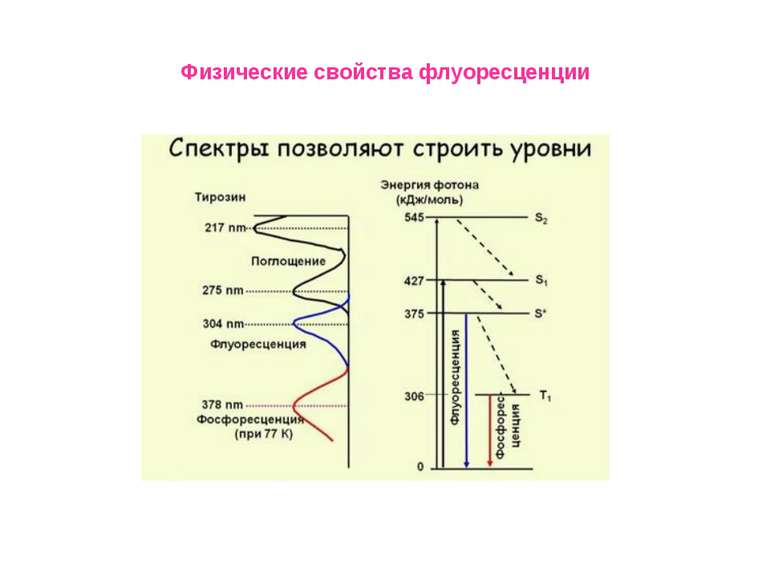
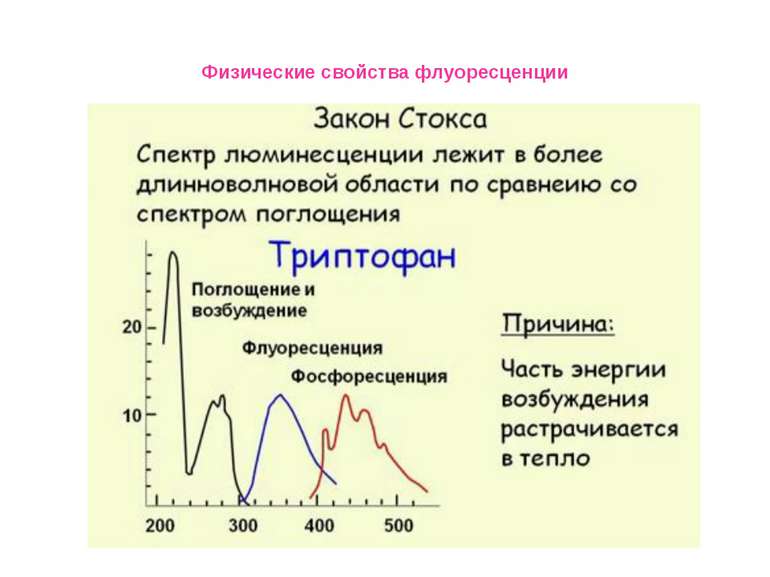
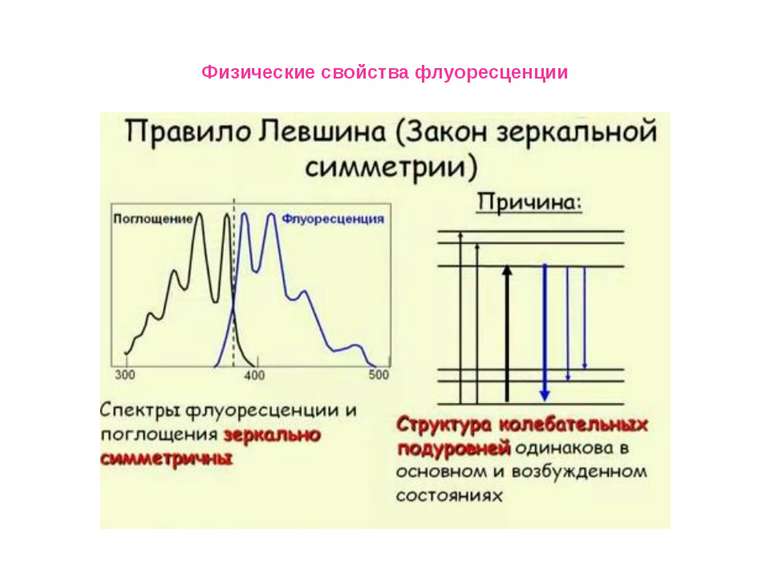
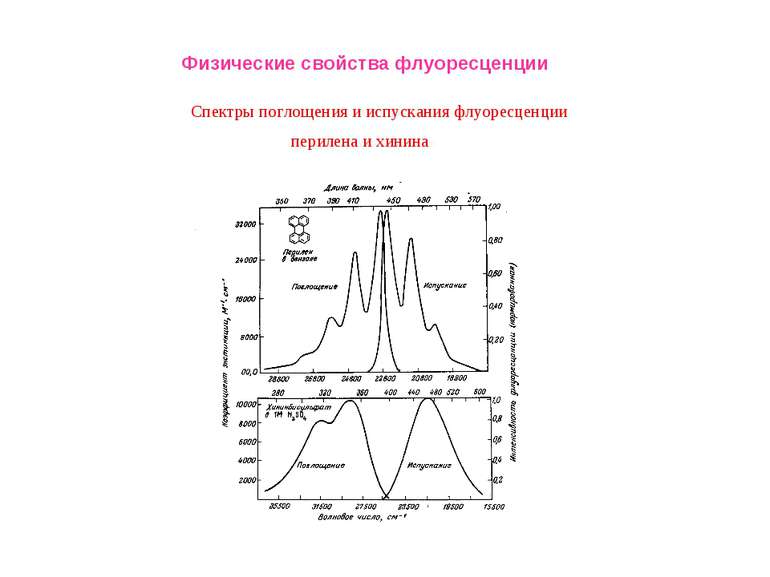
Физические свойства флуоресценции Влияние полярности окружения на положения максимумов в спектрах флуоресценции окружающей среды. Спектр испускания сдвигается в сторону коротких длин волн («голубой сдвиг») при уменьшении полярности; Увеличение полярности окружения приводит к смещению спектра испускания в длинноволновую область («красный сдвиг»). Красные сдвиги часто (но не всегда) сопровождаются уменьшением квантового выхода флуоресценции.
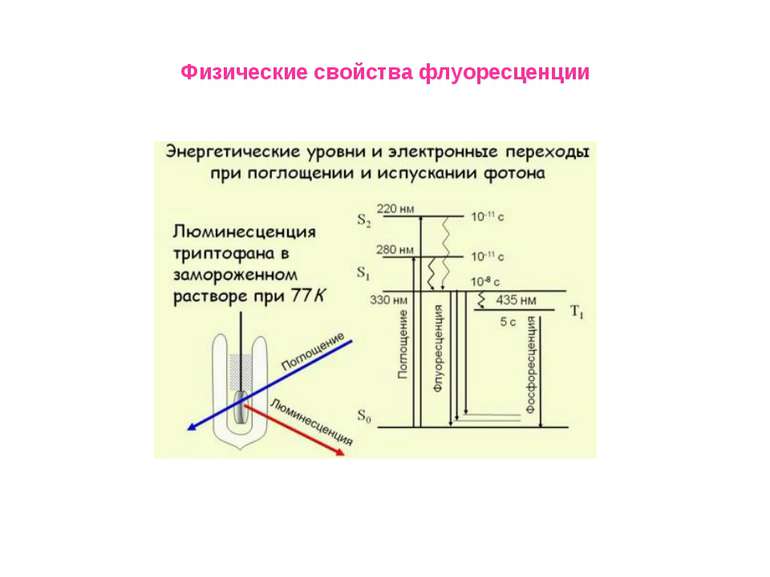
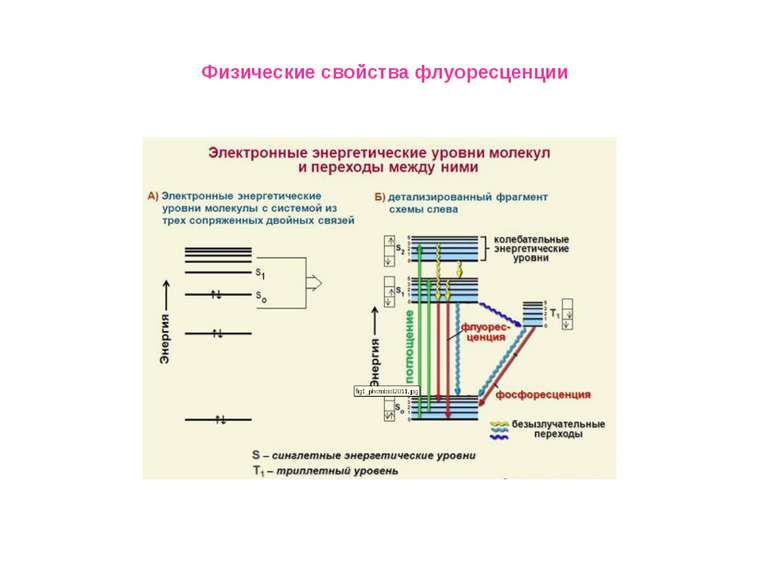
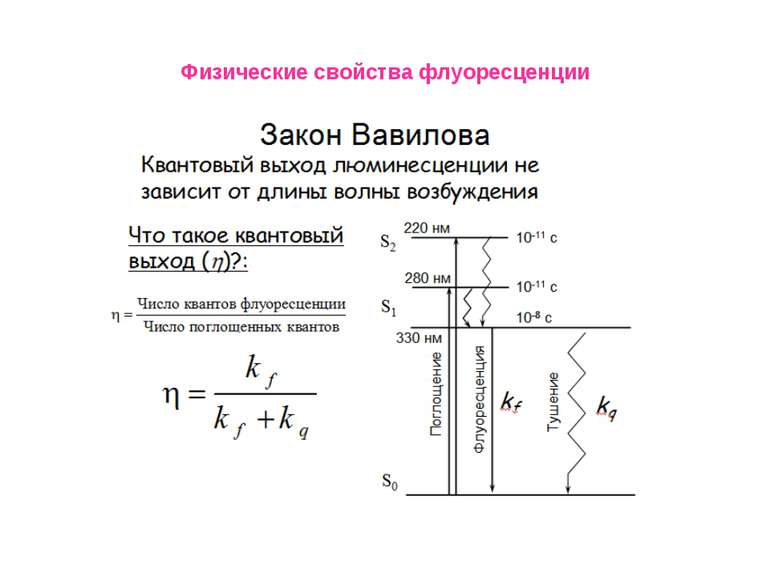
Физические свойства флуоресценции Измерение времен затухания флуоресценции Время затухания флуоресценции представляет собой промежуток времени, в течение которого система остается в возбужденном состоянии, прежде чем вернуться в основное состояние. Временной диапазон между поглощением света и последующим его испусканием достаточен для протекания нескольких процессов, каждый из которых приводит к ослаблению наблюдаемых спектральных характеристик флуоресценции. К таким процессам относятся:столкновения с тушителями, вращательная и поступательная диффузия Во флуоресцентной спектроскопии очень часто приходится измерять времена жизни, поскольку из таких данных можно найти частоту столкновений с молекулами тушителей, скорость переноса энергии и скорости реакций в возбужденных состояниях. , .
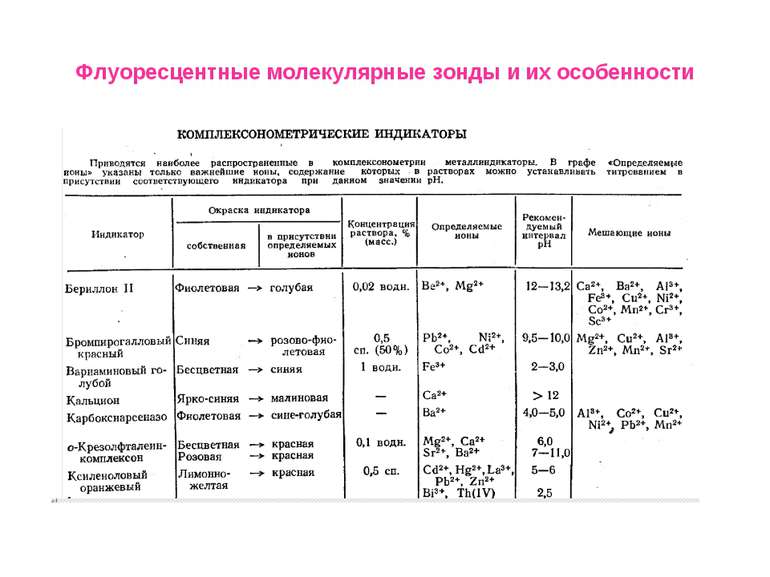
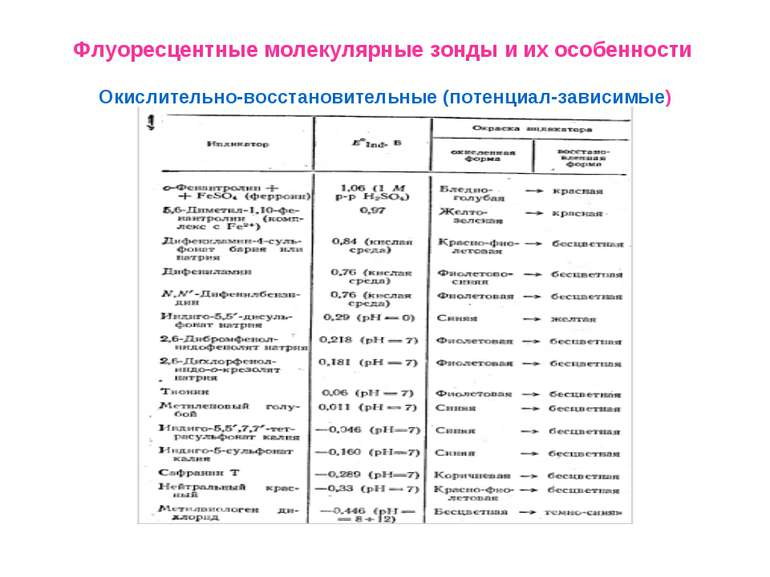
Флуоресцентные молекулярные зонды и их особенности Окислительно-восстановительные (потенциал-зависимые)
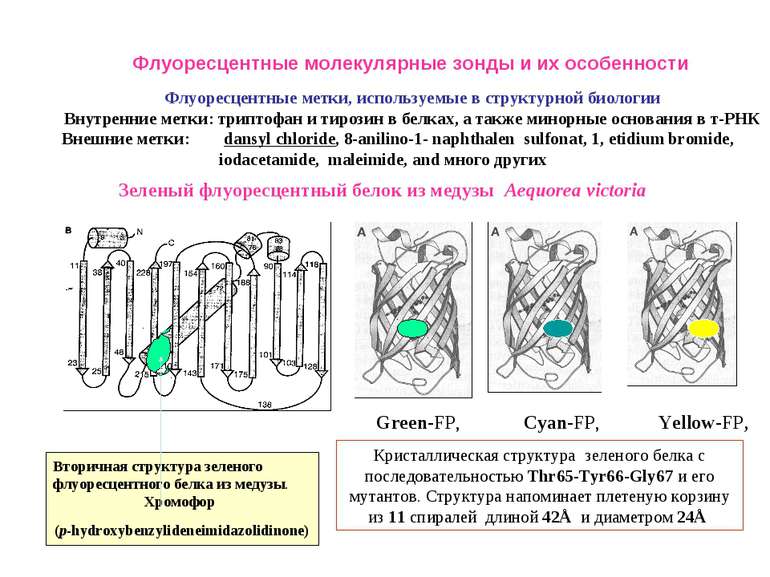
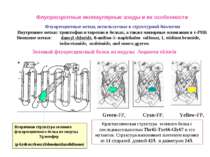
Флуоресцентные метки, используемые в структурной биологии Внутренние метки: триптофан и тирозин в белках, а также минорные основания в т-РНК Внешние метки: dansyl chloride, 8-anilino-1- naphthalen sulfonat, 1, etidium bromide, iodacetamide, maleimide, and много других Зеленый флуоресцентный белок из медузы Aequorea victoria Вторичная структура зеленого флуоресцентного белка из медузы. Хромофор (p-hydroxybenzylideneimidazolidinone) Green-FP, Cyan-FP, Yellow-FP, Кристаллическая структура зеленого белка с последовательностью Thr65-Tyr66-Gly67 и его мутантов. Структура напоминает плетеную корзину из 11 спиралей длиной 42Å и диаметром 24Å Флуоресцентные молекулярные зонды и их особенности
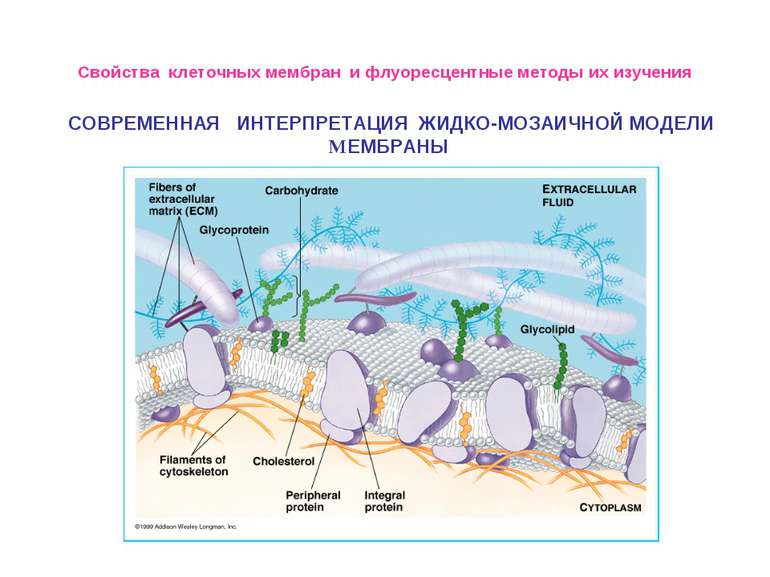
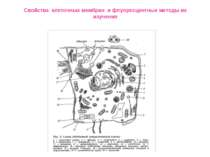
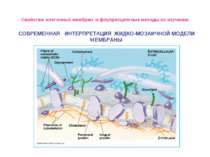
Свойства клеточных мембран и флуоресцентные методы их изучения СОВРЕМЕННАЯ ИНТЕРПРЕТАЦИЯ ЖИДКО-МОЗАИЧНОЙ МОДЕЛИ МЕМБРАНЫ
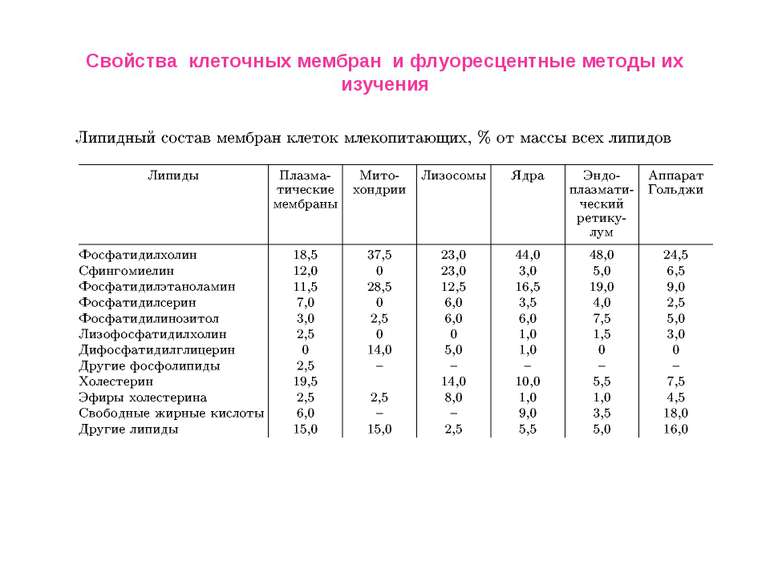
Свойства клеточных мембран и флуоресцентные методы их изучения Биологические мембраны состоят из нескольких молекулярных слоев, суммарная толщина которых обычно не превышает 10 нм. В состав биологических мембран входят липиды трех различных классов: фосфолипиды, гликолипиды и стероиды. Белки, входящие в состав мембран, как правило, гидрофобные глобулярные структуры, достаточно прочно связанные с мембра- нами за счет не только гидрофобных, но и электростатических взаимодействий. По степени влияния на структуру бислоя и силе взаимодействия с мембраной белки делятся на интегральные и периферические: первые пронизывают мембрану, их трудно выделить без разрушения целостности мембраны; вторые локализованы на поверхности липидного бислоя мембраны и легко экстрагируются Для БМ клетки характерно явление асимметрии, при котором распределение и состав липидов на цитоплазматической поверхности мембраны отличаются от распределения и состава на экстраклеточной.
Свойства клеточных мембран и флуоресцентные методы их изучения Основная цель проведения флуоресцентных исследований заключается в том, чтобы разработать и применить систему флуоресцентных измерений для изучения состояния живой клетки и ее мембраны, позволяющую: получать и анализировать спектры флуоресценции (положение максимумов, тонкая структура спектров, интенсивность полос); определять статические и динамические конформационные свойства макромолекул в мембране; определять глубины залегания хромофоров в мембранах или белках по отношению к поверхности раздела; измерять микровязкость клеточных мембран; изучать поступательную и вращательную диффузия белков в биологических мембранах;
Свойства клеточных мембран и флуоресцентные методы их изучения исследовать реакции ассоциации (связывания) соединений с белками, ДНК, мембранами, проводить двумерное картирование образца по измеряемым параметрам анизотропии, интенсивности (в динамическом режиме). изучать полярность областей связывания исследовать доступность воды к области связывания (положение участка связывания внутри или снаружи макромолекулы); изучать эффективность флуоресцентного переноса энергии проводить двумерное картирования образца по эффективности флуоресцентного переноса энергии. измерять расстояния в 2-5 нм между флуоресцентными метками, введенные в мембраны или различные участки макромолекулы
Свойства клеточных мембран и флуоресцентные методы их изучения следить в реальном масштабе времени за проникновением низкомолекулярных и заряженных молекул в живую клетку и за их распределением по клеточным компонентам; исследовать влияние молекул на проницаемость, поверхностный заряд и трансмембранный электрический потенциал мембран в живых клетках; выяснить, как результат взаимодействия заряженных и незаряженных молекул с живой клеткой зависит от свойств этих молекул, с одной стороны, и от физико-химических свойств (прежде всего электрических) клеточных мембран, с другой стороны.
Оборудование для изучения флуоресценции Спектрофлуориметры серии FluoroMax являются компактными инструментами для получения спектров испускания в стационарном режиме. Как опции, приборы серии FluoroMax могут оборудоваться дополнительными устройствами для измерения времен затухания флуоресценции и фосфоресценции.
Оборудование для изучения флуоресценции Источник излучения: ксеноновая лампа Возбуждение: 200 нм - 950 нм (оптимизировано под УФ область) Эмиссия: 200 нм - 950 нм (оптимизирована под видимую область) Полоса пропускания: регулируемая до 30 нм Точность установки длины волны: ± 0.5 нм Скорость сканирования: 80 нм/сек Эмиссионный детектор: фотоумножитель Программное обеспечение: FluorEssence Габариты: 82.6 см х 28 см х 48 см Размеры камеры для образца: 14 см х18 см х 18 см Требования по электропитанию: 2.5 A, 240 В, 50-60 Гц Вес: 34 кг
Универсальный микропланшетный ридер Synergy 4. Модульная изменяемая архитектура ридера позволяет определять: * интенсивность флюоресценции; * флюоресценцию с временным разрешением; * поляризацию флюоресценции; * быстро (flash-) и медленно (glow-) протекающую люминесценцию; * поглощение в УФ и видимой области спектра; * FRET (исследование резонансного переноса энергии флюоресценции); * TR-FRET (исследование резонансного переноса энергии флюоресценции с временным разрешением); * BRET (исследование резонансного переноса энергии биолюминесценции); * спектральное сканирование. Оборудование для изучения флуоресценции
Оборудование для изучения флуоресценции Серия MF2 Спектрофлуориметры серии MF2 являются конфигурируемыми системами на основе блока для быстрых измерений времен затухания, работающего в фазово-модуляционном режиме. Главной особенностью MF2 является очень высокая скорость измерения времен затухания (порядка миллисекунд), по причине чего инструмент в основном применяется для изучения кинетики химических и биохимических процессов в режиме реального времени.
Оборудование для изучения флуоресценции Серия FluoroLog/NanoLog Спектрофлуориметры серии Fluorolog/Nanolog представляют собой уникальные модульные системы, которые могут быть скомпонованы «под ключ» исходя из любого требуемого набора задач, в принципе решаемых методом оптической флуориметрии. Спектрофлуориметры серии Nanolog специально спроектированы для исследований в области нанотехнологий и наноматериалов.
Автоматизированный люминесцентный спектральный комплекс для исследования фотофизических процессов в широком температурном диапазоне Основные характеристики: Измерение спектров и кинетик флуоресценции в диапазоне 350-800 нм под управлением компьютера. Детектор: фотоэлектронный умножитель, работающий в режиме счета фотонов. Фотовозбуждение объектов: He-Cd лазер, длина волны 325 нм. Установка снабжена гелиевым криостатом замкнутого цикла, позволяющим варьировать температуру объекта в пределах 14-300 К. Оборудование для изучения флуоресценции
Установка состоит из: YAG:Nd лазера с длительностью импульса 20 нс, длина волны излучения лазера 1064 нм может быть преобразована во вторую (532 нм) или четвертую (266 нм) гармонику; охлаждаемого фотоприемника на InGaAs с усилителем (модель G6126, Hamamatsu); вольтметра пиковых значений; цифрового запоминающего осциллографа. Временное разрешение при детектировании сигнала составляет 0.1-1000 мкс. Автоматизированный комплекс для исследования релаксационных процессов при импульсном лазерном воздействии Оборудование для изучения флуоресценции
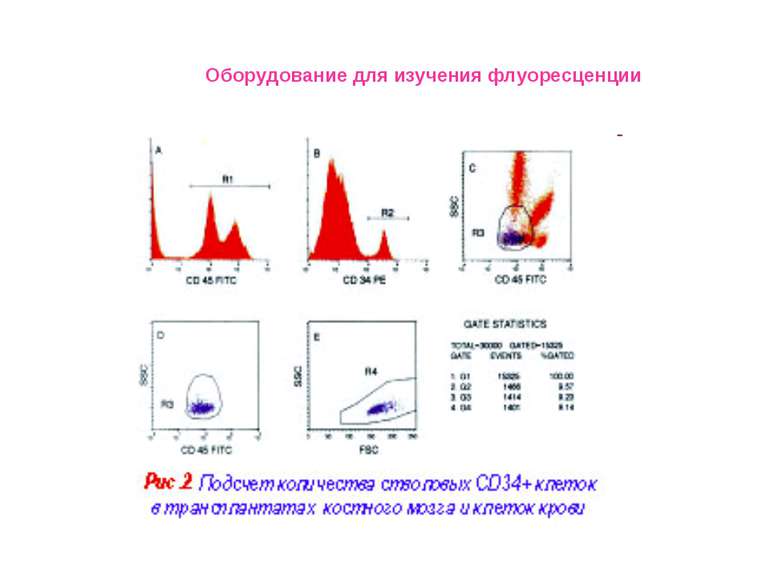
Проточный цитофлуориметр EPICS XL-MCL » Иммунология; иммунофенотипирование клеток периферической крови Оборудование для изучения флуоресценции
1 2 3 4 5 6 7 8 9 10 Do you know the parts now? LSM 510 META basic assembly 1 Laser Coupling 2 Collimator Optic 3 Beam combiner for a two fiber configuration (UV, NLO) 4 Main Dichroic Beam splitter 5 Scan Mirrors 6 Scan Optic 7 Mirror 8 Objective Lens 9 Specimen 10 Secondary Beam splitter 11 Pinholes 12 Emission Filter 13 Channel Detectors 14 Grating 15 Meta Detector 16 Fiber Out Coupling for connection of further detection modules (Spectrometer, Fluorescence Life Time Imaging Module) 17 Neutral Density Filter Wheel for attenuation of the laser reflex from 3 18 Monitor Diode to control laser intensity 1 1 2 1 2 3 7 6 5 4 8 9 11 10 10 10 11 11 11 12 13 12 13 14 16 17 18 15 Оборудование для изучения флуоресценции
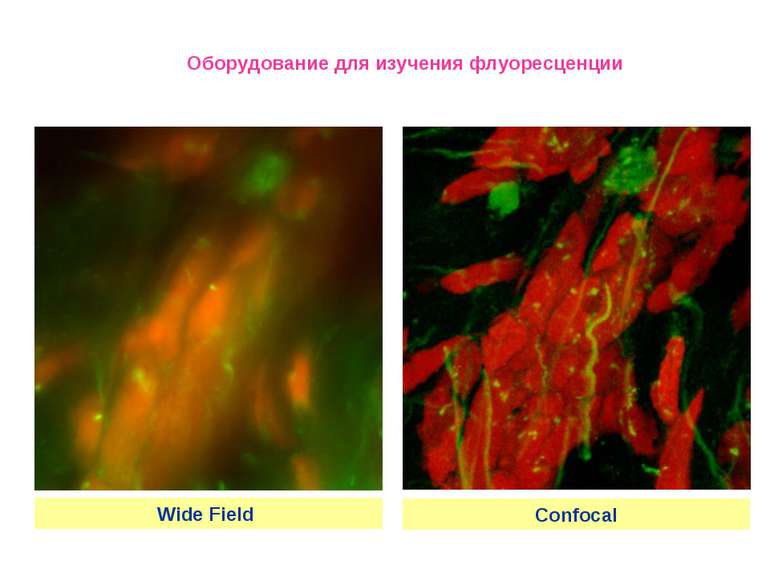
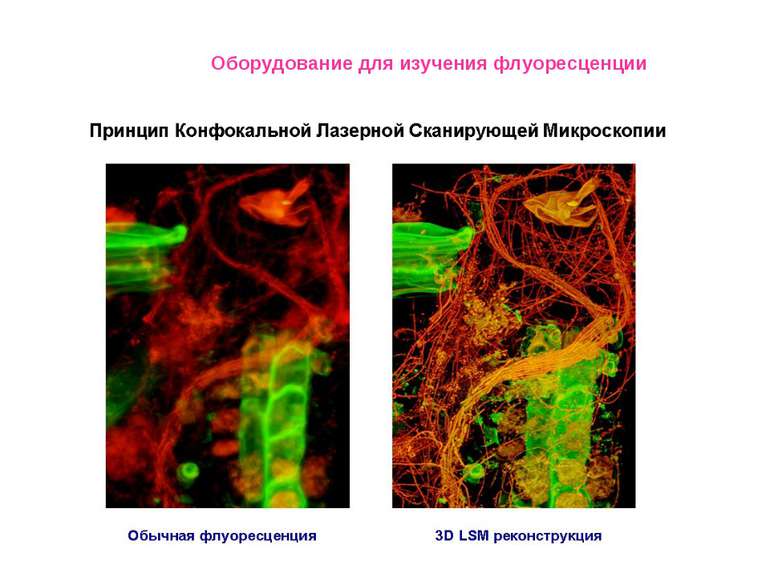
Конфокальный микроскоп Leica TCS SP2 * Измерение распределения интенсивности флуоресценции в фокальной плоскости и по объему исследуемых образцов при разных длинах волн в диапазоне длин волн возбуждения флуоресценции 450 – 663 нм (до семи независимых каналов регистрации одновременно). * Получение трехмерных изображений флуоресцентно меченных препаратов с измерением геометрических параметров. * Математическая обработка изображений. * Анализ процессов методами FRET и FRAP * Определение колокализации флуорофоров в образце. Оборудование для изучения флуоресценции
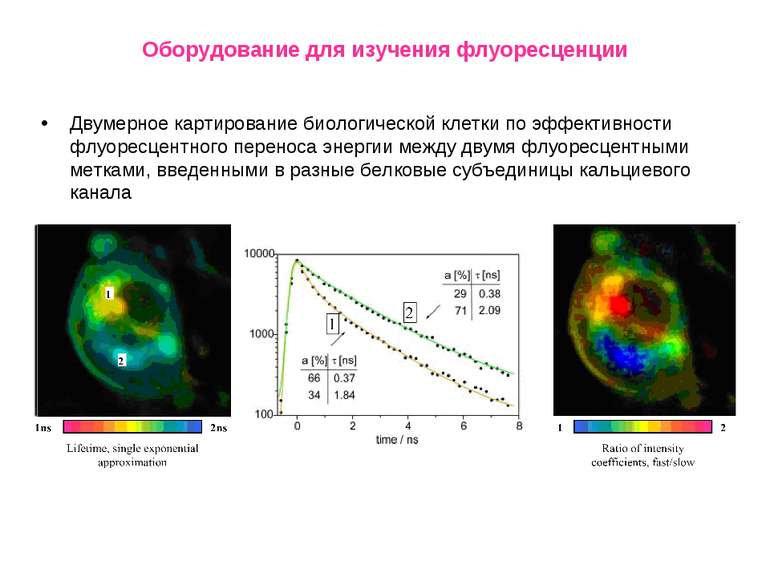
Оборудование для изучения флуоресценции Двумерное картирование биологической клетки по эффективности флуоресцентного переноса энергии между двумя флуоресцентными метками, введенными в разные белковые субъединицы кальциевого канала
Оборудование для изучения флуоресценции Серия DynaMyc DynaMyc – конфокальный флуоресцентный микроскоп, позволяющий проводить двумерное картирование образцов по результатам измерения динамических параметров флуоресценции, к примеру, по временам затухания флуоресценции. Теперь Вы можете изучать динамику флюоресценции, которая является независимой от концентрации флюорофоров, и получать больше информации о движении, размерах, окружении, взаимодействии, связывании изучаемых молекул.
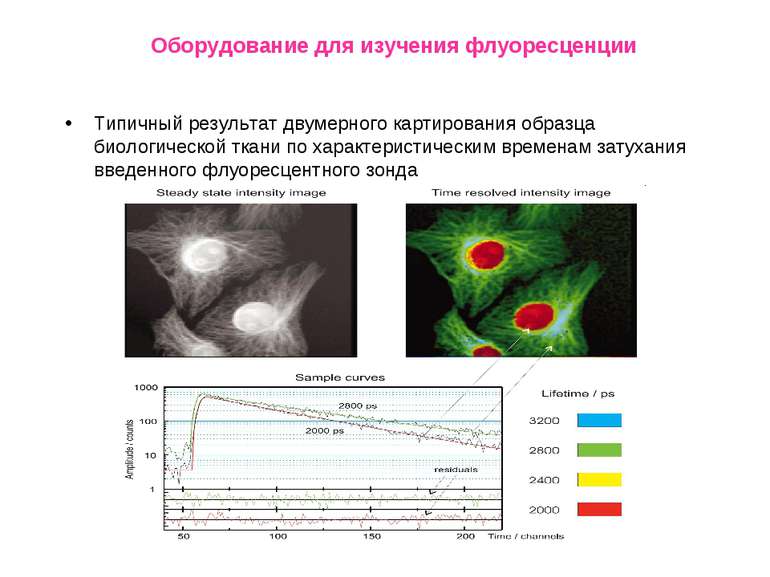
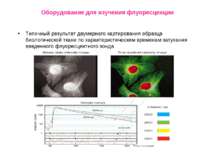
Оборудование для изучения флуоресценции Типичный результат двумерного картирования образца биологической ткани по характеристическим временам затухания введенного флуоресцентного зонда
Схожі презентації
Категорії