Презентація на тему:
Плазматичні та внутрішньоклітинні мембрани
Завантажити презентацію
Плазматичні та внутрішньоклітинні мембрани
Завантажити презентаціюПрезентація по слайдам:
Плазматична мембрана: функції Бар єрна Транспортна (зумовлена наявністю транспортних насосів та структурних одиниць інформаційних каскадів) Передача сигналів від гормонів, нейромедіаторів, тощо Міжклітинна адгезія (між клітинами одного типу в органі або між клітинами різного типу – напр., в печінці, де є гептоцити, холангіоцити (клітини протоків), клітини кровоносних судин
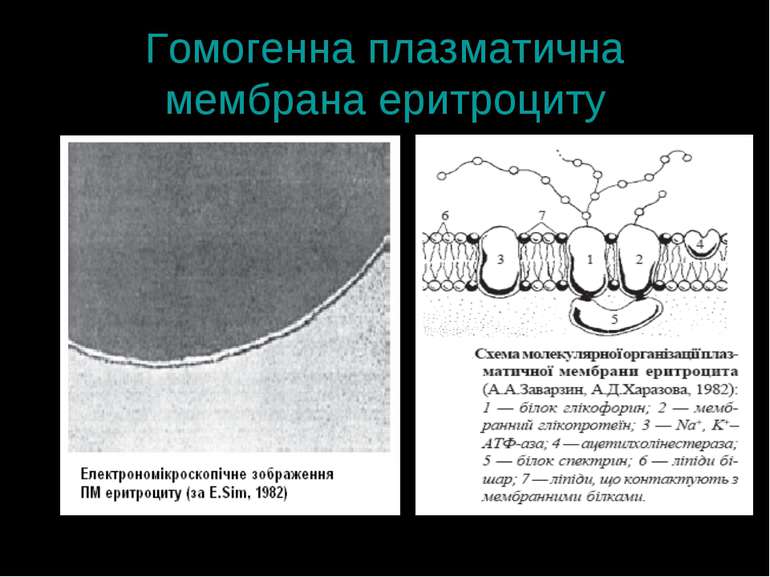
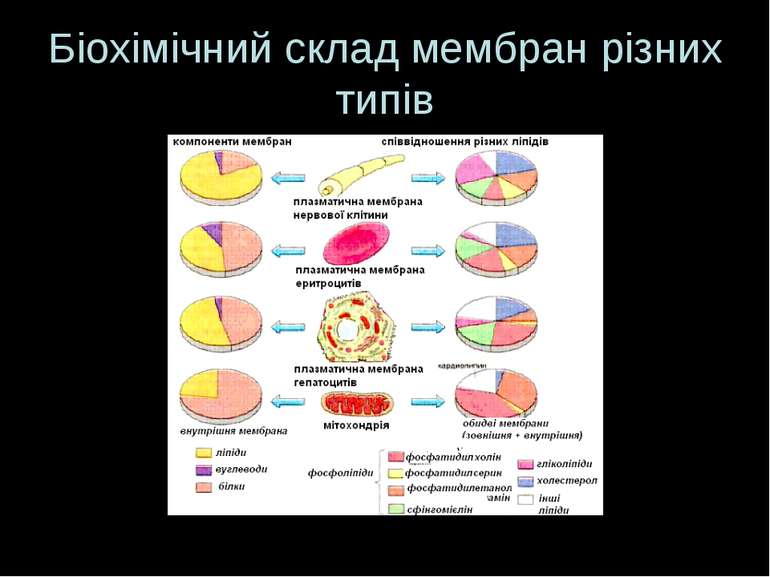
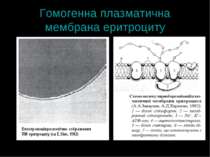
Плазматична мембрана: структура Принципи – спільні для всіх клітин Є специфічні відміни Гомогенна плазматична мембрана – має подібну морфологію на всьому її протязі (еритроцит) Гетерогенна плазматична мембрана – містить різні ділянки, що відрізняються за будовою (гепатоцит, ентероцит)
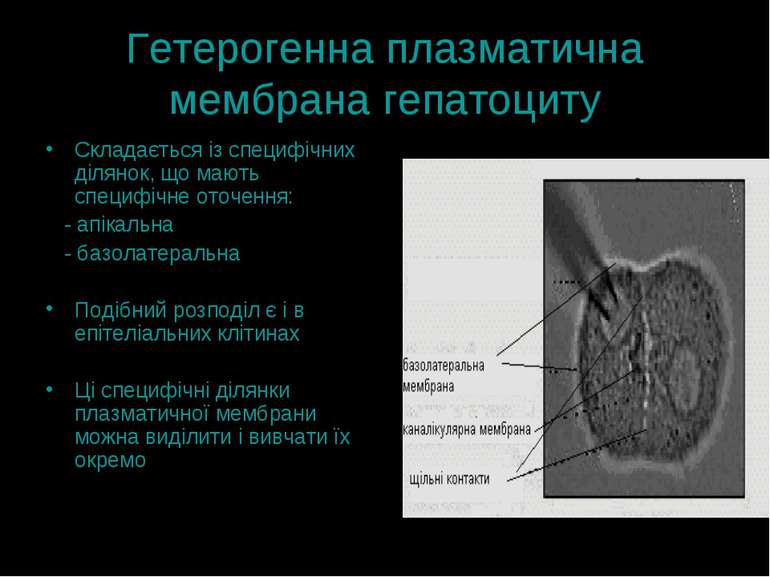
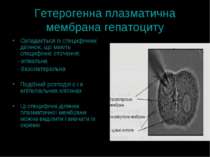
Гетерогенна плазматична мембрана гепатоциту Складається із специфічних ділянок, що мають специфічне оточення: - апікальна - базолатеральна Подібний розподіл є і в епітеліальних клітинах Ці специфічні ділянки плазматичної мембрани можна виділити і вивчати їх окремо
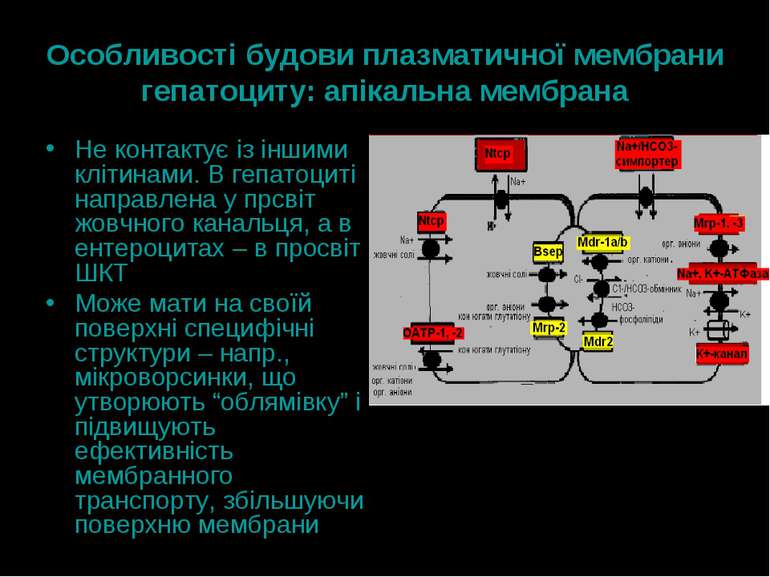
Особливості будови плазматичної мембрани гепатоциту: апікальна мембрана Не контактує із іншими клітинами. В гепатоциті направлена у прсвіт жовчного канальця, а в ентероцитах – в просвіт ШКТ Може мати на своїй поверхні специфічні структури – напр., мікроворсинки, що утворюють “облямівку” і підвищують ефективність мембранного транспорту, збільшуючи поверхню мембрани
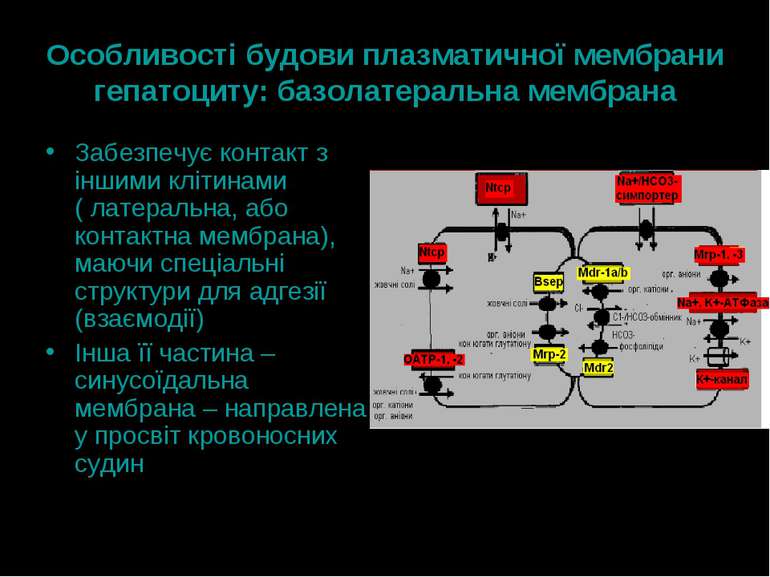
Особливості будови плазматичної мембрани гепатоциту: базолатеральна мембрана Забезпечує контакт з іншими клітинами ( латеральна, або контактна мембрана), маючи спеціальні структури для адгезії (взаємодії) Інша її частина – синусоїдальна мембрана – направлена у просвіт кровоносних судин
Типи міжклітинних контактів Міжклітинні контакти поділяються на 3 структурно-функціональні групи: - щільні (замикаючі); - прикріплюючі (основні – десмосоми); - комунікаційні (основні – щільові);
Типи міжклітинних контактів Щільні контакти – плазматичні мембрани сусідніх клітин скріплені безперервними ланцюгами трансмембранних білків. Ці білки контактують у міжклітинному просторі і утворюють сполучення, непроникні для макромолекул. В залежності від кількості таких контактів мембрани мають різну проникність для малих молекул та іонів. Вони герметезують ділянки взаємодії клітин та запобігають змішуванню вмісту клітин, позаклітинного середовища, кровоносних судин З комунікаційних контактів найбільш поширені щільові. Через них клітини обмінюються іонами і невеликими молекулами ( до 1500 Да), у тому числі й внутрішньоклітинними месенжерами, що забезпечує електричне та метаболічне спряження контактуючих клітин. Щільовий контакт складається з двох білкових утворень (по одному у кожній контактуючій мембрані), між якими залишається щілина в 2-4 нм. Всередині цих утворень є водяна пора. Проникність контактів регулюється рН і вмістом Са. При пошкодженні клітини вміст Са всередині клітини зростає (10 -4 моль/л і більше), що викликає закриття пори. Це запобігає поширенню пошкодження по тканині. Десмосоми складаються із щільної цитоплазматичної пластинки з прикріплюючих внутрішньоклітинних білків ( разом звуться десмоплакінами) і трансмембранних лінкерних глікопротеїнів. Останні внутрішньоклітинними доменами зв’язуються з пластинкою, а позаклітинними – між собою, чим утримують разом сусідні плазматичні мембрани. Існує хвороба шкіри – пемфігус – коли до десмосомних лінкерних глікопротеїнів виробляються антитіла. Це спричиняє руйнування демосом між клітинами епідермісу, з’являються пухирці внаслідок виходу тканинних рідин у розпушений епітелій. Це стосується тільки шкіри – отже, десмосоми різних тканин мають біохімічні відміни.
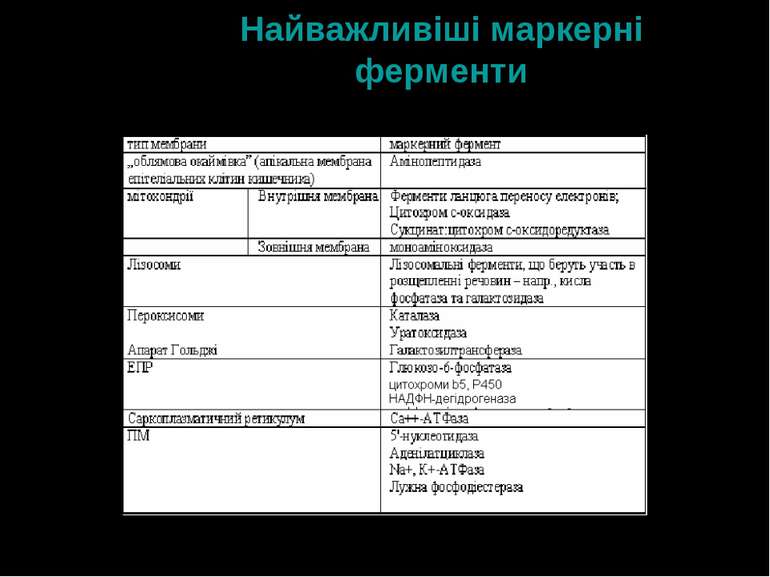
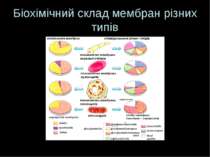
Ендомембрани Мембрани ЕПР, апарату Гольджі, ядер, мітохондрій, лізосом, пероксисом, піно- і фагосом Вони поділяють клітину на компартменти, в яких здійснюються специфічні функції: синтез біомолекул (ЕПР), відтворення генетичної інформації (ядро), генерація енергії (мітохондрії), вивільнення продуктів життєдіяльності (апарат Гольджі) Кожний тип ендомембран, а також ПМ характеризується тим чи іншим спектром специфічних мембранних ферментів, що залучені у біохімічні процеси, властиві даному типу мембран. Ці ферменти отримали назву маркерних До маркерних, або векторних, ферментів належать порівняно стабільні ферменти, активність яких є достатньо високою і може бути легко виміряна Маркерні ферменти є типово інтегральними білками Маркерні ферменти застосовують для оцінки чистоти виділених мембранних фракцій
ЕПР ЕПР – це система мембранних структур, що утворюють сітку трубочок, пухирців, цистерн Гранулярний (шороховатий) ЕПР – основна роль – біосинтез білків на рибосомах; синтезовані білки надалі модифікуються у апараті Гольджі, набуваючи функціональної активності; новосинтезовані білки після процесингу можуть вбудовуватися у плазматичну мембрану Агранулярний (гладенький) ЕПР – біосинтез стероїдів, десатурація жирних кислот, процеси детоксикації із залученням транспорту електронів за участю цитохромів р450 і b5 ЕПР є депо Са++ Маркерний фермент мембрани ЕПР – глюкозо-6-фосфатаза, цитохроми b5, Р450, Са++-АТФаза, НАДФН-дегідрогеназа
Апарат Гольджі Це сукупність окремих мембран, що утворюють цис- і транс-області – т.ч. Ця структура є полярною. Цис-область – це початок апарату Гольджі; транс-область – його закінчення. Основна функція апарату Гольджі – модифікація і зберігання білків, синтезованих на ЕПР, їх упаковка та секреція Апарат Гольджі багатий на ферменти глікозилювання – глікозидази, глікозилтрансферази По ходу апарату Гольджі змінюється будова мембран, а також здатність до синтезу і модифікації різних сполук Маркерні ферменти мембрани апарату Гольджі – УДФ-галактозилтрансфераза, сіалілтрансфераза, тіамінпірофосфатаза
Лізосоми Відповідають за деградацію макромолекул Містять ферменти: - протеази - ліпази - нуклеази Також містять сполуки, які захоплює клітина шляхом ендоцитозу (фаго- і піноцитозу). Ці речовини входять у лізосоми у складі ендосом і фагосом, що утворюються за участю плазматичних мембран; в лізосомах відбувається розщеплення компонентів цих структур Маркерні ферменти мембран лізосом – кисла фосфатаза,β-глюкуронідаза, арилсульфатаза, кисла РНКаза, кисла ДНКаза
Пероксисоми Органели, що містять окислювальні ферменти, які беруть участь у деградації малих молекул (амінокислоти, жирні кислоти, ксантин) – зокрема, каталазу Маркерні ферменти пероксисом – каталаза, карнітинпальмітоїлтрансфераза, уратоксидаза
Мітохондрії Здійснюють основні процеси, що сприяють накопиченню енергії Це двомембранні структури. Внутрішня мембрана утворює крипти, на яких зосереджені субстрати і ферменти ланцюга переносу електронів Також виконує роль Са++-депо Маркерні ферменти зовнішньої мітохондріальної мембрани – моноаміноксидаза Маркерні ферменти внутрішньої мітохондріальної мембрани – Н+-АТФаза, ротеноннечутлива НАДФН-цитохром с-редуктаза, сукцинатдегідрогеназа, цитохромоксидаза Маркерні ферменти міжмембранного простору мітохондрій – аденілаткіназа, малатдегідрогеназа
Ядро Оточене 2-мембранною ядерною оболонкою; в ряді випадків ці 2 мембрани з єднуються з утворенням ядерних пор Внутрішня ядерна мембрана має 6% вуглеводів (зовнішня – 16%), більше окисних ферментів і ДНК. До неї прикріплюється периферійний хроматин. Її функціональна активність дуже висока. Є гіпотеза, що вона бере участь у регуляції ініціації реплікації й транскрипції Зовнішня ядерна мембрана – утворює “вип ячування”, які формують везикули, що за певних умов здатні відбруньковуватися від неї – “blabbing”. Ці везикули рухаються у напрямку: ядерна мембрана → ЕПР → апарат Гольджі → плазматична м-на Під внутрішньою ядерною мембраною розташована ламіна. Ламіна – це фіброзний шар товщиною 20 – 80 нм, немембранний компонент ядерної оболонки, що контактує із внутрішньою ядерною мембраною, не містить ДНК і ліпідів. В місцях утворення пор цей шар переривається. Він складається якби із правильних 6-кутників, зібраних, як соти, механічно скріплює ядерну оболонку і сприяє її відновленню при пошкодженні. Є 3 типи ламін: а, b, c Ядерні пори - це 8 периферійних гранул (центральна гранула діаметром 100 нм + 7 гранул навкруги неї). Діаметр пори – 25 нм. Пора безпосередньо пов язана із ламіною – але в місті пори вона відсутня. Внутрішня і зовнішня мембрани навколо пори з єднуються, утворюючи “ободок пори” Ферменти ядерної оболонки – глюкозо-6-фосфатаза, пірофосфатаза, манозо-6-фосфатаза, 5‘-нуклеотидаза, лізофосфоліпідтрансфераза, Mg-залежна АТФаза, фосфоліпази А і С, протеїнкінази Наявність у ядерній мембрані таких ферментів, як серин-треонінові ПК (зокрема, здійснюють фосфорилювання білків-регуляторів реплікації, напр., гістонів), фосфатази (відщеплюють залишки фосфорної к-ти з утворенням АТФ), фосфоліпаз А і С (сприяють синтезу фосфатидилінозитол-3-фосфату і ДАГ), Са++,Mg-залежної АТФази (забезпечує транспорт катіонів Са++ і виконує регуляторну роль у біосинтетичних процесах у ядрі) свідчить про те, що ядерна мембрана залучена до внутрішньоклітинної трансдукції
Маркерні ферменти ПМ Базолатеральна: аденілатциклаза; Na+,К+-АТФаза Апікальна: 5'-нуклеотидаза; лейцинамінопептидаза; глутамілтранспептидаза
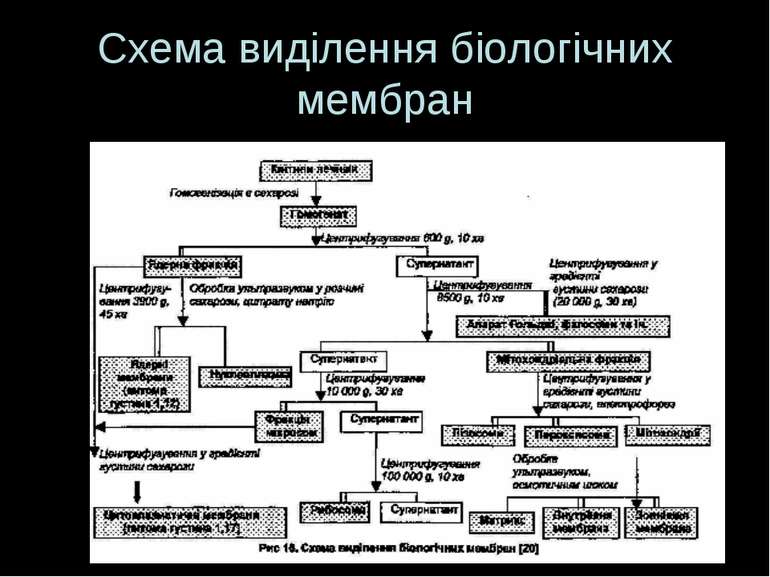
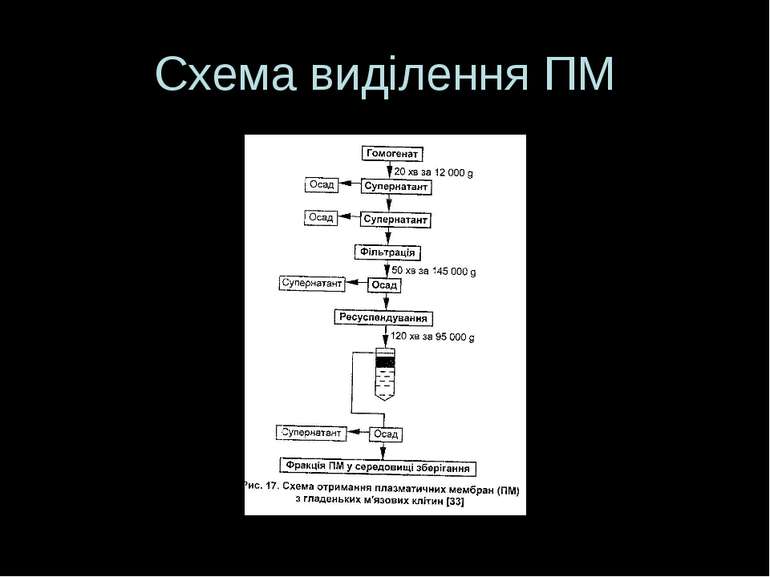
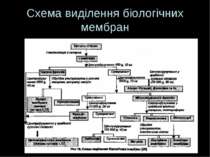
Загальна схема Руйнування тканин і клітин Диференційне ультрацентрифугування (фракціонування) з утворенням субклітинних фракцій, що базується на загальних принципах фракціонування внутрішньоклітинних органел. Ще Potter et al показали, що частки, які звільнюються при розриві клітин, можна поділити на фракції відносно до їх активності та морфології. Адже фракції вміщують частки, що володіють певними розмірами й щільністю, що робить можливим їх фракціонування у різних центробіжних полях і градієнті щільності 3. Очищення отриманих фракцій - т.я. фракції, отримані при однократному центрифугуванні, ніколи не бувають чистими – напр., мітохондріальна фракція окрім мітохондрій та їх фрагментів буде містити домішки лізосом і везикул-похідних ПМ і ЕПР. Для очищення – повторні центрифугування, а для розділення грубих субклітинних фракцій на більш чисті, які складаються переважно із мембран 1-го типу – центрифугуваня грубих фракцій в градієнті щільності сахарози чи фіколу (+висока швидкість і охолодження) Для отримання ПМ використовують 0,32 М сахарозу .”+” сахарози – відносна дешевість; “-” – сахароза легко проходить крізь ПМ і може пошкодити її структурні компоненти. Особливо це стосується лімфоїдних клітин, які є дуже чутливими. Для виділення ПМ лімфоїдних клітин застосовують м які умови та інші сполуки, що не можуть проходити всередину клітини, напр., фікол 4. Ідентифікація виділених субклітинних фракцій та дослідження ступеню їх чистоти
Руйнування тканин і клітин При виділенні ПМ треба пам ятати, що: Вона є гетерогенною; Вона є асиметричною – внутрішня і зовнішня поверхні будь-якої ПМ є різними: зовнішній бік мембрани містить багато глікозильованих білків, які, зокрема, є чутливою частиною рецепторів, і містить порівняно мало фосфатидилсерину. Внутрішня поверхня має багато ферментів, що беруть участь у гліколітичному розщепленні фосфоліпідів, а також ферменти, що беруть участь у передачі сигналу за фосфатидилінозитол-залежним шляхом Тому бажано використовувати більш м які умови для руйнування клітин – інакше може порушитися зазначений розподіл. Допускається руйнування клітин ультразвуком, впливом гіпо- й гіперосмотичного середовища (осмотичний шок), заморожуванням/відтаюванням, рідким азотом, гомогенізацією (розтиранням у ступці із кварцевим піском чи скляними кульками). При цьому утворюються 1 чи кілька розривів ПМ, внутрішнє середовище клітини витікає, залишається “тінь” – ПМ. Метод руйнування клітин і тривалість обробки залежить від типу тканини Зруйновані клітинні мембрани здатні замикатися й утворювати міхурці діаметром 0,3 – 3 мкм
Буфер виділення – деякі особливості Повинен мати певний рН; Повинен мати певну іонну силу; Для збереження -S-S-зв язків додають меркаптоетанол; Є засоби, що забезпечують збереження термолабільних мембранних ферментів Повинен містити сахарозу, яка, створюючи осмотичний тиск, запобігає руйнуванню виділених мікроструктур
Розділення субклітинних компонентів: класичний варіант фракціонування Диференційне центрифугування у градієнті густини; в процесі ультрацентрифугування гомогенатів клітин і тканин фрагменти мембран рухаються під дією відцентрової сили й розділяються вздовж центрифужної пробірки В залежності від швидкості фракціонування гомогенат клітин поділяється на 3 грубі фракції: Ядерна (низькошвидкісне центрифугування 600G, 15 хв) – має великі за розміром органели (із домішками лізосом, колагену, ядерець, ЕПР); Мітохондріальна (10 000 G, 25 хв) – частинки середнього розміру (домішки – еритроцити, лізосоми, пероксисоми ); Мікросомальна фракція (міститься у надосадовій рідині після видалення фракції мітохондрій) – найменші органели Далі кожну із цих фракцій можна розділити, нашаровуючи на градієнт щільності з наступним центрифугуванням у відповідності до швидкості седиментації тієї фракції, яку треба отримати Наприклад, ядерна фракція містить ядерні мембрани; супернатант (надосадова рідина) після центрифугування (10 000 G, 25 хв) дає осад – мітохондріальну фракцію і новий супернатант – мікросомальну фракцію. Остання в основному є сумішшю мембран ЕПР, апарату Гольджі. Застосовуючи різні середовища, різні градієнти щільності можна їх відділити – для цього на виготовлене середовище із певним градієнтом нашаровують суміш і центрифугують за високої швидкості Інший приклад – отримання із мітохондріальної фракції внутрішніх і зовіншніх мітохондріальних мембран і компонентів матриксу Для отримання “порожніх” субклітинних структур – виключно мембранних фракцій – виділені субклітинні структури обробляють ультразвуком. При цьому вміст органел виходить назовні, а мембрани утворюють замкнені структури
Вимоги до речовини, що застосовується для приготування градієнта щільності Легко розчинна у воді; Фізіологічно нешкідлива і хімічно інертна; Розчин цієї речовини повинен бути нев язким, прозорим у видимій ділянці спектра, має створювати низький осмотичний тиск
Найпоширеніші речовини для створення градієнту густини Сахароза ( + - задовольняє більшості вимог; “-” – в той же час, за високих конентрацій має велику в язкість і може спричинити небажані осмотичні ефекти) Перкол (золь силіконових частинок, вкритих полівінілпіролідоном) – “+”: дозволяє зменшити швидкість центрифугування і створити ізоосмотичні умови, що важливо при ізолюванні крихких органел і везикул для дослідження мембранного транспорту Метризамід і найкоденз – “+” – мають дуже низьку осмотичну активність і в язкість, ніж розчини сахарози тієї ж густини; застосовуються для розділення мітохондрій, лізосом, пероксисом, для виділення секреторних гранул
Ідентифікація та визначення забрудненості отриманих мембранних фракцій Отримані фракції мембран можуть бути “забрудненими”. Для ідентифікації отриманих мембранних фракцій та для визначення забруднення можна: Застосувати методи мікроскопії для виявлення певних ознак (напр., наявності мікроворсинок та ін. морфологічних елементів ПМ; ідентифікації ядерної фракції – фазово-контрастний мікроскоп; ЕПР (за наявністю рибосом) і мітохондрії; також можна виявити присутність у препаратів сторонніх структур – незамкнених обривків мембран, фібрил тощо) Визначити ліпідний склад: всі клітинні мембрани містять ліпіди, але співвідношення ліпід:білок і набор ліпідів є специфічними для даного типу мембран Визначити білковий склад : застосувати метод електрофореза в ПААГ – для деяких типів мембран є характерною присутність значних кількостей білків з певною молекулярною масою. Напр., мікросомальна фракція м язової тканини – Са++-АТФаза саркоплазматичного ретикулуму (М.м. 100 кД) – 50-70% від загального вмісту білка цієї фракції; ПМ – глікопротеїни; Застосувати визначення активності маркерних ферментів
Маркерні ферменти Оцінюють активність маркерних ферментів мембран усіх клітинних органел як у вихідному гомогенаті, так і в усіх фракціях, виділених поетапно в процесі отримання кінцевої мембранної фракції. Це дозволяє визначити, на якому етапі може відбуватися осадження певних мембран, оцінити втрати мембранних фракцій та вихід кінцевого мембранного матеріалу, про що свідчить збагачення його маркерами (збільшення активності певного мембранного маркера відносно вихідного гомогенату). Чим вище буде це збагачення, тим більш гомогенним буде виділений препарат. Для різних об єктів ступінь збагачення біохімічним маркером варіює від 5 до 50 Фермент може бути маркером, якщо: Від міцно зв язаний з даною мембраною; При розділенні фракцій він не підлягає активації чи інгібуванню; Локалізований виключно в даному типі мембран На практиці для більш чіткого контролю за чистотою триманих фракцій визначають активність 2-3-х мембранних маркеров для кожного типу мембран Застосування маркерів із цілого набору маркерних ферментів для мембрани певної органели варіює в залежності від типу клітин.
Маркери для визначення чистоти ПМ 5‘-нуклеотидаза зовнішньої поверхні ПМ Аденілатциклаза – внутрішня поверхня ПМ Na+, К+-АТФаза – інтегральний білок, що активується іонами Na+ ізсередини клітини, а К+ - ззовні і розщеплює внутрішньоклітинний АТФ Лужна фосфодіестераза – цитоплазматичний бік ПМ Активність цих ферментів може не проявитися, якщо в процесі виділення зміниться орієнтація мембрани – зовнішня поверхня буде всередині міхурця і активний центр ферменту стане недосяжним для субстрату. Крім того, маркерні ферменти 1-го типу мембран можуть проявляти свою активність і в інших типах мембран – напр., 5‘-нуклеотидазна активність в основному характерна для ПМ, але ця активність також присутня також в апараті Гольджі і ЕПР
Схожі презентації
Категорії