Презентація на тему:
дифернц
Завантажити презентацію
дифернц
Завантажити презентаціюПрезентація по слайдам:
Дослідження процесів диференціювання клітин в системі in vitro Ключевим механізмом гістогенезу є диференціювання клітин. Всі клітини багатоклітинного організму розвиваються із однієї клітини - зиготи. зигота - тотипотентна тобто здатна давати початок любій клітині. Ця властивість зберігається до 4-8 бластомерів. наступні клітини (бластомери, клітини зародкових листків ) уже не тоти-, а поліпотентні: здатні давати початок не всім а багатьом типам клітин уніпотентні – ті які диферціюються лише в один тип клітин. феномен поступового обмеження можливих напрямків розвитку клітин називається «коммитированием».
а) Механизм коммитирования - стойкая репрессия одних и дерепрессия других генов. б) Таким образом, по мере развития в клетках постепенно меняется спектр фунционально активных генов,и это определяет всё более узкое и конкретное направление дальнейшего развития клеток. а) На определённой стадии коммитирование приводит к тому, что у клетки остаётся только один путь развития: такая клетка называется детерминированной.б) Итак, детерминация - это появление у клетки генетической запрограммированности только на один путь развития. в) А. Таким образом, детерминация - более узкое понятие, чем коммитирование:превращение тотипотентных клеток в полипотентные, олигопотентные и, наконец, унипотентные - это всё коммитирование;о детерминации же можно говорить лишь только на самом последнем этапе - при образовании унипотентных клеток.Б. Действительно, поли- или олигопотентная клетка - ещё не детерминирована: у неё сохраняются разные варианты развития.
а) Реалізація програми розвитку детермінованої клітини з часом змінює морфологію та функції клітини чи її потомків. Такі події відносять до ДИФЕРЕНЦІЮВАННЯ ОТЖЕ, ДИФЕРЕНЦІЮВАННЯ – це послідовна зміна структури та функції клітини, яка обумовлена генетичною програмою розвитку і приводить до утворення високоспеціалізованих клітин з послідовними змінами біохімії та морфології клітин а) Диференціювання клітин призводить до утворення диферонів. Диферон –це сукупність клітинних форм (від стовбурової клітини до високодиференційованих), які складають певну лінію диференціювання. Наприклад, в кровотворній тканині - 8 диферонів: які починаються з однієї поліпотентної стовбурової клітини крові, а потім починаючи з уніпотентних стають різними
Стосовно клітин, що культивуються - До умов, які сприяють проліферації клітин, відносяться низька щільність, невисока концентрація Ca2+, наявність ростових факторів. Фактори індукції диференціювання: висока щільність клітин (вище 105 клітин на 1 см2), концентрація Ca2+ (300—1500 мкмоль); наявність індукторів диференціювання (гормони, зокрема гідрокортизон, фактор дозрівання глії, фактор росту нервів, ретиноїди; та полярні розчинники, диметилсульфоксид)
Індуктори диференціювання для різних типів клітин різні: 1.Низькі концентрації сироватки активують диференціювання олігодендроцитів 2.Для диференціювання бронхіального епітелію в ороговіваючий навпаки необхідно використовувати високі концентрації сироватки. 3.Велике значення, особливо для епітелію, має встановлення правильної полярності клітин та їх форми. Так, клітини, що ростуть на зависі колагенового гелю, омиваються поживним середовищем зі всіх сторін, і це дозволяє встановить правильну полярність відносно базальної мембрани, а також підтримувать правильну форму клітин завдяки наявності субстрату.
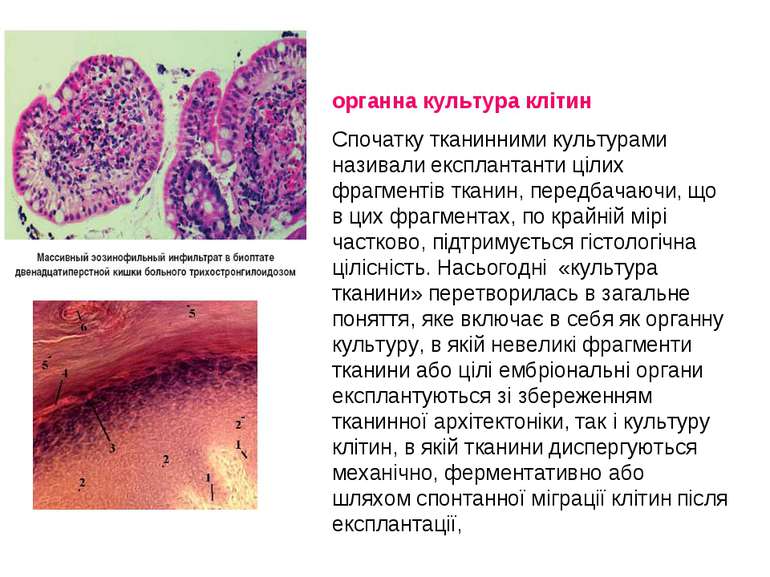
органна культура клітин Спочатку тканинними культурами називали експлантанти цілих фрагментів тканин, передбачаючи, що в цих фрагментах, по крайній мірі частково, підтримується гістологічна цілісність. Насьогодні «культура тканини» перетворилась в загальне поняття, яке включає в себя як органну культуру, в якій невеликі фрагменти тканини або цілі ембріональні органи експлантуються зі збереженням тканинної архітектоніки, так і культуру клітин, в якій тканини диспергуються механічно, ферментативно або шляхом спонтанної міграції клітин після експлантації,
Під диференціюванням in vitro розуміється експресія генів, які відповідають за функціональні властивості вихідної тканини. Перевагами дослідження диференціювання клітин in vitro є слідуючі: на клітинних лініях, що диференціюються в культурі можливе дослідження властивостей клітин в строго контрольованих умовах навколишнього середовища. Можлива екстраполяція клітинних взаємодій, що відбуваються in vitro на процеси, що відбуваються в цілісному організмі При використанні первинних клітин, експлантованих із організму для дослідження механізмів диференціювання теж існує ряд проблем із-за клітинної гетерогенності, втрати дефінітивних властивостей вихідної тканини та обмеженого строку життя in vitro. Тому, використання ряду клітинних постійних ліній, в яких зберігається вся программа диференціювання вихідної тканини є надзвичайно зручною модельною системою.
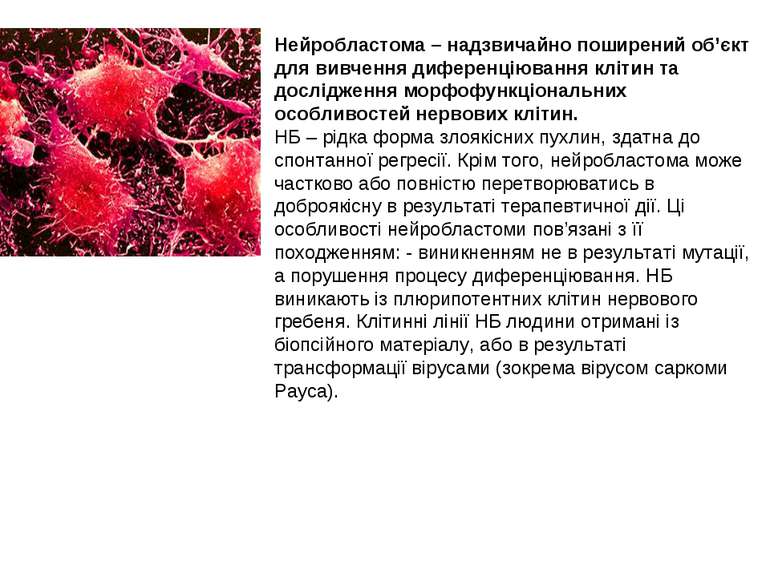
Нейробластома – надзвичайно поширений об’єкт для вивчення диференціювання клітин та дослідження морфофункціональних особливостей нервових клітин. НБ – рідка форма злоякісних пухлин, здатна до спонтанної регресії. Крім того, нейробластома може частково або повністю перетворюватись в доброякісну в результаті терапевтичної дії. Ці особливості нейробластоми пов’язані з її походженням: - виникненням не в результаті мутації, а порушення процесу диференціювання. НБ виникають із плюрипотентних клітин нервового гребеня. Клітинні лінії НБ людини отримані із біопсійного матеріалу, або в результаті трансформації вірусами (зокрема вірусом саркоми Рауса).
НБ представляють собою гетерогенні популяції клітин і представлені округлими клітинами (можуть утворювати агрегати) та розпластаними на субстраті. Такий тип росту характерний як для НБ людського, так і мишиного походження. Лінії НБ мишей – анеуплоїдні, з високим числом хромосом в клітинах, в середньому 3-5 п. Вони характеризуються широким розмахом каріотипової мінливості, модальний клас хромосом виражений слабо. На противагу, НБ людського походження в своєму складі мають більшість диплоїдний або кратний диплоїдному набору хромосом, з чітко вираженим модальним числом. Для багатьох ліній НБ людського походження відмічаються специфічні хромосомні перебудови, зв’язані з утворенням гомогенно-зафарбованих районів в певних хромосомах. Нейробластомні клітини при тривалому культивуванні зберігають онкогенність і при перещепленні безтимусним мишам можуть давати пухлини.
Основними маркерами диференціювання нервових клітин є наявність в них специфічних відростків, висока активність ферментів, які приймають участь у метаболізмі нейромедіаторів, електрична збудність клітинної мембрани. Відомо багато агентів, які суттєво підвищують рівень диференціювання в клітинах, що культивуються, в результаті чого НБ стає фенотипові схожою з нормальними клітинами. Недиференційовані клітини НБ мають округлу форму та низьку ступінь субстратної залежності. У диференційованих клітин наявним є специфічні відростки – нейрити, довжина яких, ступінь відгалуження, а також кількість на клітину варіюють. Ознаки диференціювання НБ в культурі: 1) якісним критерієм диференціювання є частота клітин з нейритами клітинні лінії клітин НБл як людського так і мишиного походження містять ряд маркерних для нервових клітин ферментів адренергетичних нейромедіаторів (тирозингідроксилаза, дофамін-β-гідроксилаза, катехол –q –метилтрансфераза) та холінергічні нейромедіаторів (холінацетилтрансфераза та ацетилхолінестераза). За активністю цих ферментів клітини НБ поділюють нв 4 групи: адренергічні холінергічні змішаний тип неактивні
Еритролейкемія Більшість клітинних ліній еритролейкемії мишиного походження. Вперше отримані Фрейдом із ретикулоклітинних сарком. Основну масу складали недиференційовані клітини, однак в невеликих кількостях були присутні і зрілі еритробласти, в тому числі і ті, що синтезували гемоглобін. Вірусологічні дослідження виявили наявність невеликої кількості вірусних частин на клітинних мембранах, а також в культуральному середовищі. Ін’єкції клітин сигенним мишам приводили до утворення пухлин. При клону ванні клітин ЕЛ виявились як диференційовані так і недиференційовані клітини. Здатність клітин еритролейкемії диференціюватись та продукувати гемоглобін дало можливість використовувати ці клітини для вивчення механізмів еритропоеза, а також загальних закономірностей цитодиференціювання. В більшості випадків матеріалом для отримання клітинних ліній ЕЛ слугують кровотворні органи мишей (селезінка, кістковий мозок), заражених вірусом Фрейда.
Міогенні клітинні лінії В первинних культурах скелетних м’язів різних видів тварин одно ядерні міогенні клітини зливаються і утворюються багатоядерні клітини з висоорганізованими міофібрілярними структурами, забезпечуючи їх ритмічне скорочення, тобто міогенез in vitro проходить так як in vivo. Така модель широко застосовується, хоча має ряд недоліків:диференціювання проходить лише в первинних культурах. При пересівах клітини можуть зберігати проліферативну активність, але здатність до диференціювання втрачають повністю. Найбільш поширені в дослідженнях біогенезу є первинні культури отримані із скелетних м’язів щурів. Для того, щоб раніше часу не формувались міотуби, необхідно слідкувати, щоб на початковому етапі не утворювався моно шар. Клітинні лінії 3Т3 та С3Н10Т1/2 отримані при тривалому культивування експлантованих клітин ембріонів мишей мають фібробластоподібний вигляд. Трансформований фенотип цих клітин має мінімальну ступінь, при перещепленні не дають пухлин. При обробці обох ліній клітин 5-азацитидином, або його аналогами ксилофуранозидом або рибоксилофуранозидом ( агенти, що міняють ступінь метилювання ДНК) в обох культурах формуються міотуби
ЕК-клітини Експериментальна тератокарцинома- пухлина, яка виникає із попередників термінальних клітин, що мають потенціал до диференціювання ранніх ембріональних клітин. Ці пухлини можуть перещеплюватись in vivo чи підтримуватись in vitro, проявляючи онкогенні властивості. В перещеплених пухлинах можуть формуватись острівці зрілої тканини. Причому ізольовані клітини можуть диференціюватись по декількам напрямкам, проявляючи властивості поліпотентних стовбурових клітин. Диференціювання in vitro може бути індуковано ретиноєвою кислотою. Розміщення диференційованих та недиференційованих клітин в тератокарциномі є хаотичним. Недиференційовані стовбурові клітини тератокарциноми називають клітинами ембріональної карциноми (ЕК- клітини). За морфологічними та функціональними ознаками ЕК-клітини схожі з ембріональними клітинами ранніх стадій нормального розвитку.
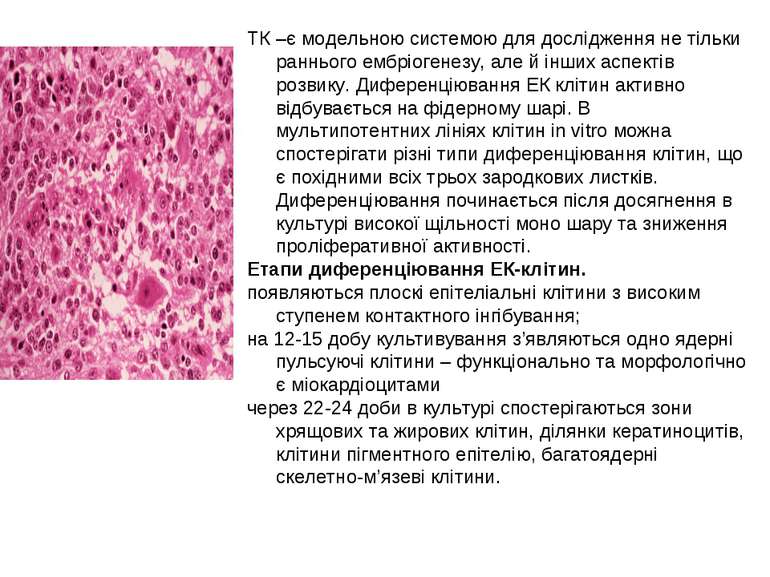
ТК –є модельною системою для дослідження не тільки раннього ембріогенезу, але й інших аспектів розвику. Диференціювання ЕК клітин активно відбувається на фідерному шарі. В мультипотентних лініях клітин in vitro можна спостерігати різні типи диференціювання клітин, що є похідними всіх трьох зародкових листків. Диференціювання починається після досягнення в культурі високої щільності моно шару та зниження проліферативної активності. Етапи диференціювання ЕК-клітин. появляються плоскі епітеліальні клітини з високим ступенем контактного інгібування; на 12-15 добу культивування з’являються одно ядерні пульсуючі клітини – функціонально та морфологічно є міокардіоцитами через 22-24 доби в культурі спостерігаються зони хрящових та жирових клітин, ділянки кератиноцитів, клітини пігментного епітелію, багатоядерні скелетно-м’язеві клітини.
Важливим напрямком із застосуванням клітин, що диференціюються in vitro є мієломні лінії клітин Ці пухлини являють собою продукти злоякісної проліферації одиничних клонів В-клітин, кожен із яких секретує імуноглобуліни одного якогось виду, причому деякі із цих імуноглобулінів реагують з антигенами навколишнього середовища. Доступність цих ліній, можливість трансплантувать їх in vivo, а також адаптувати до росту в умовах in vitro дозволили суттєво розширити наші уявлення про структуру, секрецію та функцію імуноглобулінів.
Одним із напрямків застосування клітин, що диференціюються in vitro є Підтримання та культивування кровотворної та лімфоїдної тканини. Культивування гемопоетичної тканини розвивалась в декількох напрямках. В культурах стромального компоненту лимфоїдних та кровотворних органів були досліджені властивості клітин, що створюють мікро оточення кровотворення. В напівтвердих культуральних середовищах були клоновані майже всі клітини-попередники гемо та лімфопоезу. При додаванні лімфокінів із культур лімфоцитів, які були стимульовані мітогенами, в напівтвердих гелях були отримані колонії, які утворені безпосередньо поліпотентними стовбуровими кровотворними клітинами, в сузпензійних клітинах – довго пасовані лінії диплоїдних Т-лімфоцитів. Найбільш наближеною системою до гемопоезу є культури кровотворних та лімфоїдних клітин на стромальних підложках. В останні роки найбільш ефективною системою культивування клітин кроворення є декстеровська система. Особливістю цієї системи є її двофазність, завдяки чому кровотворні та лімфоїдні елементи стають доступними для їх використання в клінічних цілях.
Декстеровські культури мають надзвичайно виражену морфологію: в рідкій фазі плавають великі компактні групи кровотворних клітин, які рихло зв’язані з під ложкою. Стромальна підложка надзвичайно необхідна для кровотворення в культурі. Шари адгезивних клітин некістковомозкового походження нездатні підтримувати довготривалий гемопоез. Стромальна підложка є багатошаровою структурою, яка гетерогенна за своїм складом і в декстеровських культурах існує як кровотворне мікро оточення. До стромальної підложки відносяться стромальні механоцити (фібробласти, ретикулярні клітини), макрофаги, клітини ендотелія та жирові клітини. В адгезивних підлдожках мишей більшість гетерогенної популяції клітин представлена фібробластами, які синтезують колагени І та ІІІ типів, фібронектин. Жирові клітини, які представлені в адгезивному шарі скоріш за все є видозміненими фібробластами. Фактично декстеровські культури – це багато компетентна тканинна система in vitro, в яких довготривало зберігаються морфогенетичні міжклітинні взаємодії. Застосування декстеровських культур: Так як, імунокомпетентні клітини гинуть в декстеровських культурах раніше, чим знижується кровотворення, то клітини із пізніх культур людини можуть використовуватись для відновлення гемопоезу у опромінених пацієнтів, не визиваючи реакцію на трансплантат. Можна також в довготривалих культурах видаляти лейкозні стовбурові клітини, а нормальні підсаджувати опроміненим хворим. Використовується для тестування біологічно активних речовин. Також може використовуватись для вірусологічних досліджень при введенні лейкогемонів та вірусів
Схожі презентації
Категорії