Презентація на тему:
"Пароутворення і конденсація"
Завантажити презентацію
"Пароутворення і конденсація"
Завантажити презентаціюПрезентація по слайдам:
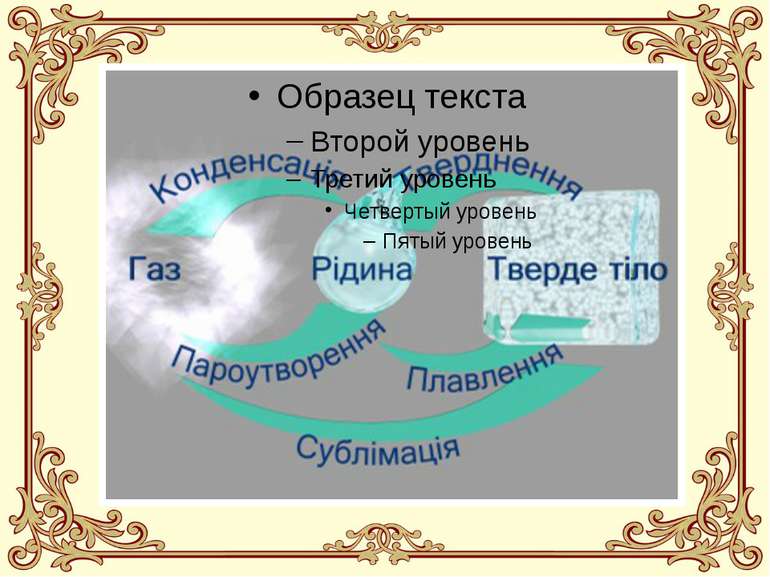
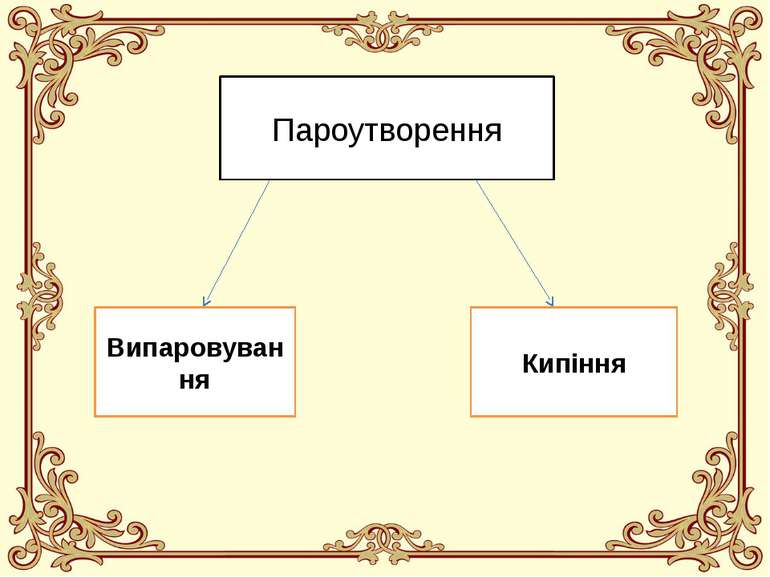
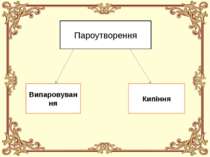
Що таке пароутворення? Пароутворення - це процес перетворення речовини із рідкого агрегатного стану у газоподібний агрегатний стан (перетворення рідини у пару).
Внутрішня енергія Внутрішня енергія речовини у газоподібному агрегатному стані завжди є більшою за внутрішню енергію цієї ж речовини у рідкому агрегатному стані. Пояснення цього факту спираються на означення поняття внутрішньої енергії речовини - суми кінетичної енергії руху її молекул та потенціальної енергії їх взаємодії. Сила взаємодії між молекулами речовини визначає модуль потенціальної енергії. Тому, вочевидь, модуль потенціальної енергії взаємодії молекул газів значно менший, ніж молекул рідин. Однак, потенціальна енергія взаємодії компонентів у будь-якій фізичній системі за означенням виражається від'ємним числом. Отже, в енергетичному порівняння величина внутрішньої енергії взаємодії молекул газів буде більшою, ніж молекул рідин.
Отже, під час пароутворення внутрішня енергія речовини неодмінно має збільшитись. Це безпосередньо означає, що для здійснення пароутворення необхідно надавати тепло рідині, яка перетворюється у пару. Однак, завдяки особливостям механізму пароутворення та на відміну від плавлення, пароутворення може відбуватись із самочинним поглинанням тепла із оточуючого середовища.
Випаровування Випаровування - це пароутворення на поверхні рідини. Випаровування відбувається за будь-якої температури та у будь-яких рідин, що мають вільну поверхню. Випаровування завжди супроводжується охолодженням рідини. Інтенсивність випаровування суттєво залежить від кількох зовнішніх чинників (дивіться наступний розділ конспекту).
Кипіння Кипіння - це пароутворення в об'ємі рідини. Кипіння відбувається лише за певної для даної рідини та даних умов температури. Під час кипіння рідини її температура не змінюється. Температура кипіння суттєво залежить від зовнішнього тиску.
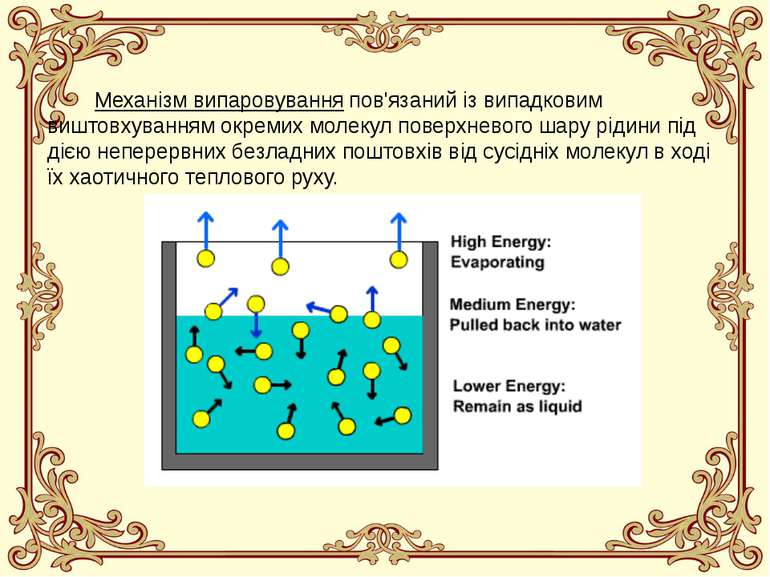
Механізм випаровування пов'язаний із випадковим виштовхуванням окремих молекул поверхневого шару рідини під дією неперервних безладних поштовхів від сусідніх молекул в ході їх хаотичного теплового руху.
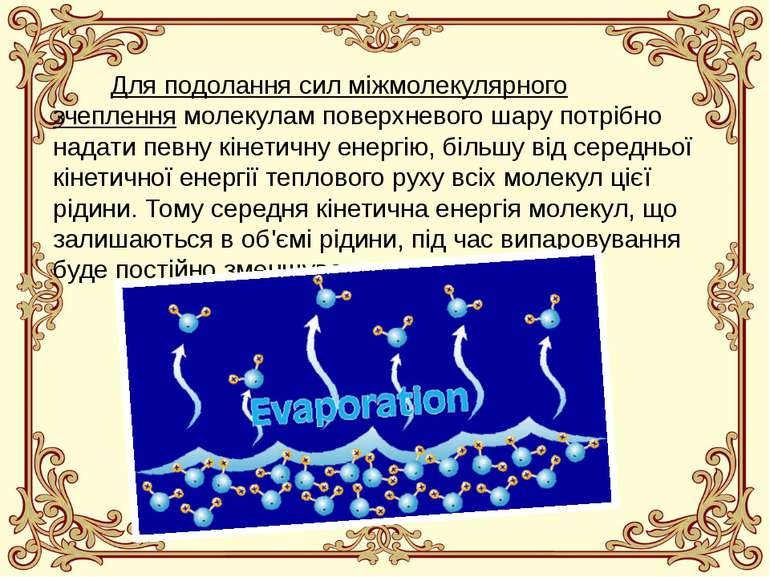
Для подолання сил міжмолекулярного зчеплення молекулам поверхневого шару потрібно надати певну кінетичну енергію, більшу від середньої кінетичної енергії теплового руху всіх молекул цієї рідини. Тому середня кінетична енергія молекул, що залишаються в об'ємі рідини, під час випаровування буде постійно зменшуватись.
Отже, випаровування буде завжди супроводжуватись охолодженням рідини. Саме цю властивість випаровування успішно застосовують в холодильниках та кондиціонерах, а також при наданні першої медичної допомоги для знеболювання при травмах. Прикладом охолоджуючої дії випаровування є ефект замерзання людини, яка щойно вийшла з води у спекотний літній день. На побутовому рівні емпіричним шляхом з давніх часів було винайдено охолоджуючий ефект посуду із сирої (пористої) глини або шкіри тварин, пронизаної капілярами.
З точки зору випадкового кінетичного механізму випаровування має існувати зворотній процес - випадкового кінетичного проникнення вільних молекул пари у поверхневий шар рідини. Цей процес називається зрідженням або конденсацією. Конденсація завжди супроводжує випаровування, але для відкритої поверхні за інтенсивністю (числом молекул, що повертаються до рідини за одиницю часу) - неодмінно відстає від нього. Тому загальне число молекул, що випаровуються за певний проміжок часу з вільної поверхні рідини, завжди більше від загального числа молекул, які за цей час повертаються назад. Виключенням із даної закономірності є утворення насиченої пари - пари, яка знаходиться у динамічній рівновазі із своєю рідиною, тобто, коли середнє число молекул рідини, що випаровуються, дорівнює середньому числу молекул пари, які конденсуються. Такі умови можливі лише у закритій посудині, або при 100% вологості повітря.
Закономірності випаровування Швидкість випаровування пропорційна площі вільної поверхні рідини. Швидкість випаровування пропорційна температурі рідини. Швидкість випаровування залежить від руху повітря поблизу поверхні рідини. Швидкість випаровування залежить від вологості повітря. Швидкість випаровування у різних рідин - різна.
Механізм кипіння Механізм кипіння пов'язаний із утворенням всередині об'єму рідини (на дні та стінках посудини) повітряних бульбашок, заповненням цих бульбашок парою під час внутрішнього випаровування, їх спливанням на поверхню рідини під дією архімедової сили, шумним руйнуванням бульбашок та виходом із них пари при досягненні поверхні рідини. В цілому, процес кипіння відрізняється від процесу випаровування саме великою інтенсивністю пароутворення: рідина при кипінні значно швидше (за менший проміжок часу) перетворюється у пару.
Основним механізмом початку кипіння є утворення бульбашок із повітря, розчиненого у рідині за певного зовнішнього тиску. При зниженні зовнішнього тиску рідина здатна закипіти і без попереднього нагрівання (в тому числі і за кімнатної температури), оскільки за малого тиску розчинене у рідині повітря або інший газ може утворювати бульбашки самочинно (як при відкриванні пляшки із газованими напоями).
При незмінному зовнішньому тиску на рідину вона здатна закипіти лише після нагрівання до певної температури (температури кипіння). Це пояснюється тим, що під час нагрівання рідини відбувається її теплове розширення, внаслідок якого зменшується густина цієї рідини. При зменшенні густини рідини, розчинність у ній повітря теж зменшується. Отже, утворення бульбашок та їх наповнення парою починається одразу із початком нагрівання. Однак, для початку спливання на поверхню бульбашок із парою, відповідно до закону Архімеда, є необхідним, щоб ці бульбашки досягли достатнього початкового об'єму. А от для розширення первинних бульбашок потрібно, щоб тиск пари в них переважав зовнішній тиск. Отже,оскільки тиск пари залежить від температури, то для кожного певного значення зовнішнього тиску існує певне фіксоване значення температури кипіння даної рідини.
Загальні закономірності кипіння умовою початку кипіння є нагрівання рідини до певної температури; умовою здійснення кипіння є неперервне надання рідині великої кількості теплоти; температура кипіння є різною для різних рідин; для даної рідини температура кипіння залежить від зовнішнього тиску: із зменшенням тиску температура кипіння зменшується і навпаки; кипіння зажди відбувається у декілька окремих стадій.
Основні стадії кипіння рідини у відкритій посудині - утворення первинних бульбашок повітря на дні та стінках посудини; - заповнення первинних бульбашок парою під час внутрішнього випаровування; - зростання тиску пари у бульбашках за рахунок нагрівання рідини; - збільшення розмірів бульбашок під дією внутрішнього тиску; - початок спливання бульбашок під дією архімедової сили; - шумове кипіння: при недостатньому початковому прогріванні верхніх шарів рідини перші бульбашки, що спливають, потрапляючи у холодніші шари рідини, стискаються із характерним шумом; - повне кипіння: при рівномірному прогріванні всіх шарів рідини розмір бульбашок по мірі спливання через зменшення гідростатичного тиску - збільшується, досягаючи поверхні, бульбашки із булькотінням руйнуються, випускаючи накопичену в них пару назовні.
Що це таке? Питома теплота пароутворення - це фізична величина, що є мірою кількості тепла, необхідного для перетворення у пару 1 кг даної рідини, попередньо нагрітої до температури її кипіння за даного зовнішнього тиску. Питома теплота пароутворення позначається літерою r та вимірюється у Дж/кг. Наприклад, питома теплота пароутворення води складає: r = 2257000 Дж/кг. Це означає, що для перетворення у пару 1 кг води, попередньо нагрітої до температури 100 0C за нормального атмосферного тиску необхідно 2257000 Дж теплоти Для розрахунку загальної теплоти пароутворення потрібно питому теплоту пароутворення даної рідини помножити на її масу: Qпар = r * m
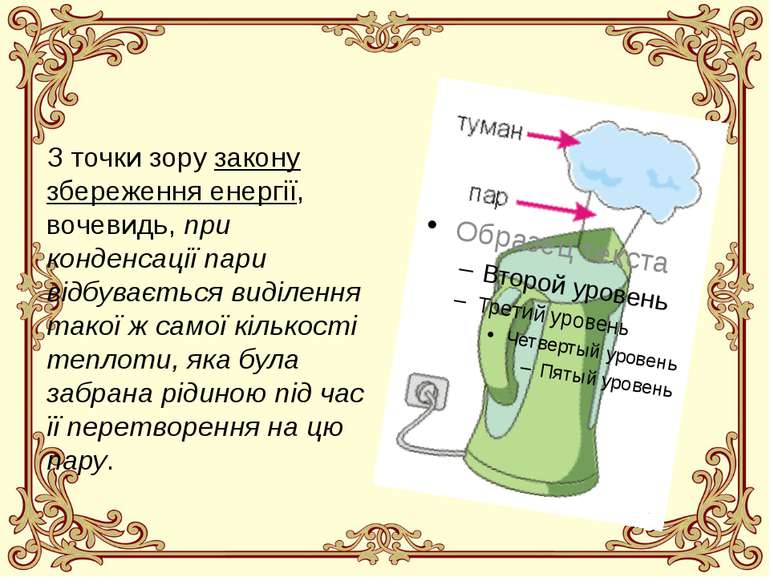
Що це таке? Конденсація - це зворотній процес перетворення речовини із газоподібного агрегатного стану у рідкий агрегатний стан (перетворення пари у рідину). Серед прикладів конденсації у природі найбільш важливими є такі, як випадіння роси, утворення туману, конденсація хмар, дощі та зливи тощо. Енергетичний баланс конденсації, через її зворотній характер, є оберненим до енергетичного балансу при пароутворенні: при перетворенні пари у рідину внутрішня енергія речовини зменшується, і тому конденсація завжди супроводжується виділенням теплоти
З точки зору закону збереження енергії, вочевидь, при конденсації пари відбувається виділення такої ж самої кількості теплоти, яка була забрана рідиною під час її перетворення на цю пару.
Закономірності конженсації конденсація може відбуватись за будь-якої температури; нтенсивність конденсації залежить від зовнішнього (атмосферного) тиску; інтенсивність конденсації залежить від вологості повітря: конденсація є найбільш інтенсивною при 100% вологості; оскільки вологість повітря залежить від температури, то для даного зовнішнього тиску конденсація відбувається при зниженні температури до певного значення - точки роси; питома теплота конденсації чисельно дорівнює питомій теплоті пароутворення.
Схожі презентації
Категорії