Презентація на тему:
Нитковая графика
Завантажити презентацію
Нитковая графика
Завантажити презентаціюПрезентація по слайдам:
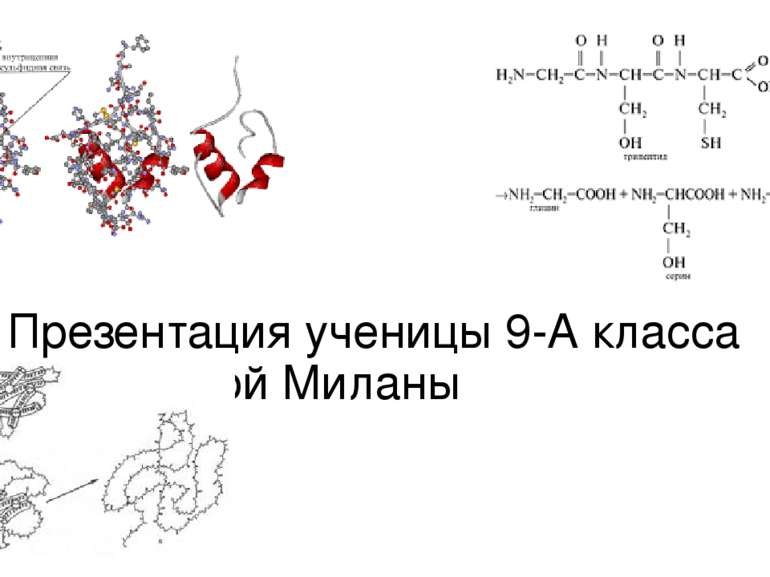
Белки Белки – сложные высокомолекулярные природные соединения, состоящие из a-аминокислот, соединенных пептидной связью. Число аминокислот, входящих в молекулы отдельных белков, различно, поэтому содержание элементов в них колеблется в достаточно широких пределах. Белки входят в состав всех живых организмов. Биологическая роль белков заключается в том, что они являются катализаторами химических реакций, протекающих в живых организмах. В настоящее время различают первичную, вторичную и третичную структуру белковой молекулы Первичная структура белка – последовательность соединения аминокислот в полипептидной цепи. Вторичная структура белка – форма полипептидной цепи в пространстве, т.е. способ скручивания цепи за счет образования водородных связей между амино- и карбонильной группами. Третичная структура белка – реальная трехмерная конфигурация закрученной спирали в пространстве. Определяющими факторами образования и удерживания третичной структуры белка являются связи между боковыми радикалами аминокислотных остатков (дисульфидные мостики –S–S–).
Свойства белков 1. Разная растворимость в воде. Растворимые белки образуют коллоидные растворы. 2. Гидролиз - под действием растворов минеральных кислот или ферментов происходит разрушение первичной структуры белка и образование смеси аминокислот. 3. Денатурация - частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Денатурация происходит под действием: - высокой температуры - растворов кислот, щелочей и концентрированных растворов солей - растворов солей тяжёлых металлов - некоторых органических веществ (формальдегида, фенола) - радиоактивного излучения
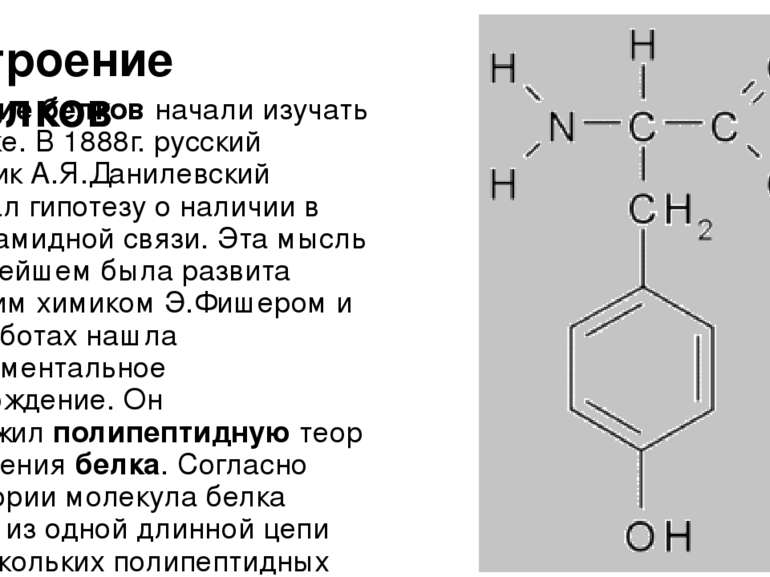
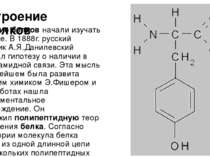
Строение белков Строение белков начали изучать в 19 веке. В 1888г. русский биохимик А.Я.Данилевский высказал гипотезу о наличии в белках амидной связи. Эта мысль в дальнейшем была развита немецким химиком Э.Фишером и в его работах нашла экспериментальное подтверждение. Он предложил полипептидную теорию строения белка. Согласно этой теории молекула белка состоит из одной длинной цепи или нескольких полипептидных цепей, связанных друг с другом. Такие цепи могут быть различной длины. Фишером проведена большая экспериментальная работа с полипептидами. Высшие полипептиды, содержащие 15-18 аминокислот, осаждаются из растворов сульфатом аммония (аммиачными квасцами), то есть проявляют свойства, характерные для белков. Было показано, что полипептиды расщепляются теми же ферментами, что и белки, а будучи введёнными в организм животного, подвергаются тем же превращениям, как и белки, а весь их азот выделяется нормально в виде мочевины (карбамида). Исследования, проведённые в 20 веке, показали, что существует несколько уровней организации белковой молекулы.
Стандартного набора 20 аминокислот. Последовательность аминокислотных остатков в молекуле белка называют первичной структурой белка. Свойства белков и их биологические функции определяются последовательностью аминокислот. Работы по выяснению первичной структуры белка впервые были выполнены в Кембриджском университете на примере одного из простейших белков - инсулина. В течение посте 10 лет английский биохимик Ф.Сенгер проводил анализ инсулина. В результате анализа выяснено, что молекула инсулина состоит из двух полипептидных цепей и содержит 51 аминокислотный остаток. Он установил, что инсулин имеет молярную массу 5687 г/моль, а его химический состав отвечает формуле C254H337N65O75S6. Анализ проводился вручную с использованием ферментов, которые избирательно гидролизуют пептидные связи между определёнными аминокислотными остатками. В настоящее время большая часть работы по определению первичной структуры белков автоматизирована. Так была установлена первичная структура фермента лизоцима. Тип "укладки" полипептидной цепочки называют вторичной структурой. У большинства белков полипептидная цепь свёртывается в спираль, напоминающую "растянутую пружину" (называют "А-спираль" или "А-стуктура"). Еще один распространённый тип вторичной структуры - структура складчатого листа (называют "B - структура"). Так, белок шёлка - фиброин имеет именно такую структуру. Он состоит из ряда полипептидных цепей, которые располагаются параллельно друг-другу и соединяются посредством водородных связей, большое число которых делает шёлк очень гибким и прочным на разрыв. При всём этом практически не существует белков, молекулы которых на 100% имеют "А-структуру" или "B - структуру".
Пространственное положение полипептидной цепи называют третичной структурой белкой. Большинство белков относят к глобулярным, потому что их молекулы свёрнуты в глобулы. Такую форму белок поддерживает благодаря связям между разнорзаряженными ионами (-COO- и -NH3+ и дисульфидных мостиков. Кроме того, молекула белка свёрнута так, что гидрофобные углеводородные цепи оказываются внутри глобулы, а гидрофильные - снаружи. Способ объединения нескольких молекул белка в одну макромолекулу называют четвертичной стуктурой белка. Ярким примером такого белка может быть гемоглобин. Было установлено, что, например, для взрослого человека молекула гемоглобина состоит из 4-х отдельных полипептидных цепей и небелковой части - гема. Свойства белков объясняет их различное строение. Большинство белков аморфно, в спирте, эфире и хлороформе нерастворимо. В воде некоторые белки могут растворяться с образованием коллоидного раствора. Многие белки растворимы в растворах щелочей, некоторые - в растворах солей, а некоторые - в разбавленном спирте. Кристаллическое состояние белов встречается редко: примером могут быть алейроновые зёрна, встречающиеся в клещевине, тыкве, конопле. Кристаллизуется также альбумин куриного яйца и гемоглобин в крови.
Гидролиз белков При кипячении с кислотами или щелочами, а также под действием ферментов белки распадаются на более простые химические соединения, образуя в конце цепочки превращения смесь A-аминокислот. Такое расщепление называется гидролизом белка. Гидролиз белка имеет большое биологическое значение: попадая в желудок и кишечник животного или человека, белок расщепляется под действием ферментов на аминокислоты. Образовавшиеся аминокислоты в дальнейшем под влиянием ферментов снова образуют белки, но уже характерные для данного организма! В продуктах гидролиза белков кроме аминокислот были найдены углеводы, фосфорная кислота, пуриновые основания. Под влиянием некоторых факторов например, нагревания,растворов солей, кислот и щелочей, действия радиации, встряхивания, может нарушиться пространственная структура, присущая данной белковой молекуле. Денатурация может носить обратимый или необратимый характер, но в любом случае аминокислотная последовательность, то есть первичная структура, остаётся неизменной. В результате денатурации белок перестаёт выполнять присущие ему биологические функции. Для белков известны некоторые цветные реакции, характерные для их обнаружения. При нагревании мочевины образуется биурет, который с раствором сульфата меди в присутствии щелочи даёт фиолетовое окрашивание или качественная реакция на белок, которую можно провести дома). Биуретовую реакцию даёт вещества, содержащие амидную группу, а в молекуле белка эта группа присутствует. Ксантопротеиновая реакция заключается в том, что белок от концентрированной азотной кислоты окрашивается в жёлтый цвет. Эта реакция указывает на наличие в белке бензольной группы, которая имеется в таких аминокислотах, как фениланин и тирозин. При кипячении с водным раствором нитрата ртути и азотистой кислоты, белок даёт красное окрашивание. Эта реакция указывает на наличие в белке тирозина. При отсутствии тирозина красного окрашивания не появляется.
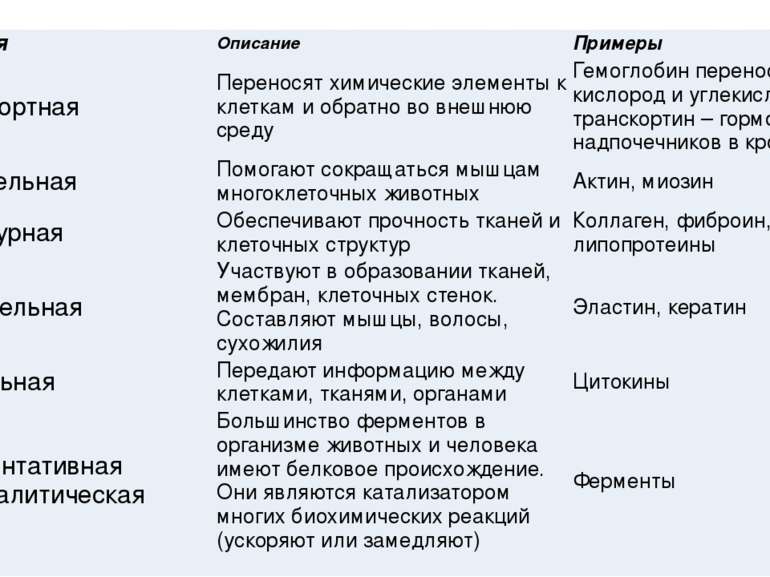
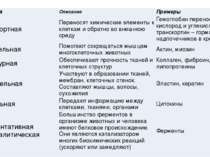
Функция Описание Примеры Транспортная Переносят химические элементы к клеткам и обратно во внешнюю среду Гемоглобин переносит кислород и углекислый газ,транскортин– гормон надпочечников в кровь Двигательная Помогают сокращаться мышцам многоклеточных животных Актин, миозин Структурная Обеспечивают прочность тканей и клеточных структур Коллаген, фиброин, липопротеины Строительная Участвуют в образовании тканей, мембран, клеточных стенок. Составляют мышцы, волосы, сухожилия Эластин, кератин Сигнальная Передают информацию между клетками, тканями, органами Цитокины Ферментативнаяиликаталитическая Большинство ферментов в организме животных и человека имеют белковое происхождение. Они являются катализатором многих биохимических реакций (ускоряют или замедляют) Ферменты
Функция Описание Примеры Регуляторная или гормональная Гормоны белкового происхождения контролируют и регулируют процессы метаболизма Инсулин,лютропин,тиротропин Генно-регуляторная Регулируют функции нуклеиновых кислот при переносе генетической информации Гистоны регулируют репликацию и транскрипцию ДНК Энергетическая Используется как дополнительный источник энергии. При распаде 1 г высвобождается 17,6 кДж Распадаются после исчерпывания других источников энергии – углеводов и жиров Защитная Специфичные белки – антитела – предохраняют организм от заражения, уничтожая чужеродные частицы. Особые белки сворачивают кровь, останавливая кровотечение Иммуноглобулины, фибриноген, тромбин Запасающая Запасаются для питания клеток. Удерживают необходимые организму вещества Ферритинудерживает железо, казеин,глютен, альбумин запасаются в организме Рецепторная Удерживают различные регуляторы (гормоны, медиаторы) на поверхности или внутри клетки Глюкагоновыйрецептор,протеинкиназа
Схожі презентації
Категорії