Презентація на тему:
Метали
Завантажити презентацію
Метали
Завантажити презентаціюПрезентація по слайдам:
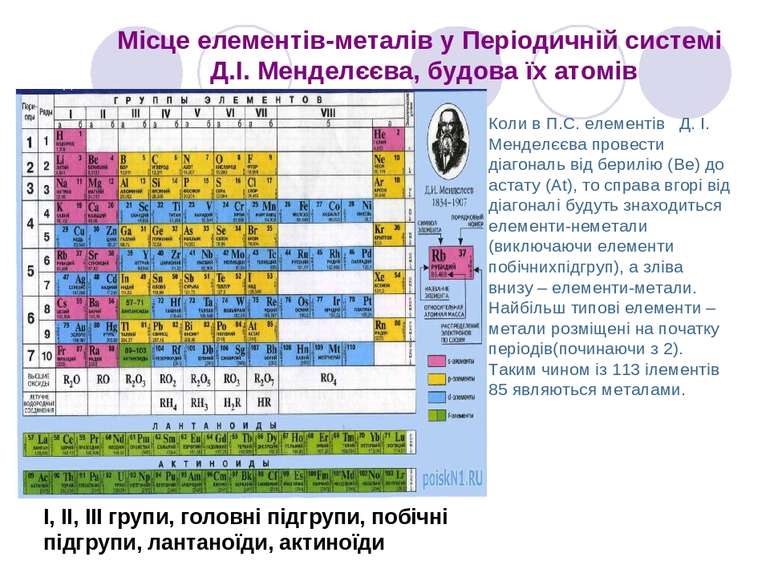
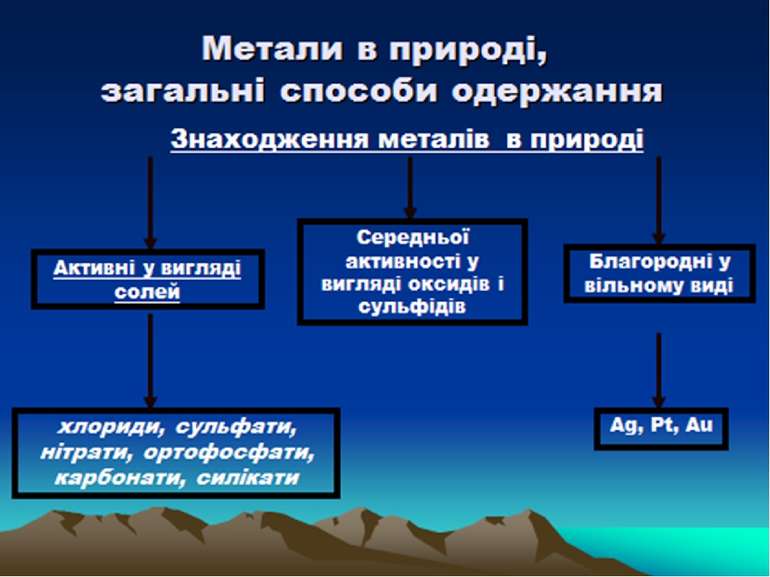
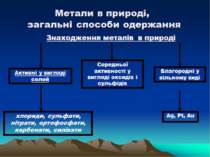
Місце елементів-металів у Періодичній системі Д.І. Менделєєва, будова їх атомів І, ІІ, ІІІ групи, головні підгрупи, побічні підгрупи, лантаноїди, актиноїди Коли в П.С. елементів Д. І. Менделєєва провести діагональ від берилію (Be) до астату (At), то справа вгорі від діагоналі будуть знаходиться елементи-неметали (виключаючи елементи побічнихпідгруп), а зліва внизу – елементи-метали. Найбільш типові елементи – метали розміщені на початку періодів(починаючи з 2). Таким чином із 113 ілементів 85 являються металами.
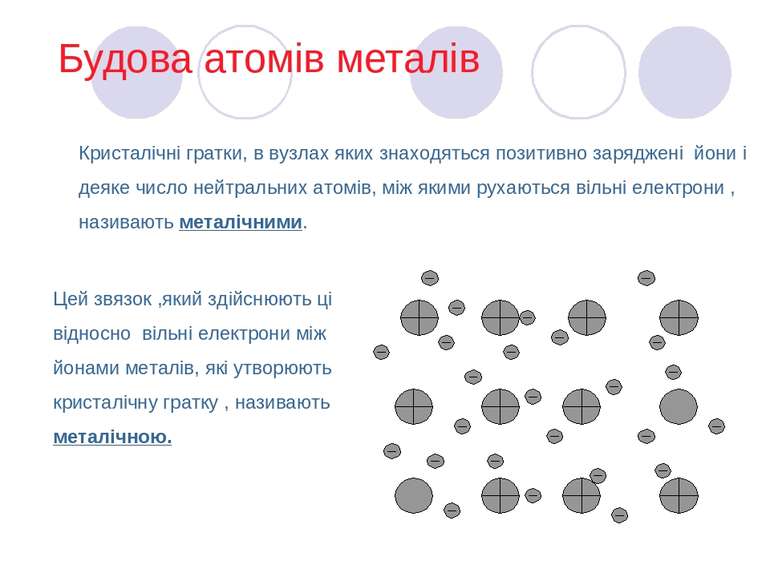
Будова атомів металів Кристалічні гратки, в вузлах яких знаходяться позитивно заряджені йони і деяке число нейтральних атомів, між якими рухаються вільні електрони , називають металічними. Цей звязок ,який здійснюють ці відносно вільні електрони між йонами металів, які утворюють кристалічну гратку , називають металічною.
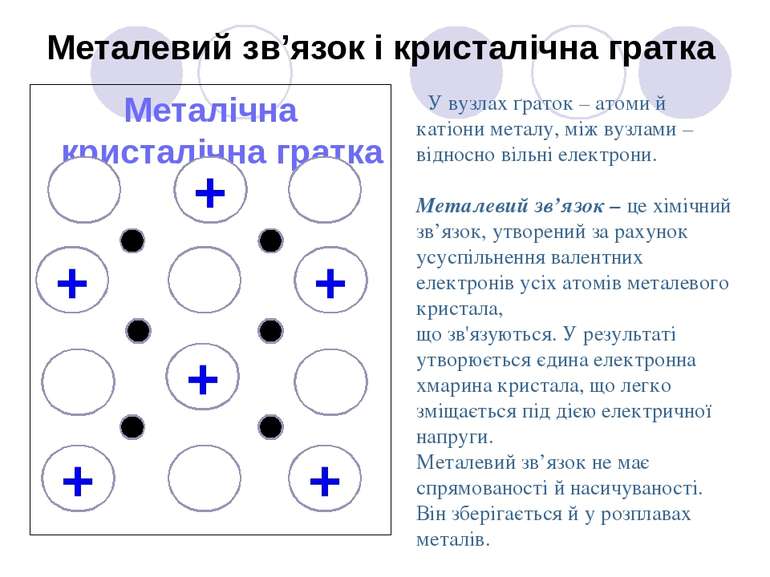
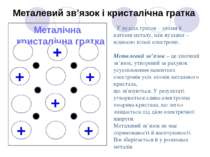
Металічна кристалічна гратка Металевий зв’язок і кристалічна гратка + + + + У вузлах ґраток – атоми й катіони металу, між вузлами – відносно вільні електрони. Металевий зв’язок – це хімічний зв’язок, утворений за рахунок усуспільнення валентних електронів усіх атомів металевого кристала, що зв'язуються. У результаті утворюється єдина електронна хмарина кристала, що легко зміщається під дією електричної напруги. Металевий зв’язок не має спрямованості й насичуваності. Він зберігається й у розплавах металів. + +
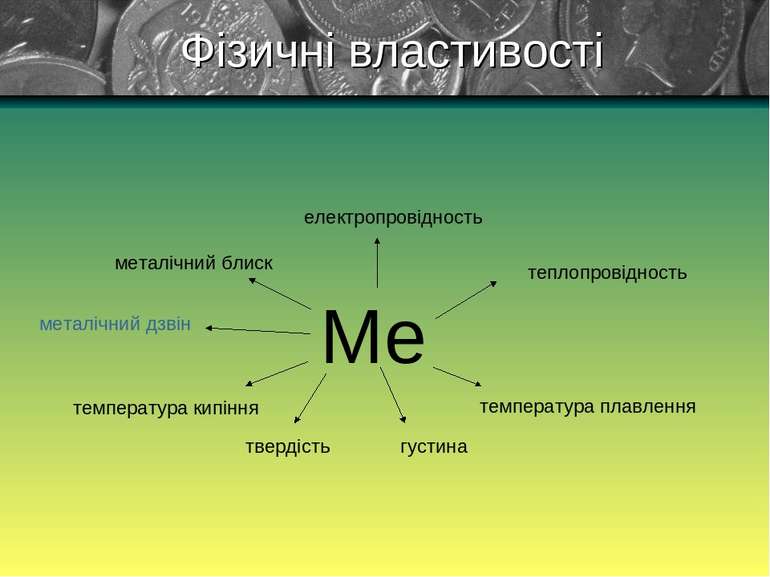
1) Для всіх металів характерний металічний блиск, сірий колір і непрозорість пояснюються наявністю вільних електронів . 2) Метали володіють електричною провідністю, це пояснюються наявністю вільних електронів. Найбільшою електричною провідністю володіють срібло і мідь. За ними - золото, алюміній, залізо. Фізичні властивості Електричний струм– це напрямлений рух заряджених частинок.
Загальні хімічні властивості: Найбільш активно метали реагують з простими речовинами (неметалами): галогенами киснем сіркою Ca - відновник Mg - відновник Na - відновник
Метали, гідроксиди яких амфотерні, як правило взаємодіють з розчинами кислот і лугів. Основна властивість металів – вони відновники. Метали можуть утворювати хімічні сполуки між собою.Вони мають загальну назву – інтерметалічні сполуки або інтерметаліди. Прикладом є сполуки деяких металів з сурмою: Na2Sb, Ca3Sb, NiSb, Ni4Sb, FeSbx (х = 0,72 – 0,92). В них найчастіше всього не зберігаються ступені окиснення, характерні в сполуках з неметалами. Загальні хімічні властивості .
Загальні хімічні властивості (продовження) Метали можуть окиснюватися також йонами Гідрогену та йонами інших металів. Метали реагують з складними речовинами : водою: кислотами: растворами солей: Na - відновник Fe - відновник Zn - відновник
Взаємодія лужного металу з водою 2Na + 2H2O = 2NaOH + H2 Активні метали, що стоять у ряду стандартних електродних потенціалів до Алюмінію включно, реагують із водою з утворенням основ і водню
Електрохімічний ряд напруг Цей ряд називається електрохімічним рядом напруг. Енергія іонізаціі, визначається положенням металу в періодичній системі. В електрохімічному ряду напруг метал, який стоїть лівіше, може витіснити із розчину або розплаву солей метал, який стоїть правіше.Користуючись цим рядом, можно передбачити, як Ме буде себя вести в парі з іншим . В електрохімічному ряді напруг розміщений Гідроген .Це дозволяє зробити висновок про Ме ,які можуть витіснити водень із розчинів кислот. Так , наприклад, залізо витісняє водень із розчинів кислот, так как знаходиться лівіше нього; мідь же не витісняє водень, так как знаходиться правіше нього.
Корозія металів Корозія – це хімічне і електрохімічне руйнування металів та їх сплавів в результаті взаємодії на них зовнішнього середовища. Існує два види корозії: хімічна і електрохімічна . Електрохімічна корозія Корозію Ме та їх сплавів викликають такі компоненти зовнішнього середовища , як вода, кисень, оксиди карбону і сульфуру , водні розчини солей. Більш активний Ме при електрохімічній корозії руйнується, переходячи в воду, тим самим захищає менш активний від руйнування.
Цікаві відомості про ЗОЛОТО: Температура плавлення золота дорівнює 1064,43 градуси за Цельсієм. Цей метал відмінно проводить тепло і електрика, ніколи не іржавіє. Золото - один із самих коштовних металів. Висока вартість золота стала підмогою для активного розвитку копалень у різних куточках планети. Тим не менше, вважається, що 80% загальних запасів дорогоцінного металу до цих пір знаходяться в надрах Землі. Золото - дуже гнучкий метал. З нього можна виготовляти швейні нитки. Одна унцій золота (28,35 грама) може бути розтягнута на 80 кілометрів. одного з найбільших золотих самородків дорівнював 72 кг, його розміри становили - 31 × 63,5 см. Золото - хімічно інертна речовина, тому воно ніколи не іржавіє і не викликає подразнення шкіри. Якщо ювелірний виріб із золота викликало алергічну реакцію, значить, в сплав доданий інший метал. Медалі для переможців олімпійських ігор були відлиті з золота цілком. У сучасних медалях золотом покривається лише «зовнішня оболонка». На це витрачається 6 грамів дорогоцінного металу. Вага золота в каратах може становити 10, 12, 14, 18, 22 або 24. Чим більше цей показник, тим вище якість золота. «Чисте золото» вважається з мінімальною вагою в 10 карат. «Найчистіше золото» - 24 карата, однак і в ньому міститься невелика кількість міді. Чисте золото настільки м'яке і пластичне, що його можна формувати вручну.
Схожі презентації
Категорії