Презентація на тему:
"Електроліз"
Завантажити презентацію
"Електроліз"
Завантажити презентаціюПрезентація по слайдам:
Електроліз – розклад речовин (наприклад, води, розчинів кислот, лугів, розчинених або розплавлених солей тощо) постійним електричним струмом. Електроліз полягає в електрохімічних процесах окиснення та відновлення на електродах. При електролізі позитивно заряджені йони (катіони) рухаються до катода, на якому електрохімічно відновлюються. Негативно заряджені йони (аніони) рухаються до анода, де електрохімічно окиснюються. В результаті електролізу на електродах виділяються речовини в кількостях, пропорційних кількості пропущеного струму.
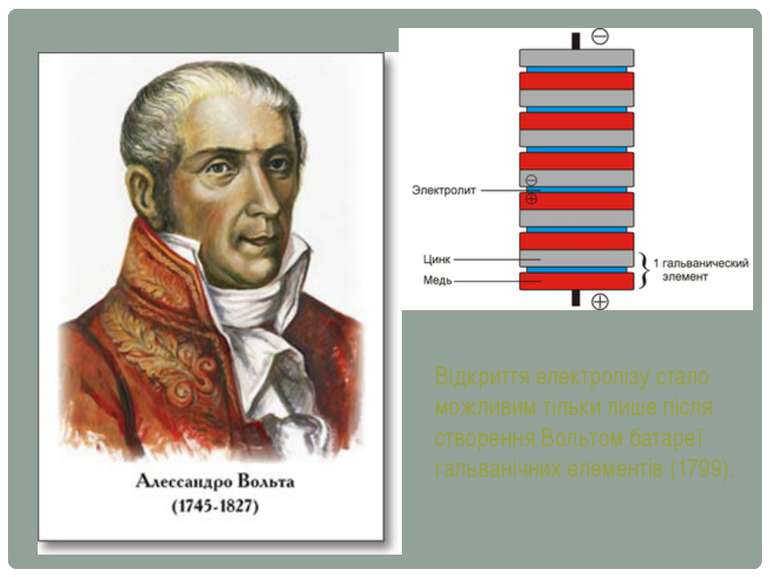
Відкриття електролізу стало можливим тільки лише після створення Вольтом батареї гальванічних елементів (1799).
Закони Фарадея m=kq де k – електрохімічний еквівалент речовини, m - маса речовини, q - заряд . Перший закон: маса m речовини, яка виділилась на електроді під час проходження електричного струму, прямо-пропорційна значенню q електричного заряду, пропущеного через електроліт,
Де A - атомна маса речовини, - заряд її йона, F - число Фарадея. Частка A/ν називається хімічним еквівалентом. Другий закон: електрохімічні еквіваленти елементів прямо-пропорційні їх хімічним еквівалентам.
Вперше паралельне з'єднання приймачів електричного струму запропонував російський фізик В. В. Петров під час дослідів з електролізу. Учений проводив одночасне розкладання води в декількох скляних трубках, приєднаних до одного джерела струму.
Електрохімічні процеси широко застосовуються в різних галузях сучасної техніки, в аналітичній хімії, біохімії і т. д. У кольоровій металургії електроліз використовується для добування металів з руд та їх очищення. Електролізом з розплавлених середовищ отримують алюміній, магній, титан, цирконій, уран, берилій. Електроліз в гідрометалургії є однією з стадій переробки металовмісткої сировини, що забезпечує отримання товарних металів.
Гальванотехніка - область прикладної електрохімії, що займається процесами нанесення металевих покриттів на поверхню як металевих, так і неметалевих виробів при проходженні постійного електричного струму через розчини їх солей. Гальванотехніка ділиться на гальваностегію і гальванопластику.
Гальваностегія - це електроосадження на поверхню металу іншого металу, який міцно зв'язується (зчіплюється) з покриваючим металом (предметом), що служить катодом електролізера. Перед покриттям вироби необхідно ретельно очистити, в іншому випадку метал буде осідати нерівномірно, і зв'язок металу з поверхнею виробу буде нестійким. Способом гальваностегіі можна покрити деталь тонким шаром золота або срібла, хрому або нікелю. За допомогою електролізу можна наносити найтонші металеві покриття на різні металеві поверхні. При такому способі нанесення покриттів, деталь використовують як катод, який міститься у розчину солі того металу, покриття з якого необхідно отримати. В якості анода використовується пластинка з того ж металу.
Гальванопластика - одержання шляхом електролізу точних, легко відокремлюваних металевих копій щодо значної товщини з різних як неметалічних, так і металевих предметів, які називаються матрицями.
Застосування електролізу в інших галузях: Електрохімічна обробка поверхні металевого виробу (поліровка); Електрохімічне фарбування металів (наприклад, міді, латуні, цинку, хрому та ін); Очищення води - видалення з неї розчинних домішок. В результаті виходить так звана м'яка вода
Схожі презентації
Категорії