Презентація на тему:
Електроліз
Завантажити презентацію
Електроліз
Завантажити презентаціюПрезентація по слайдам:
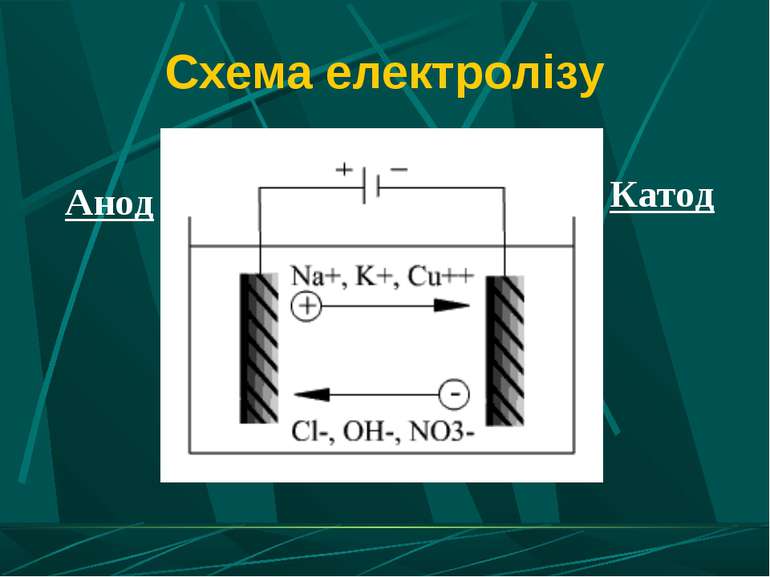
Электроліз - Це окислювально-відновний процес, що протікає під впливом постійного електричного струму. Протікає в електролітах при наявності рухливих іонів, а вони є в розчинах чи розплавах.
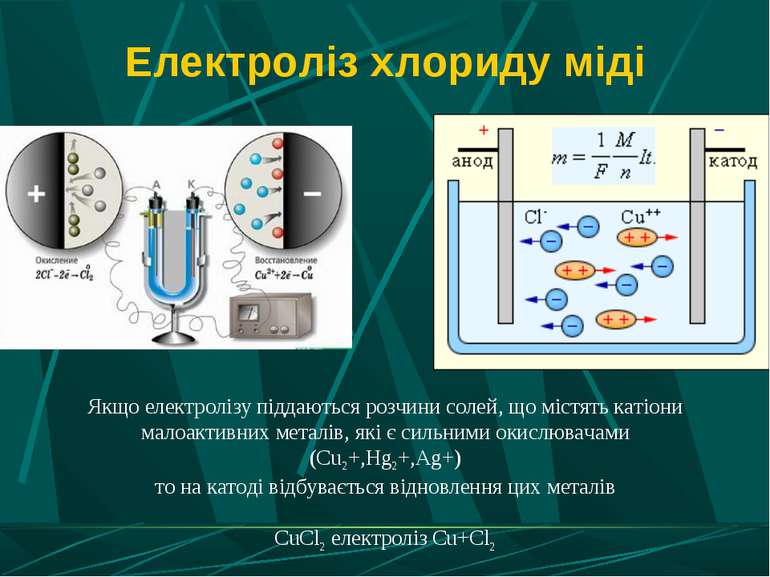
Електроліз хлориду міді Якщо електролізу піддаються розчини солей, що містять катіони малоактивних металів, які є сильними окислювачами (Cu2+,Hg2+,Ag+) то на катоді відбувається відновлення цих металів CuCl2 електроліз Cu+Cl2
Запам’ятайте! Сутність електролізу - протікання таких реакцій під дією струму, які мимовільно йти не можуть. Для визначення продуктів електролізу необхідно використовувати ряд напруг металів і окислювальний ряд аніонів.
Правила визначення продуктів електролізу на катоді Продукти від матеріалу катода не залежать. Користуватися рядом напруг металів: Якщо метал до Mn, відновлюється вода з утворенням Н2. Якщо метал після Н2 , відновлюється метал. Якщо метал між Al та Н2, то процеси конкурують, відновлюється метал та вода з виділенням Н2.
Правила визначення продуктів електролізу на аноді Продукти залежать від матеріалу анода. Нерозчинні (інертні) аноди – графіт, золото, платина – не беруть участі в електролізі. Розчиний анод (метал) окислюєтся в електролізі, недивлячись на природу аніона.
Правила визначення продуктів електролізу на аноді Якщо аніон кисневмісний, або іон F-1, то окислюєтся вода з утворенням О2. Якщо це аніон безкисневої кислоти, Cl-,Br -,I-,S2-,то він окислюется і утворюється неметал (Cl2,Br2,I2,S).
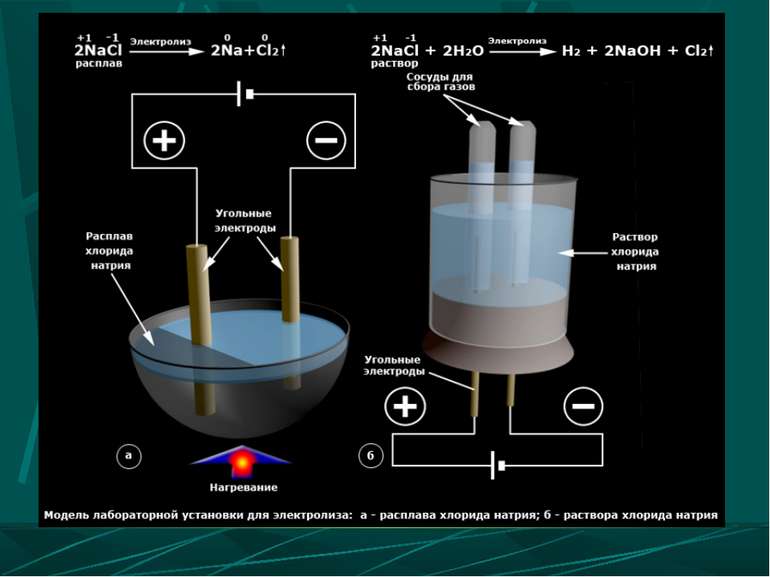
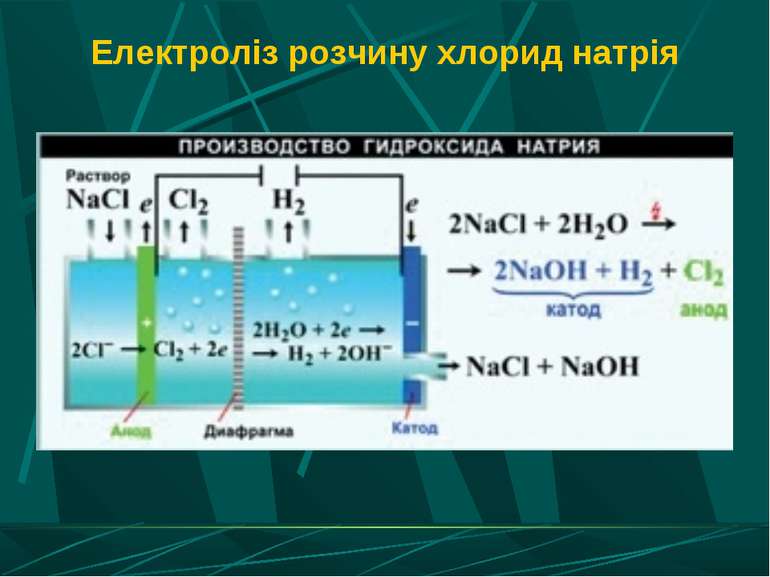
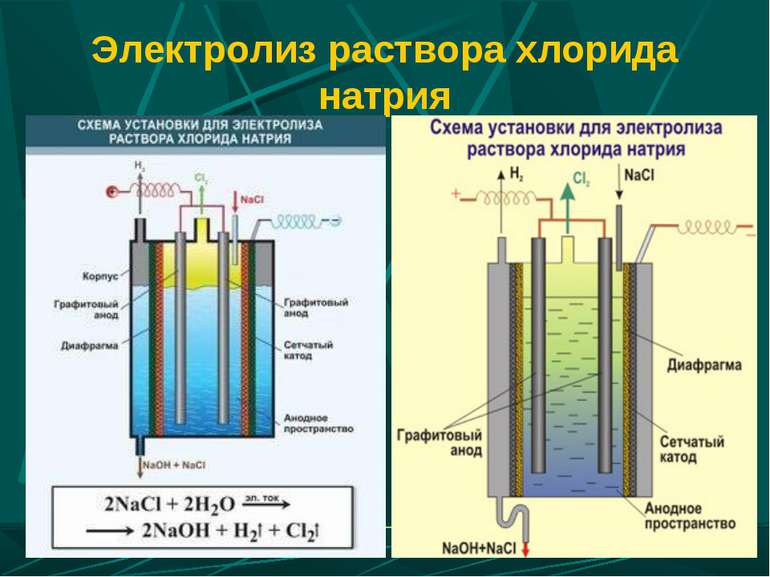
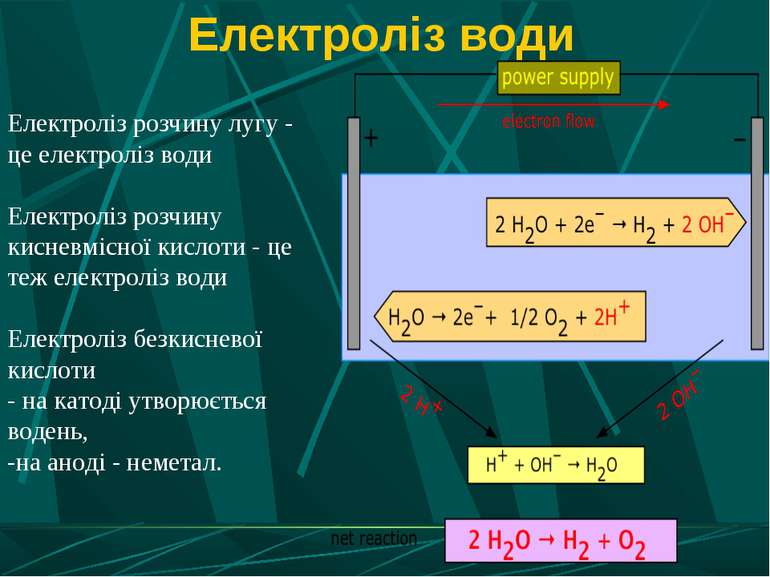
Електроліз води Електроліз розчину лугу - це електроліз води Електроліз розчину кисневмісної кислоти - це теж електроліз води Електроліз безкисневої кислоти - на катоді утворюється водень, -на аноді - неметал.
Продукти на аноді 2- 2- 2- - 2- 2- 2- 3- - - Розряджаються на аноді Не разряжаются, так A(+)2Cl-2e=Cl2 як відбувається окислення іона ОН- воды: A(+)2H2O-4e=O2+4H+ S I Br C l OH SO4 NO3 CO3 PO4 F
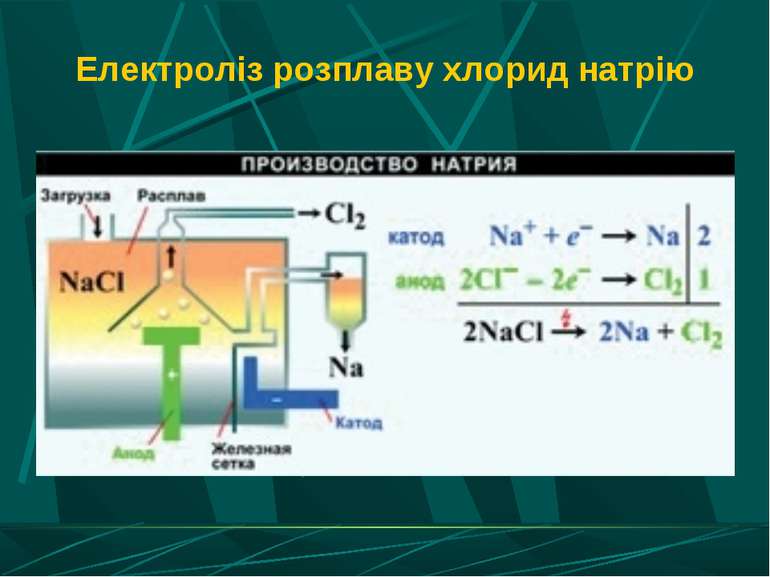
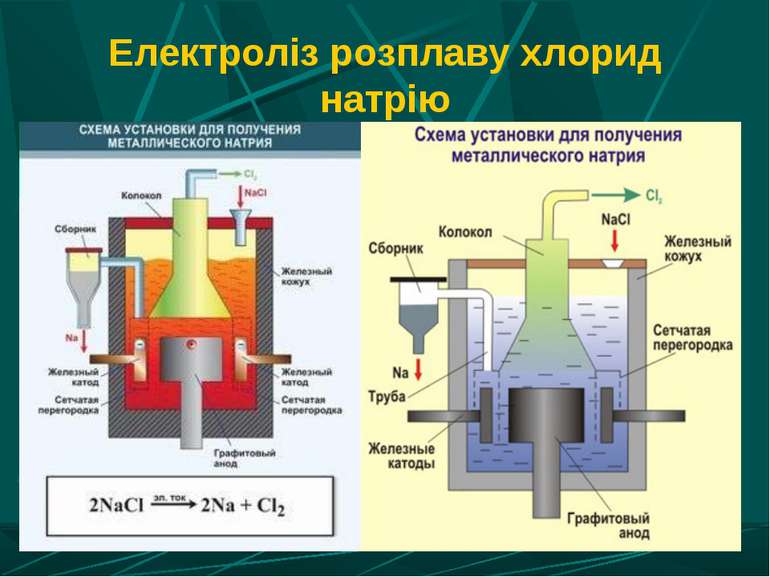
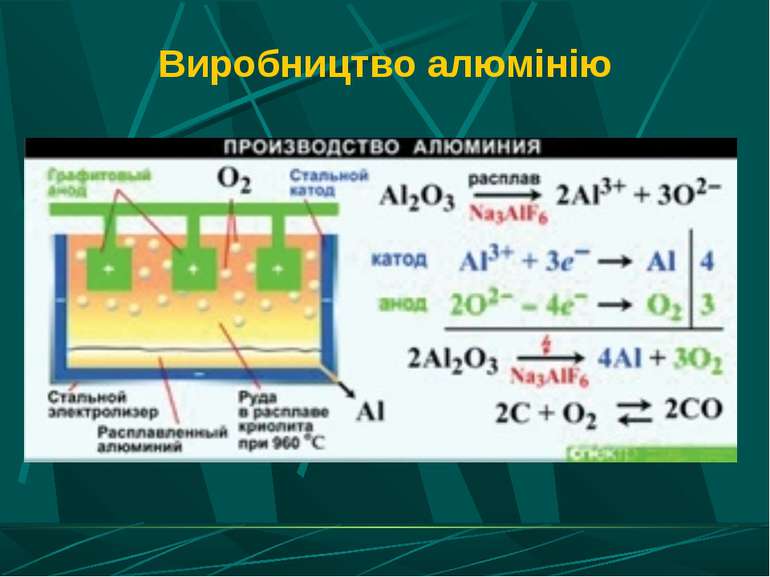
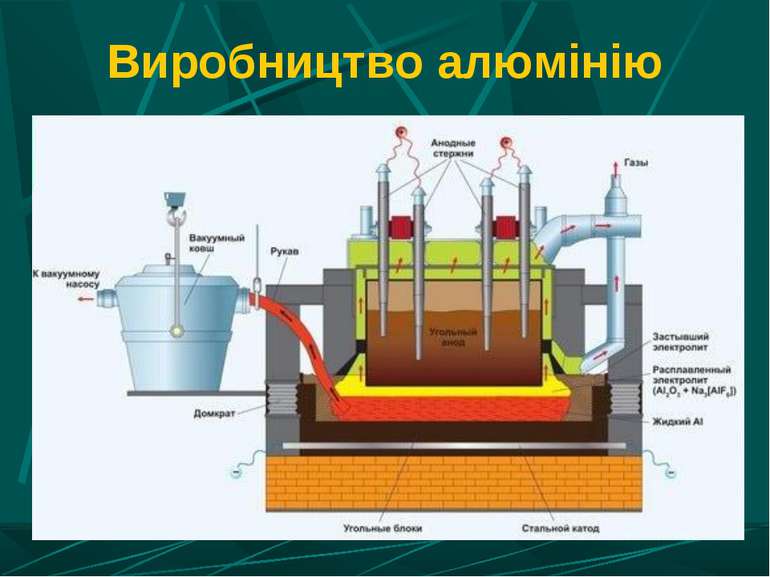
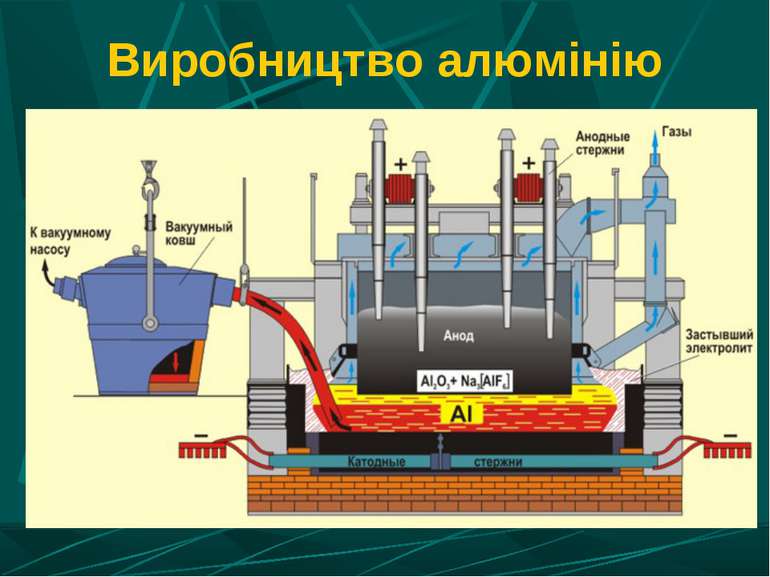
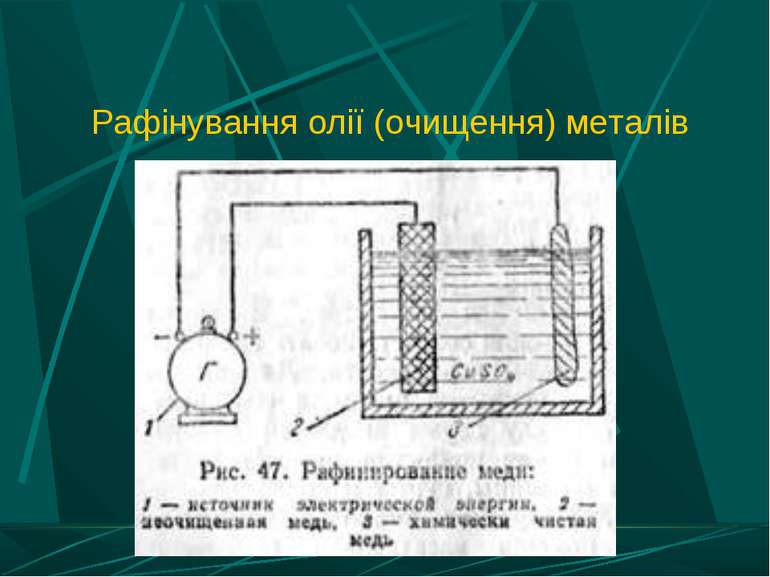
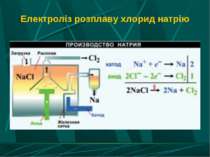
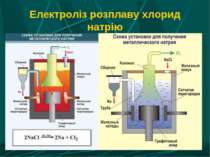
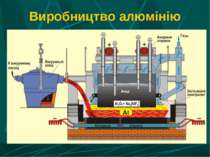
Застосування електролізу в металургії Отримання лужних і лужноземельних металів з розплавів солей галогенів. Одержання алюмінію з розплаву оксиду алюмінію в кріоліті. Отримання малоактивних металів з розчинів солей. Рафінування олії (очищення металів).
Застосування електролізу Отримання галогенів, водню. Отримання лугів. Електросинтез органічних речовин. Гальванопластика - нанесення захисних антикорозійних покриттів. Гальванопластика - отримання металевих копій, пластинок і т.д. Електрохімічне полірування, свердління і т.д.
Гідроелектрометаллургія - важлива галузь металургії кольорових металів (Сu, Bi, Sb, Sn, Pb, Ni, Co, Cd, Zn); застосовується для отримання благородних і розсіяних металів, Мn, Сr. Електроліз використовують безпосередньо для катодного виділення металу після того, як він переведений з руди в розчин, а розчин підданий очищенню.
Застосування електролізу Гальваностегія Електрофорез Гальванопластика Цинкування Нікелювання
Схожі презентації
Категорії