Презентація на тему:
Електричний струм в рідинах. Версія 1
Завантажити презентацію
Електричний струм в рідинах. Версія 1
Завантажити презентаціюПрезентація по слайдам:
H2O Вода з водопроводу провідник H2O Дистильована вода діелектрик Розчин HNO3 провідник Розчин KOH провідник Розчин NaCl провідник
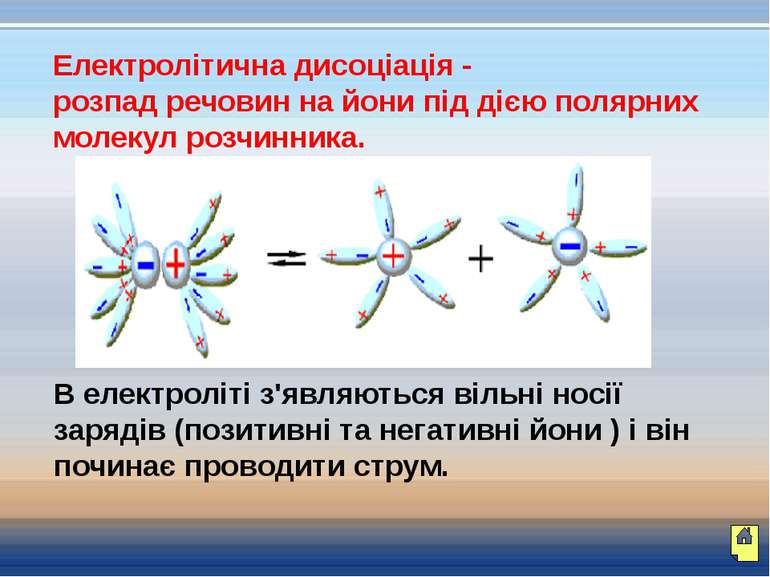
Чому? Чому деякі рідини проводять електричний струм, а деякі – ні? При розчиненні солі у воді з'являються вільні носії електричних зарядів.
Як виникають вільні носії електричних зарядів? При зануренні кристала в воду до позитивних іонів натрію, що знаходяться на поверхні кристала, молекули води притягуються своїми негативними полюсами. До негативних іонів хлору молекули води повертаються позитивними полюсами. Як називається цей процес?
Електролітична дисоціація - розпад речовин на йони під дією полярних молекул розчинника. В електроліті з'являються вільні носії зарядів (позитивні та негативні йони ) і він починає проводити струм.
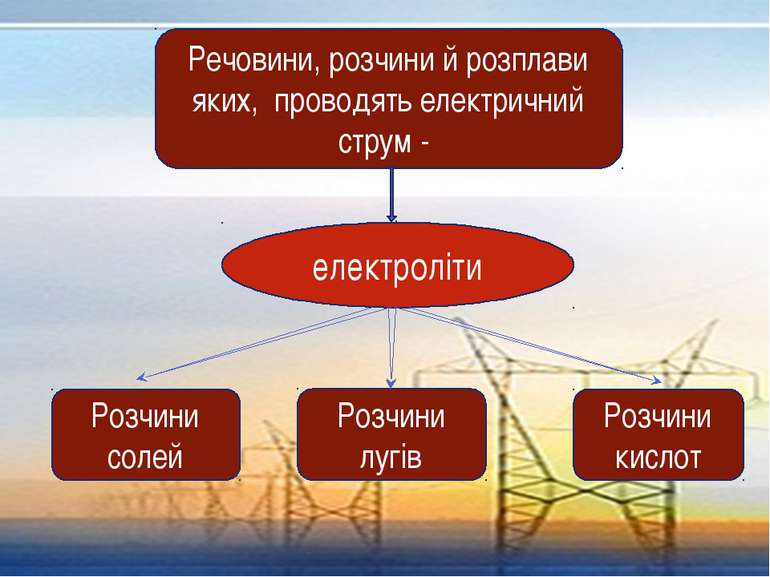
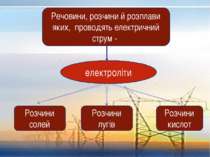
Речовини, розчини й розплави яких, проводять електричний струм - електроліти Розчини солей Розчини лугів Розчини кислот
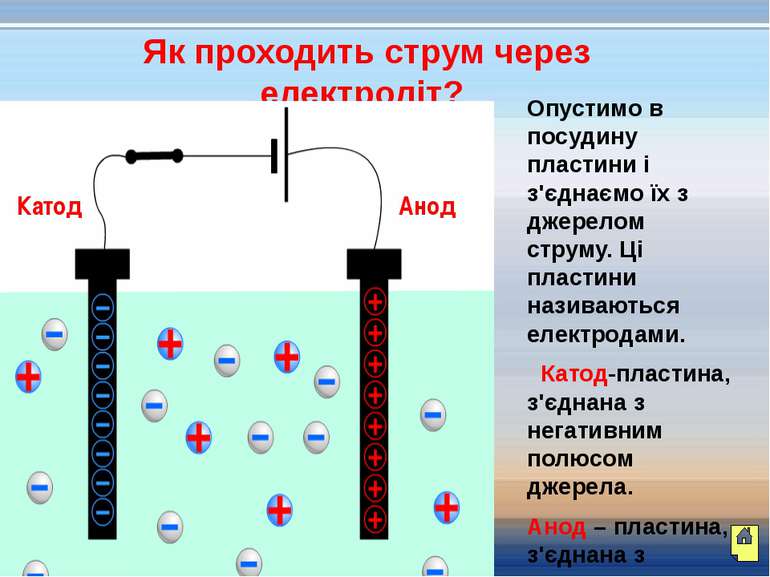
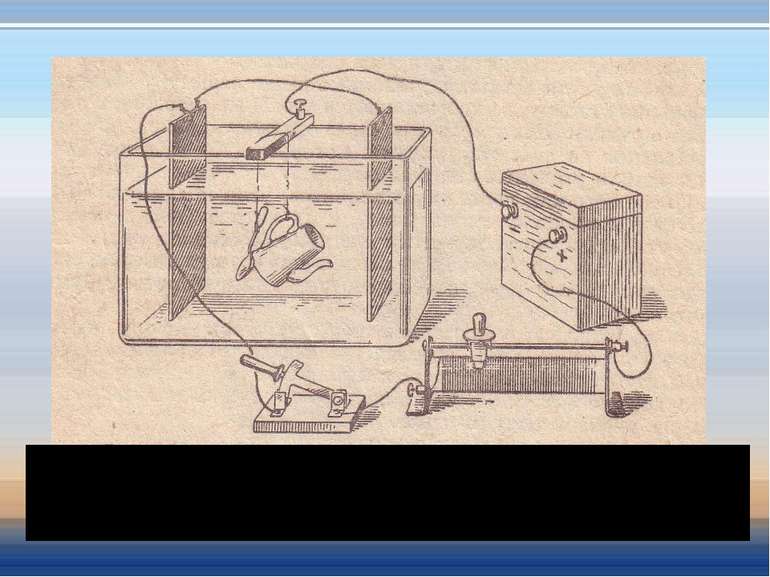
Як проходить струм через електроліт? Опустимо в посудину пластини і з'єднаємо їх з джерелом струму. Ці пластини називаються електродами. Катод-пластина, з'єднана з негативним полюсом джерела. Анод – пластина, з'єднана з позитивним полюсом джерела. Катод Анод
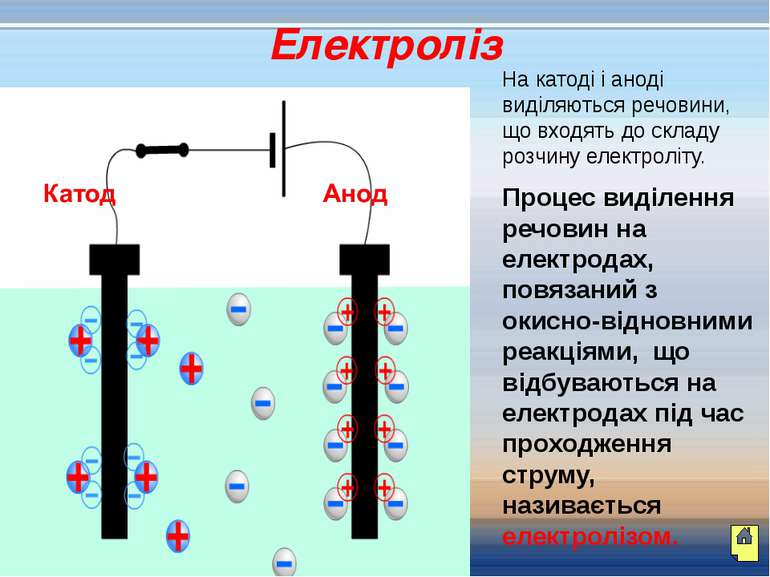
На катоді і аноді виділяються речовини, що входять до складу розчину електроліту. Процес виділення речовин на електродах, повязаний з окисно-відновними реакціями, що відбуваються на електродах під час проходження струму, називається електролізом. Електроліз
Якби у світовій історії не з'явився такий чоловік, як Майкл Фарадей, то наше життя навряд чи було б таким, як воно є зараз. У нас би не було комп'ютерів, не було б електрики, не було б нержавіючої сталі, не було б мідних проводів, алюмінієвих ложок і ще багато чого. Але він з´явився і зробив стільки найбільших відкриттів, кожне з яких могло б зробити його успішним, навіть якщо б він не відкрив більше нічого. Майкл Фарадей (1791-1867) — англійський фізик
Маса m речовини, яка виділяється на електроді під час електролізу, пропорційна силі струму І та часу t його проходження через електроліт. m = k I t Закон электроліза
Застосування електроліза I Хімічна промисловість II Металургія III Гальванотехніка Гальванопластика Гальваностегія
Гальванопластика - це процес отримання точних металевих копій шляхом електроосадження металу.
У 1837р. російський вчений Б. С. Якобі відкрив спосіб отримання абсолютно точних рельєфних копій предмета.
Словолитний гальванопластичний стереотипний заклад І. Гольдберга в Санкт-Петербурзі. Копія з гравюри на дереві
метод «Ланцюжка» (доповнити речення): Електроліти — це розчини... Носіями електричного заряду в електролітах є... Електролітична дисоціація — це… Електроліз — це... Маса речовини, яка виділяється на електроді пропорційна… Підсумуємо:
ДОМАШНЄ ЗАВДАННЯ • Вивчити §19, розв´язати №6;7 (картка) • Підготувати повідомлення про використання електролізу.
Схожі презентації
Категорії