Презентація на тему:
Досліди Розерфорда. Ядерна модель
Завантажити презентацію
Досліди Розерфорда. Ядерна модель
Завантажити презентаціюПрезентація по слайдам:
Атом – сложная нейтральная частица Понятие атом возникло еще в античном мире для обозна-чения частиц вещества. В переводе с греческого атом означает «неделимый». Атом любого химического элемента-как бы крохотная Солнечная система.
Основные характеристики элементарных частиц Частица и Ее обозначение Масса Заряд Примечание Протон -p+ 1 +1 Число протонов равно порядковому номеру элемента Нейтрон –п0 1 0 Число электронов находят по формуле: N=A-Z Электрон е- 1/1837 -1 Число электронов равно порядковому номеру элемента
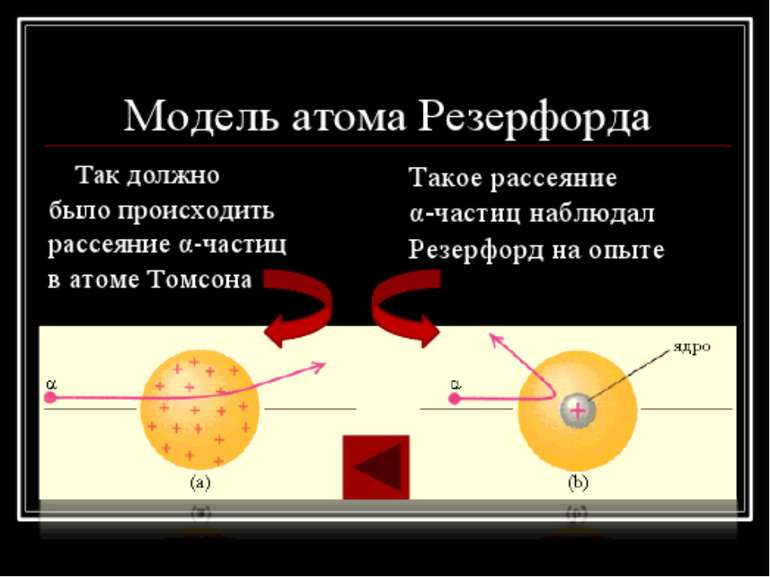
Атом представляет шар по всему объему которого распределен положительный заряд, а внутри этого шара находятся электроны. Электроны могут совершать колебательные движения
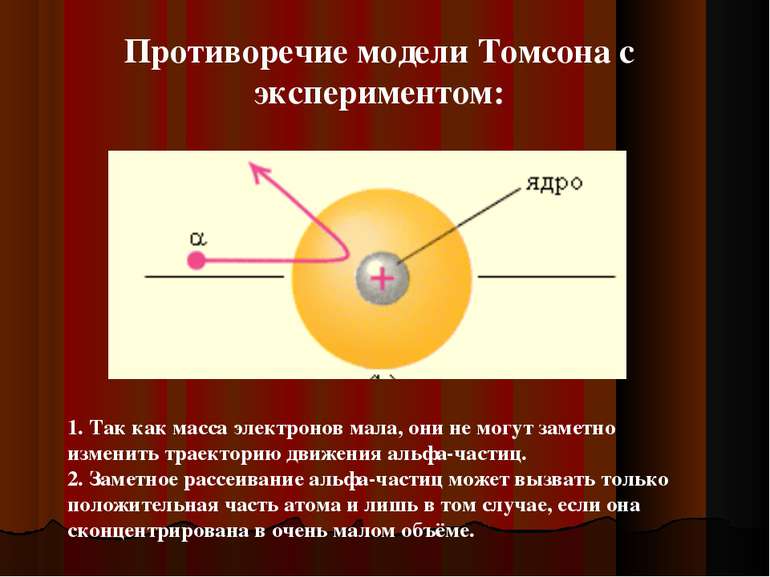
1. Так как масса электронов мала, они не могут заметно изменить траекторию движения альфа-частиц. 2. Заметное рассеивание альфа-частиц может вызвать только положительная часть атома и лишь в том случае, если она сконцентрирована в очень малом объёме. Противоречие модели Томсона с экспериментом:
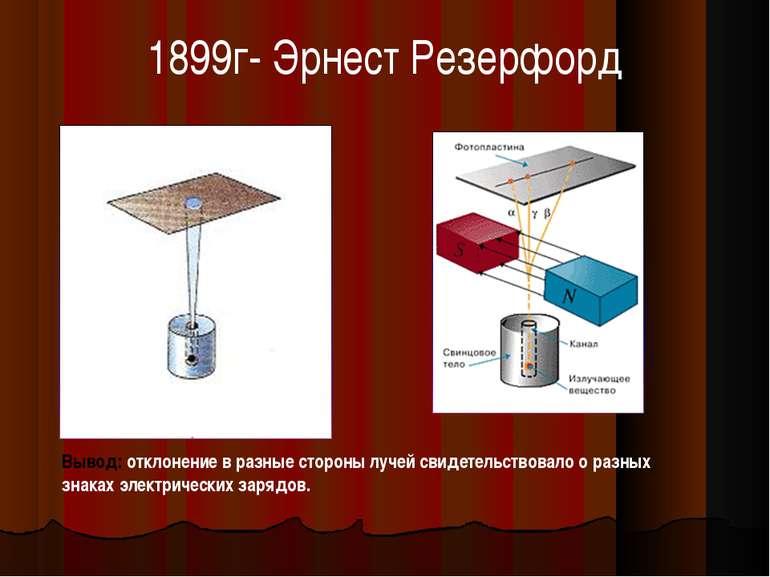
1899г- Эрнест Резерфорд Вывод: отклонение в разные стороны лучей свидетельствовало о разных знаках электрических зарядов.
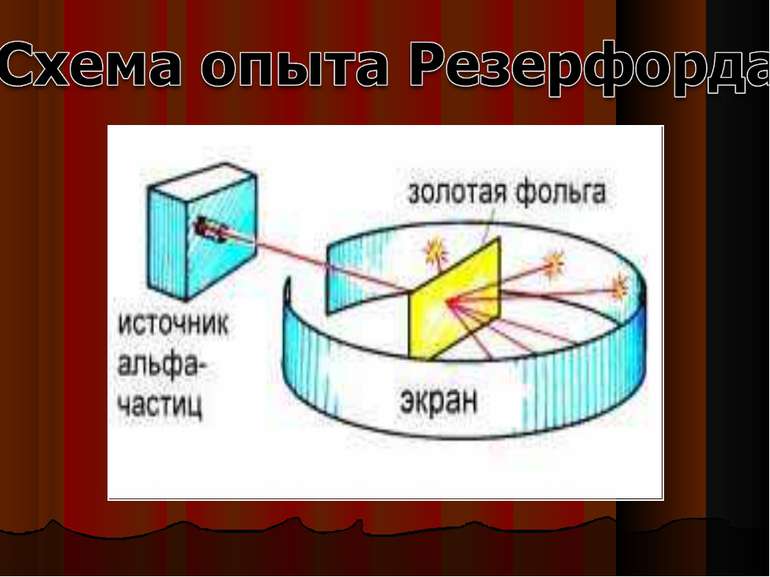
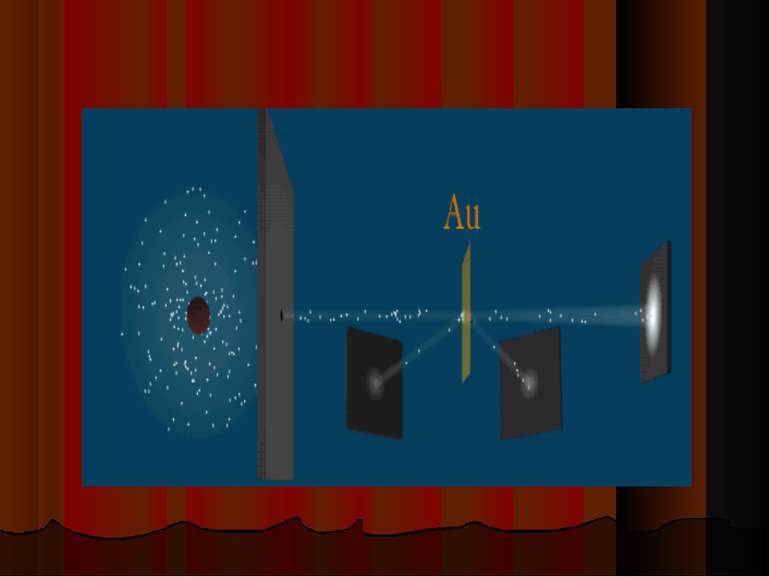
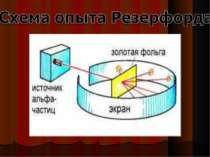
Зондировать атом альфа–частицами. Альфа-частицы возникают при распаде радия. Масса альфа-частицы в 8000 раз больше массы электрона. Электрический заряд альфа-частицы в 2 раза больше заряда электрона. Скорость альфа-частицы около 15 000 км/с. Альфа-частицы является ядром атома гелия. Идея опыта Резерфорда:
Модель атома Резерфорда (планетарная) В центре атома находится положительно заряженное ядро, а вокруг ядра движутся отрицательно заряженные электроны.
Недостаток планетарной модели атома: Нельзя объяснить факт существования атома; Нельзя объяснить устойчивость атома.
В состав ядра входят положительные протоны и неимеющие заряда нейтроны; Количество протонов равно числу электронов; В целом атом нейтрален.
Схожі презентації
Категорії