Презентація на тему:
кварки
Завантажити презентацію
кварки
Завантажити презентаціюПрезентація по слайдам:
В давні часи і середні віки були відомі тільки сім металів.Це число відносилось з числом відомих на той час числом планет: Солнце (золото), Юпітер (олово), МІСЯЦЬ (срібро), Марс (залізо), Меркурій (ртуть), Сатурн (свинець), Венера (мідь). Алхімікі вважали,що під впливом променей планет в надрах Землі народжуються ці метали.
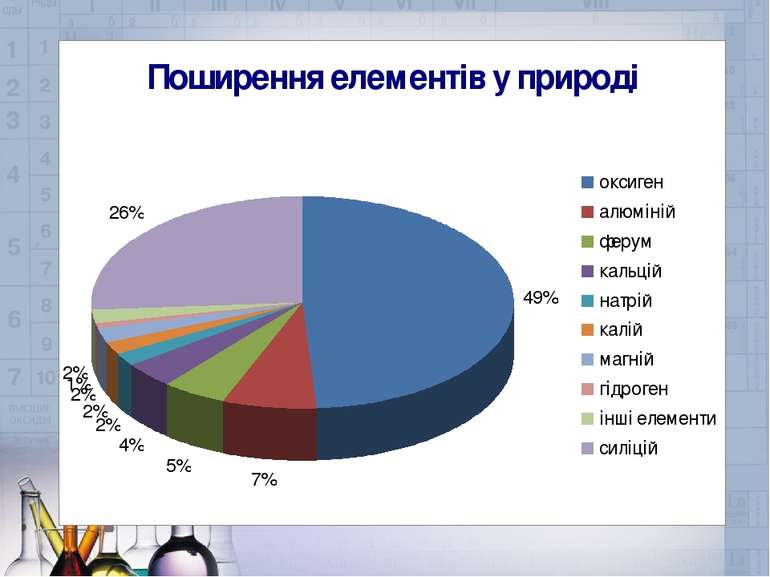
Метали в організмі людини з розрахунку на людину масою 70 кг: Zn – 3 г Ca – 1,4 кг Cu – 100 мг Fe – 5 г Co – 30 мг Mg – 200 г Na – 150 г К – 100 г
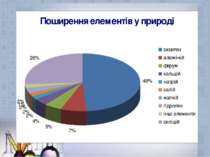
Положення металів в П.С. Коли в П. С. елементів Д. І. Менделєєва провести діагональ від берилію (Be) до астату (At), то справа вгорі від діагоналі будуть знаходиться елементи-неметали (виключаючи елементи побічнихпідгруп), а зліва внизу – елементи-метали (до ним також відносяться елементи побочних підгруп). Елементи, разміщені поблизу діагоналі (наприклад, берилій Be, алюміній Al, титан Ti, германій Ge, ніобій Nb, сурма Sb та інші.), володіють подвійними властивостями. Найбільш типові елементи – метали розміщені на початку періодів(починаючи з 2). Таким чином із 113 ілементів 85 являються металами.
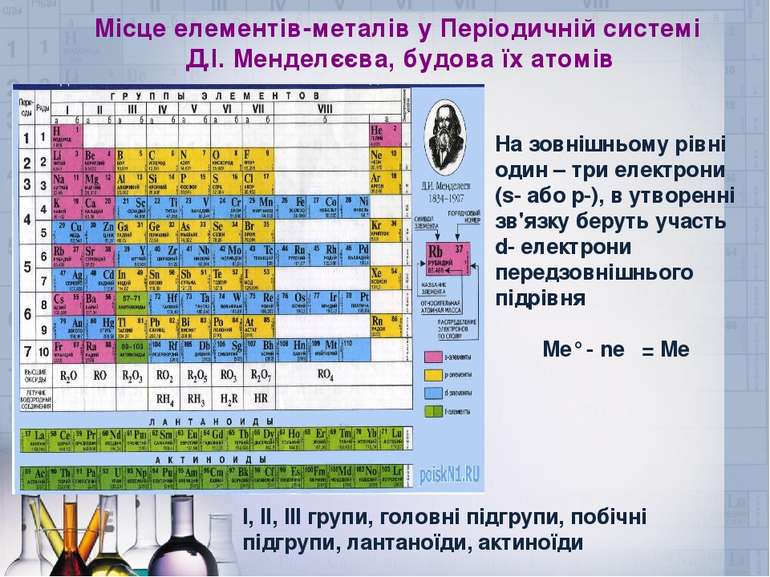
Місце елементів-металів у Періодичній системі Д.І. Менделєєва, будова їх атомів На зовнішньому рівні один – три електрони (s- або p-), в утворенні зв'язку беруть участь d- електрони передзовнішнього підрівня Me° - ne⁻ = Meⁿ⁺ І, ІІ, ІІІ групи, головні підгрупи, побічні підгрупи, лантаноїди, актиноїди
Будова атомів 1.У атомів металів на зовнішньому електронному шарі знаходиться від 1 – 3 е. 2. Їх атоми мають великий радіус. 3. Метали являються сильними відновниками, так як легко віддають зовнішні електрони. 4.Атоми металів перетворюються на позитивно заряджені йони.
Металічна кристалічна гратка Металевий зв’язок і кристалічна гратка У вузлах ґраток – атоми й катіони металу, між вузлами – відносно вільні електрони. Металевий зв’язок – це хімічний зв’язок, утворений за рахунок усуспільнення валентних електронів усіх атомів металевого кристала, що зв'язуються. У результаті утворюється єдина електронна хмарина кристала, що легко зміщається під дією електричної напруги. Металевий зв’язок не має спрямованості й насичуваності. Він зберігається й у розплавах металів.
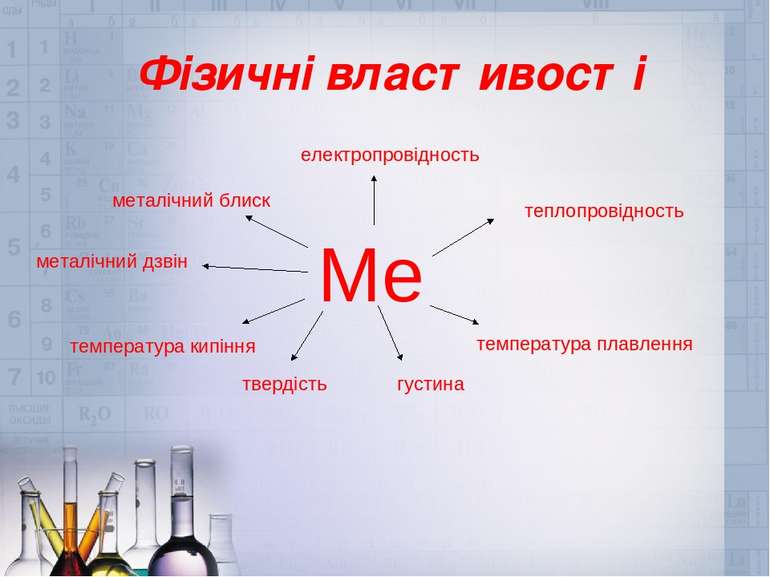
1) Для всіх металів характерний металічний блиск, сірий колір і непрозорість пояснюються наявністю вільних електронів . 2) Метали володіють електричною провідністю, це пояснюються наявністю вільних електронів. Найбільшою електричною провідністю володіють срібло і мідь. За ними - золото, алюміній, залізо. Електричний струм– це напрямлений рух заряджених частинок. Фізичні властивості
Загальні хімічні властивості Найбільш активно метали реагують з простими речовинами (неметалами): галогенами киснем сіркою Ca - відновник Mg - відновник Na - відновник
+ Cl₂ + S + HCl + НОН МеО + Н₂ (магній, залізо) + Н₂ + солі + О₂ МеCl (хлориди) Ме₂S (сульфіди) МеCl + Н₂ МеОН + Н₂ (лужні , Са) МеН (гідриди) сіль більш активного металу Ме + Ме₂О (K, Na K₂O₂; Na₂O₂) Ме
ЯКІСНІ РЕАКЦІЇ Na⁺ - дає жовте полум'я; К⁺ - дає фіолетове полум'я; Са²⁺ - дає яскраво-червоне полум'я; Al³⁺ - з лугами дає білий осад, що розчиняється в надлишку лугу; Fe²⁺ - з лугами дає зеленуватий осад, який на повітрі буріє; Fe³⁺ - у лужному середовищі дає бурий осад. Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Bi Cu Hg Ag Pt Au РЯД АКТИВНОСТІ МЕТАЛІВ / ЕЛЕКТРОХІМІЧНИЙ РЯД НАПРУГ
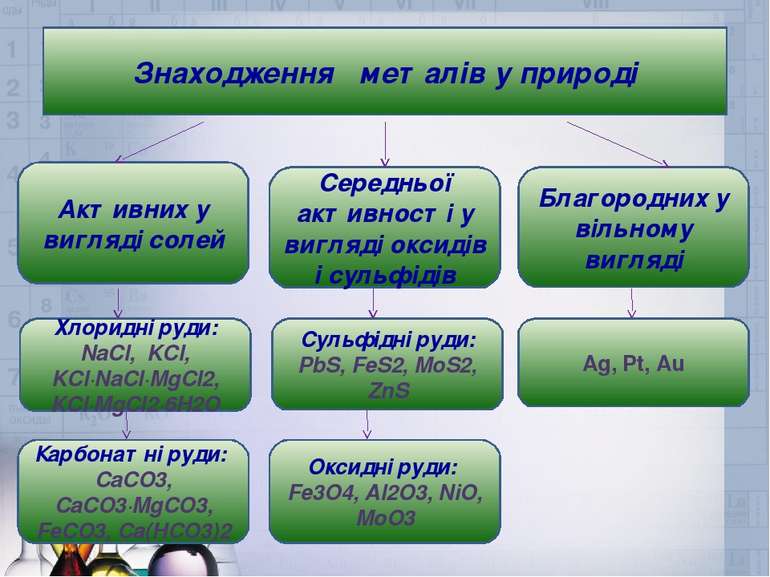
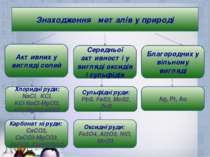
Знаходження металів у природі Активних у вигляді солей Середньої активності у вигляді оксидів і сульфідів Благородних у вільному вигляді Хлоридні руди: NaCl, KCl, KCl∙NaCl∙MgCl2, KCl∙MgCl2∙6H2O Сульфідні руди: PbS, FeS2, MoS2, ZnS Ag, Pt, Au Карбонатні руди: CaCO3, CaCO3∙MgCO3, FeCO3, Ca(HCO3)2 Оксидні руди: Fe3O4, Al2O3, NiO, MoO3
ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ Виграшний шлях - хімічні елементи в 2. Виграшний шлях – хімічні елементи атомах яких наявні чотири, з однаковою кількістю енергетичні рівні валентних електронів Fe I Mg Ar Zn V K C Cu Al O Ca H He Be C Hg Ba He Mg MgO N₂ O₂ Сa3P2 Cl₂ Na₂S PH₃ Mg 3.Виграшний шлях – речовини з іонним зв'язком
1. Найтугоплавкіший. 2. Найрасповсюджений на землі. 3. Найлегший. 4. Найелектропровідний. 5. Найактивніший. 6. Найпластичніший. 7. Найтвердіший. 8. Найлегкоплавкіший. 9. Найважчий. Au Os Cs Hg Li W Cr Al Ag А Б В Г Д Е Є Ж З Перевір!
Схожі презентації
Категорії