Презентація на тему:
Пхпхпхпхп
Завантажити презентацію
Пхпхпхпхп
Завантажити презентаціюПрезентація по слайдам:
Швидкість хімічної реакції. Залежність чинників від різних факторів Підготували: Югай А., Богомолова А., Василенко А.
Мета:cформувати уявлення про швидкість хімічної реакції, її залежність від різних чинників, поглибити знання про каталізатори та їх вплив на швидкість реакції. ПРИМЕЧАНИЕ. Чтобы изменить изображения на этом слайде, выберите рисунок и удалите его. Затем нажмите значок вставки рисунка в заполнителе, чтобы вставить собственное изображение.
Хімічна реакція – це хімічний процес, який характеризується швидкістю взаємодії однієї речовини або елемента з іншою. Вивчаючи хімічні властивості різних сполук, ви напевне звернули увагу на те, що для перебігу різних реакцій потрібний різний час. Деякі хімічні реакції відбуваються миттєво, другі – швидко, треті – повільно. Відомі настільки повільні реакції, що людина їх просто не помічає, зокрема перетворення граніту на пісок та глину (відбувається протягом тисяч років). Поняття про швидкість хімічних реакцій Іржа на залізних виробах утворюється за кілька місяців Горіння свічки триває кілька годин Реакція між содою і оцтом відбувається в одну мить
Концентрація – кількість частинок (атомів, молекул, йонів) реагенту чи продукту реакції. ПРИМЕЧАНИЕ. Чтобы изменить изображения на этом слайде, выберите рисунок и удалите его. Затем нажмите значок вставки рисунка в заполнителе, чтобы вставить собственное изображение.
Які ж чинники впливають на швидкість хімічних реакцій? Навіщо потрібно знати ці чинники? Хімічні реакції можна поділити на дві групи залежно від їх значення для людини: бажані і небажані. Чим швидше відбувається бажана реакція, тим більше за одиницю часу утвориться потрібного продукту, й тим економічно вигіднішою буде ця продукція. Деякі хімічні реакції завдають шкоди (псування харчових продуктів, процес корозії металів), тому швидкість таких небажаних реакцій потрібно сповільнювати.
Використовуючи ці знання, технологи проектують заводську апаратуру, в якій відбуватимуться хімічні перетворення, планують її продуктивність. Охолодження продуктів харчування для кращого зберігання або транспортування.
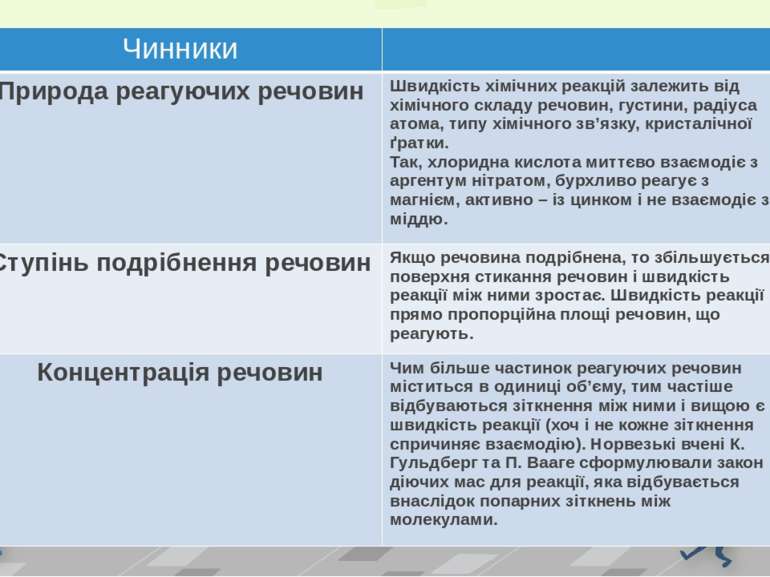
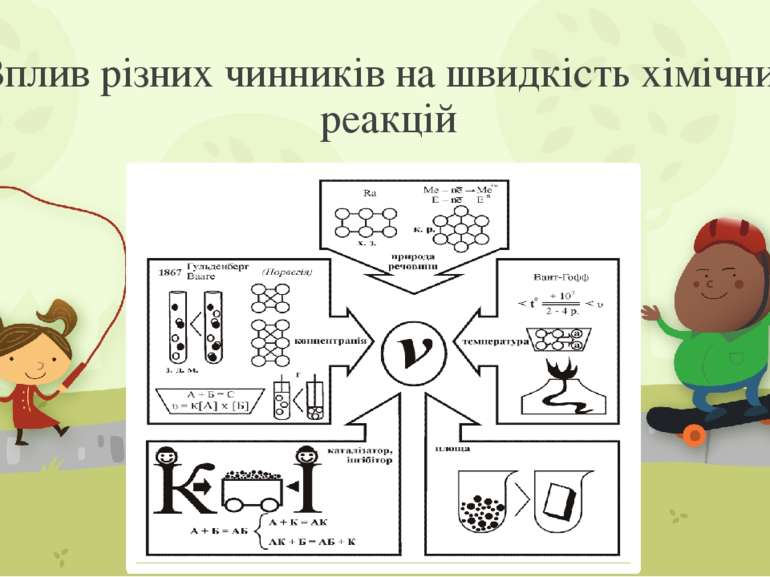
Чинники Природареагуючихречовин Швидкістьхімічнихреакційзалежитьвідхімічногоскладуречовин,густини,радіусаатома, типухімічногозв’язку,кристалічноїґратки. Так,хлориднакислотамиттєвовзаємодієзаргентумнітратом,бурхливореагуєзмагнієм, активно –ізцинком і невзаємодієзміддю. Ступіньподрібненняречовин Якщоречовинаподрібнена, тозбільшуєтьсяповерхнястиканняречовинішвидкістьреакціїміжнимизростає.Швидкістьреакціїпрямопропорційнаплощіречовин,щореагують. Концентраціяречовин Чимбільшечастинокреагуючихречовинміститьсяводиниціоб’єму,тимчастішевідбуваютьсязіткненняміжними івищоюєшвидкістьреакції(хочі некожнезіткненняспричиняєвзаємодію).НорвезьківченіК.Гульдбергта П.Ваагесформулювализакондіючихмасдляреакції, якавідбуваєтьсявнаслідокпопарнихзіткненьміжмолекулами.
Чинники Температураречовин За правилом Вант-Гоффапідвищеннятемпературинакожні10ºCспричиняєзростанняшвидкостібільшостіреакційу 2-4 рази.Цепояснюєтьсятим,щонагріванняречовинсприяєзбільшеннючислаактивнихмолекул,яківступаютьухімічнувзаємодію,оскількимаютьдостатнюенергіюдляздійсненняреакції. Наявністькаталізатора Нагадаємо,щокаталізатори–церечовини,якіприскорюютьхімічніреакції, асаміневходятьдопродуктівреакції.Виявляється,щокаталізаторбереучасть уреакції,утворюючизвихіднимиречовинамипроміжніпродукти,якішвидкоруйнуються, ікаталізаторвивільняєтьсяз них. Реакції,щовідбуваютьсязанаявностікаталізаторів,називаютьсякаталітичними, а сампроцесзмінишвидкостіреакціїпідвпливомкаталізатора–каталізом.
Застосуй свої знання про швидкість реакції в побуті! Чому продукти харчування зберігають в холодильнику? Під час консервації продуктів використовують речовини – консерванти.
Гра «Вірю – не вірю» Екзотермічні реакції відбуваються із виділенням теплоти. Ендотермічні реакції відбуваються із поглинанням теплоти. Реакція горіння вугілля – це ендотермічна реакція. Тепловий ефект реакції – це маса продукту реакції, що утворилася під час горіння речовини. Тепловий ефект реакції вимірюється в паскалях (Па), або кілопаскалях(кПа). Тепловий ефект реакції позначається буквою Q або ∆Н. В ендотермічних реакціях внутрішня енергія речовин зростає. Тепловий ефект реакції – це кількість теплоти, що виділяється, або поглинається під час реакції. Тепловий ефект реакції вимірюється в Дж або кДж. Хімічні рівняння, в яких зазначаються ступені окиснення елементів, називаються термохімічними. При екзотермічних реакціях температура реакційної системи підвищується. Під час протікання ендотермічної реакції температура реакційної суміші підвищується.
Екзотермічні реакції відбуваються із виділенням теплоти. Ендотермічні реакції відбуваються із поглинанням теплоти. Реакція горіння вугілля – це ендотермічна реакція. Тепловий ефект реакції – це маса продукту реакції, що утворилася під час горіння речовини. Тепловий ефект реакції вимірюється в паскалях (Па), або кілопаскалях(кПа). Тепловий ефект реакції позначається буквою Q або ∆Н. В ендотермічних реакціях внутрішня енергія речовин зростає. Тепловий ефект реакції – це кількість теплоти, що виділяється, або поглинається під час реакції. Тепловий ефект реакції вимірюється в Дж або кДж. Хімічні рівняння, в яких зазначаються ступені окиснення елементів, називаються термохімічними. При екзотермічних реакціях температура реакційної системи підвищується. Під час протікання ендотермічної реакції температура реакційної суміші підвищується.
Підсумки Швидкість хімічної реакції оцінюють, виходячи зі зміни кількості частинок речовини реагенту чи продукту реакції за одиницю часу. На швидкість хімічних реакцій впливають такі чинники: природа реагуючих речовин, їхня температура, концентрація, ступінь подрібненості й наявність каталізатора. Знаючи вплив чинників на швидкість хімічних реакцій можна прискорити бажані реакції і сповільнити небажані.
Схожі презентації
Категорії