Презентація на тему:
Корсунов В.А.
Завантажити презентацію
Корсунов В.А.
Завантажити презентаціюПрезентація по слайдам:
ХМАПО Кафедра дитячої анестезіології та інтенсивної терапії АРГІНІН, ОКСИД АЗОТУ – КЛЮЧОВІ ВИКОНАВЦІ МІКРОЦИРКУЛЯТОРНОЇ ДРАМИ ПРИ СЕПСИСІ ? Корсунов В.А., к.мед.н., доцент Харків 2009
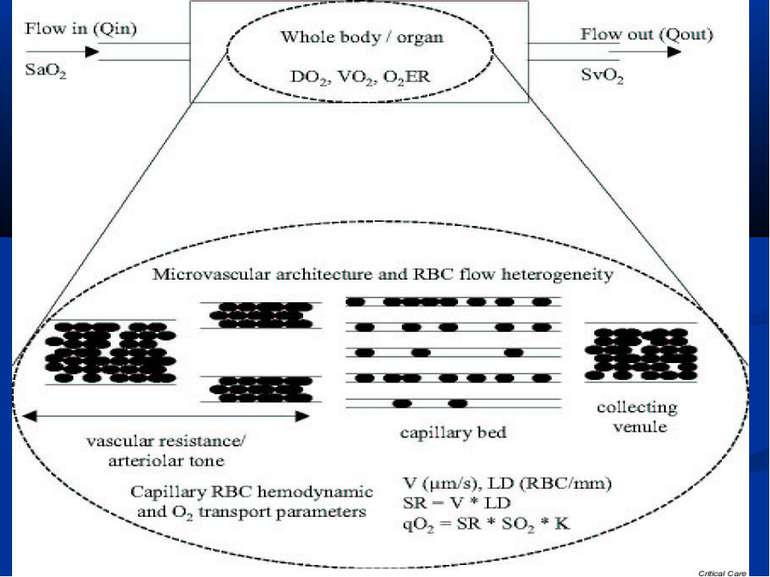
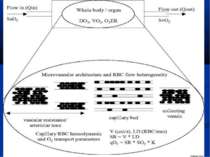
МІКРОЦИРКУЛЯТОРНІ РОЗЛАДИ – ГОЛОВНА ПАТОЛОГІЧНА ЛАНКА СЕПСИСУ De Backer et al, показали, що у хворих з тяжким сепсисом кількість мікросудин, що перфузується (
МІКРОЦИРКУЛЯТОРНІ РОЗЛАДИ – ГОЛОВНА ПАТОЛОГІЧНА ЛАНКА СЕПСИСУ Trzeciak S. et al відзначають, що у експериментальних моделях сепсису виявляється зниження швидкості мікроциркуляторного потоку крові, утворення мікросудин із зупиненим кровообігом, зростання гетерогенності кровотоку та зниження щільності капілярів. Вони підкреслюють, що такі розлади спостерігаються за відсутності глобальних гемодинамічних зрушень та артеріальної гіпотонії. (Resuscitating the microcirculation in sepsis: The central role of nitric oxide, emerging concepts for novel terapies, and challenges for clinical trials / S. Trzeciak, I. Cinel, R.P. Dellinger [et al.] // Ac. Emerg. Med. – 2008. - Vol 15. - P. 399-413) Виділяють п’ять патологічних типів тканинного кровообігу під час перерозподільного шоку. (Elberts P. Bench-to-bedside review: Mechanisms of critical illness – classifyng microcirculatory flow abnormalities in distributive shock / Paul Elbers, Can Ince // Crit. Care. – 2006 – Vol. 10. – P. 221-227) Саме мікроциркуляторні розлади та мітохондріальна дисфункція при сепсисі спричиняють розвиток СПОН, а отже мають усуватися засобами інтенсивної терапії. (Balestro G.M. Microcirculation and mitochondria in sepsis: getting out of breath / G.M. Balestro, M. Legrand, C. Ince // Current Opinion in Anest. – 2009. – Vol. 22. – P. 184-190)
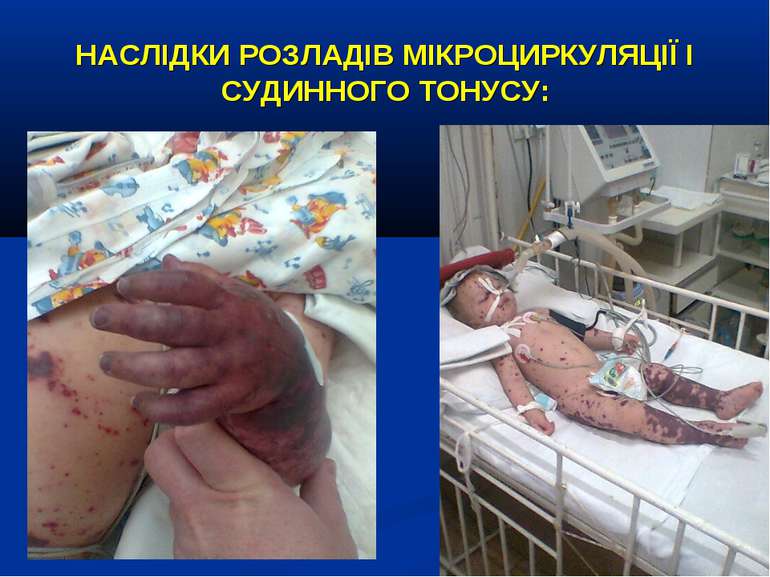
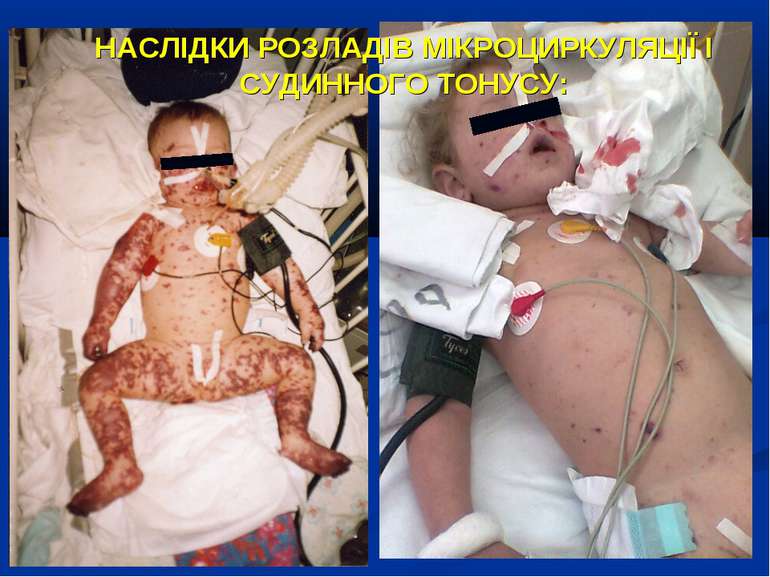
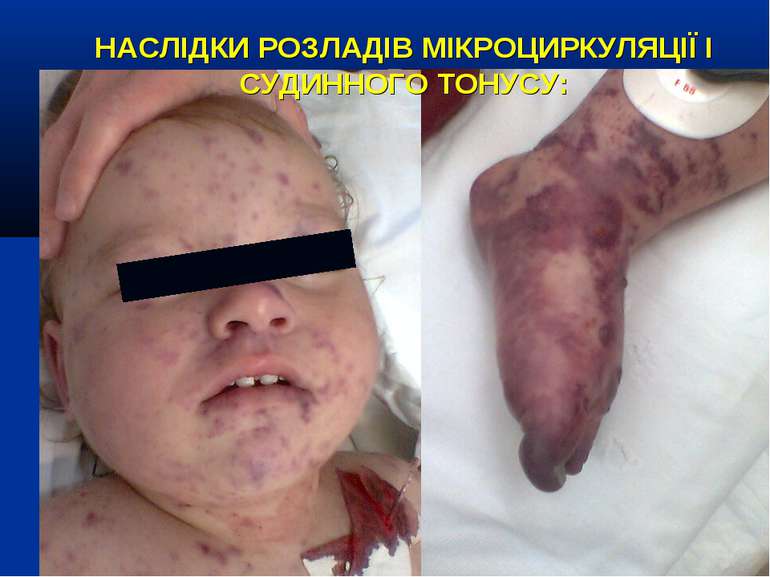
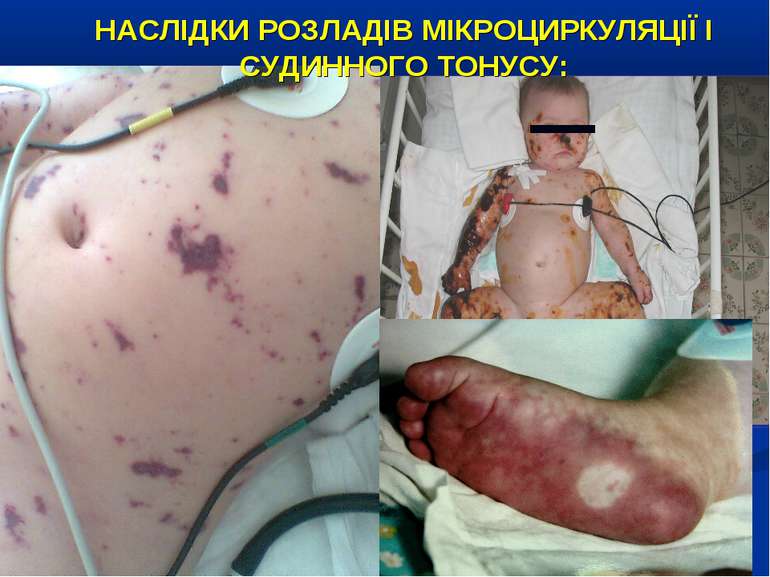
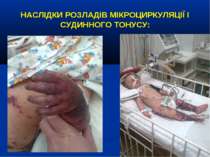
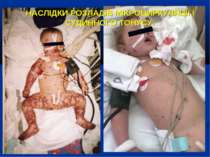
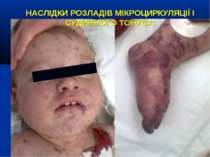
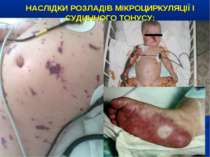
НАСЛІДКИ РОЗЛАДІВ МІКРОЦИРКУЛЯЦІЇ І СУДИННОГО ТОНУСУ: Легенева гіпертензія, респіраторний дистрес-синдром; Ішемічне ушкодження кишківника (ілеус, ерозивно-язвене ушкодження, абдомінальний компартмент-синдром, шлунково-кишкова кровотеча); Гостра ниркова недостатність; Ішемічний гепатит; Синдром дисемінованого внутрішньосудинного згортання; Пурпура та некрози шкіри, вух, носа, кінцівок
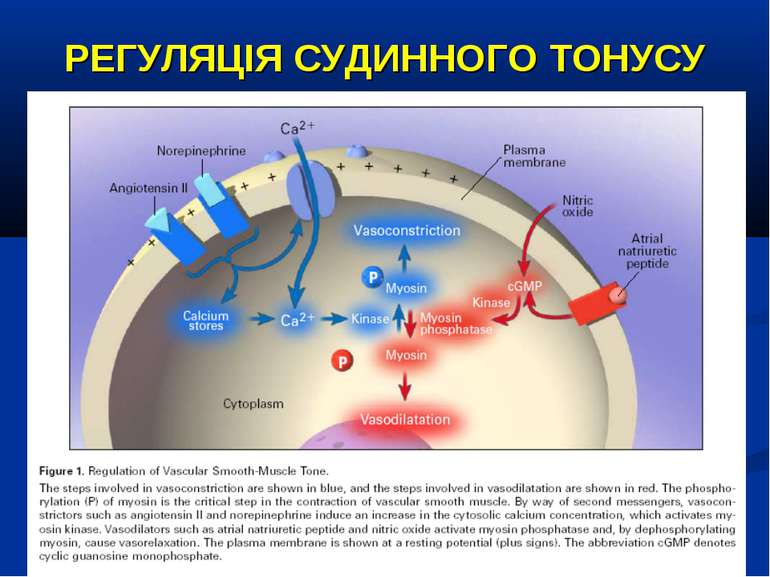
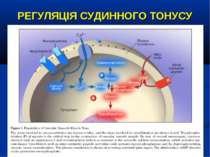
РЕГУЛЯЦІЯ СУДИННОГО ТОНУСУ ВАЗОКОНСТРИКТОРИ: катехоламіни (епінефрін, норепінефрін), вазопресин, ангіотензин ІІ, ендотелін, лейкотрієни ВАЗОДИЛЯТАТОРИ: простагландіни, серотонін, гістамін, NO, передсердний натрійуретичний пептід, активація АТФ-чутливих калієвих каналів через зниження вмісту внутріклітинного АТФ (гіпоксія), підвищення вмісту усередині клітин іонів водню і лактату, зниження рівня циркулюючого вазопресину
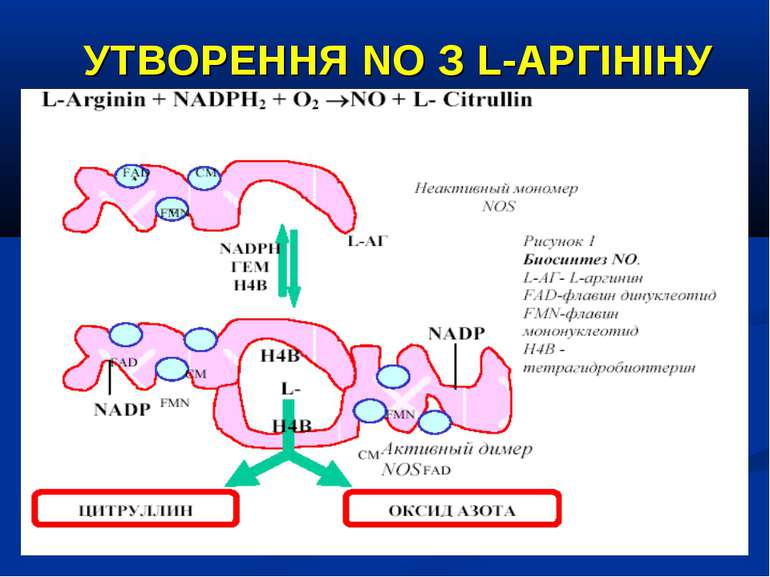
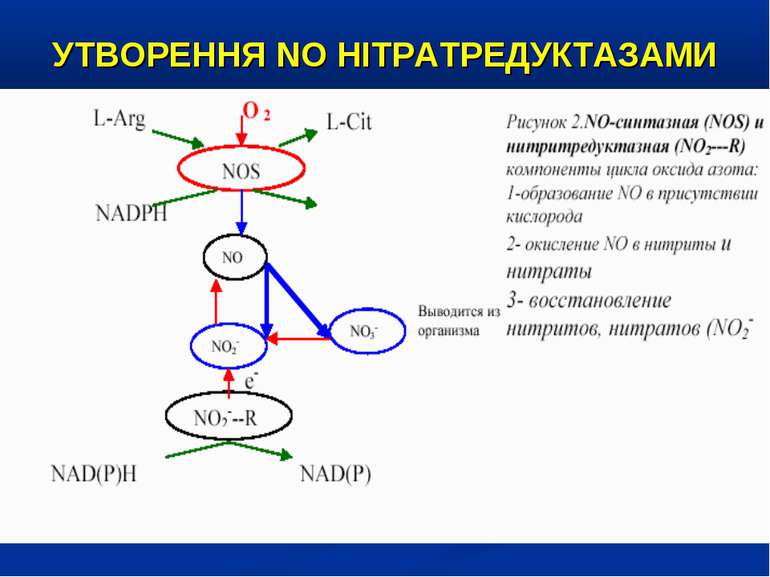
ОКСИД АЗОТУ – ВАЖЛИВИЙ ВАЗОДИЛЯТАТОР NO – сигнальна молекула, яка є неорганічною речовиною із властивостями радикалу. Малі розміри, відсутність заряду, добра розчинність у воді та ліпідах забезпечують їй високу проникливість крізь клітинні мембрани та субклітинні структури. Час існування NO становить близько 6 сек., після чого за участю кисню та води він перетворюється на нітрати (NO-2) та нітрити (NO-3).
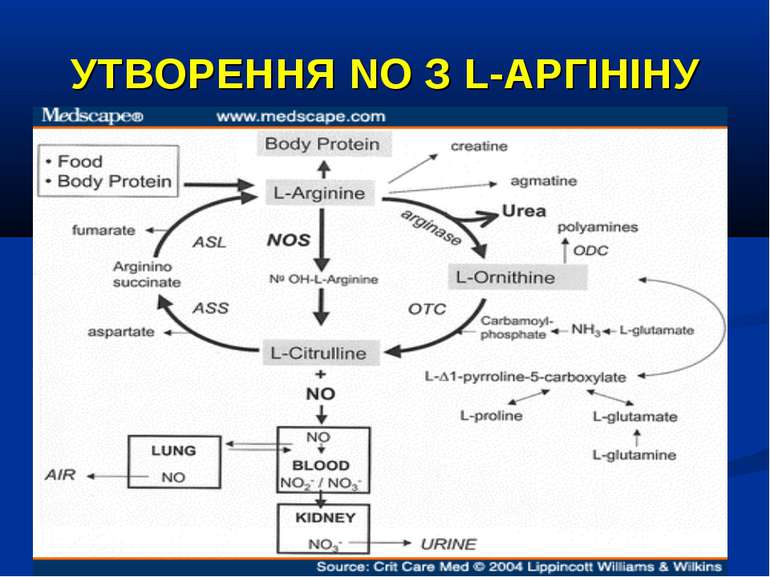
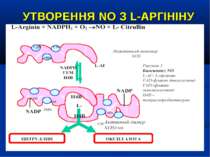
УТВОРЕННЯ NO На даний час відомо три типи NO-синтаз: Конститутивні NO-синтази (тип І та ІІІ) які експресовані постійно, продукують невелику кількість NO. ІІ тип – індуцибельна NO-синтаза (iNOS) при активації (у тому числі і ліпополісахаридом, прозапальними цитокінами) може продукувати значну кількість NO. Вона містится у макрофагах, нейтрофілах, клітинах кісткового мозку, еозинофілах, гепатоцитах, купферівских клітинах, спленоцитах, фібробластах, астроцитах, кардіоміоцитах. Ендотелій містить NO-синтазу І-го та ІІ-го типів.
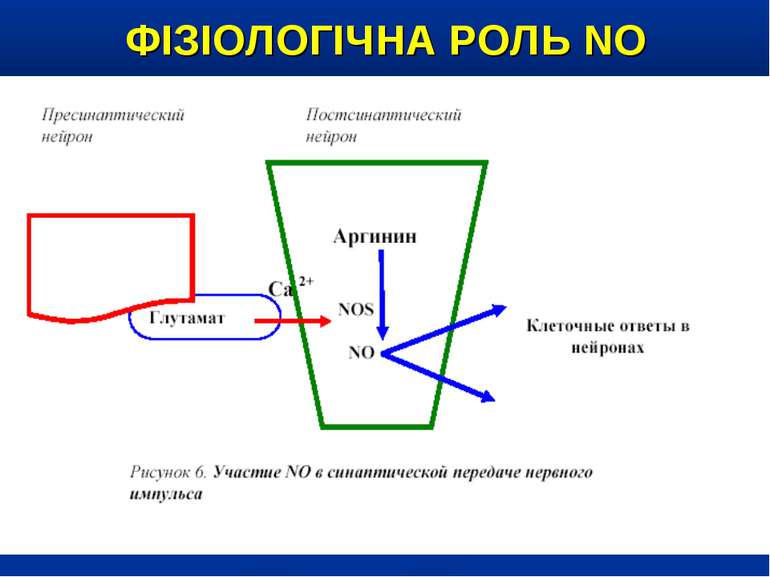
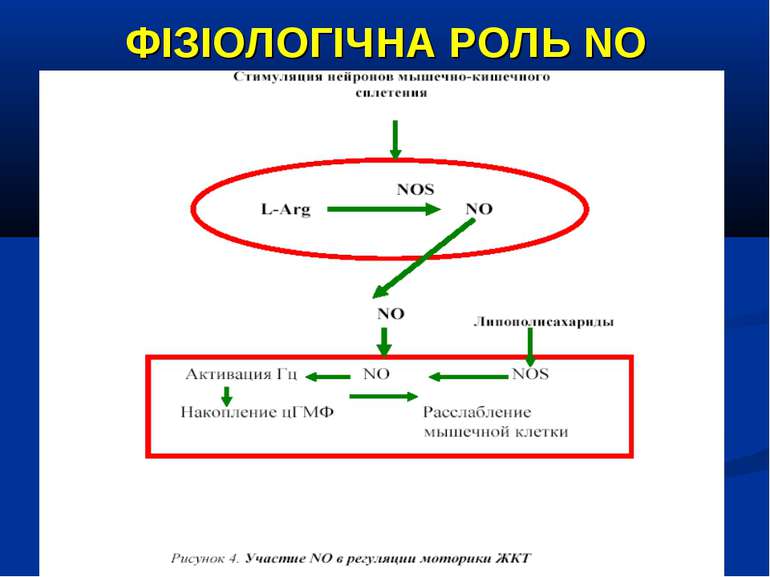
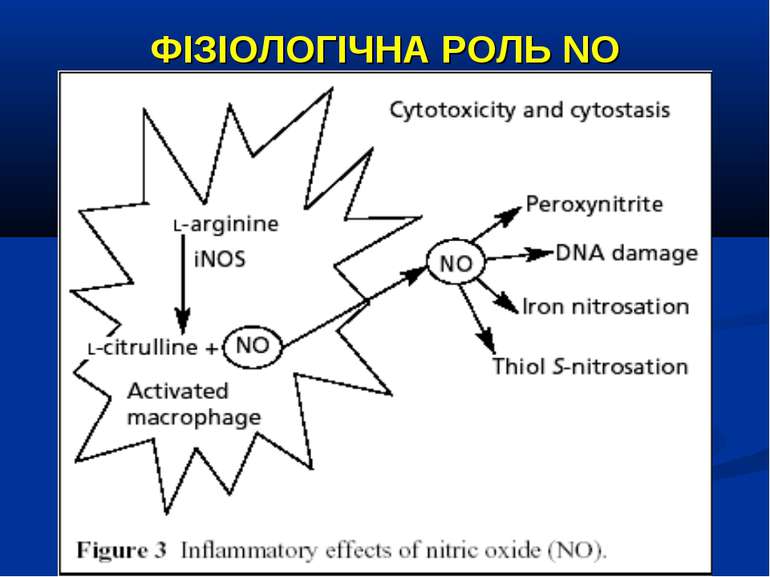
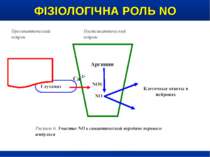
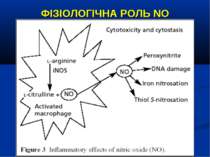
ФІЗІОЛОГІЧНА РОЛЬ NO NO важливий медіатор імунної, серцево-судинної, дихальної, нервової, травної и сечової систем (Р.И. Сепиашвили с соавт., 2001; О.В. Синяченко, Т.В. Звягина, 2001). Всі біологічні ефекти NO можна розподілити на 3 типи: — регуляторний вплив NO на судинний тонус, адгезію клітин, проникність судин, нейротрансмісію, бронходилатацію, агрегацію тромбоцитів, систему протипухлинного імунітету, функцію нирок; — захисна дія NO, проявляється через його антиоксидантну активність, інгібіцію адгезії лейкоцитів та захисту від токсичного впливу TNF-α; — ушкоджуючий вплив NO, реалізується через пригнічення ферментів, порушення структури ДНК, індукції процесів перекисного окислення. (Г.А. Рябов, Ю.М. Азизов, 2001)
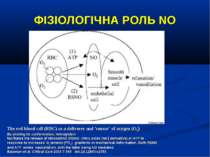
ФІЗІОЛОГІЧНА РОЛЬ NO The red blood cell (RBC) as a deliverer and 'sensor' of oxygen (O2). By altering its conformation, hemoglobin facilitates the release of nitrosothiol (RSNO; nitric oxide [NO] derivative) or ATP in response to increased O2 tension (PO2) gradients or mechanical deformation. Both RSNO and ATP evoke vasodilation, with the latter being NO mediated. Bateman et al. Critical Care 2003 7:359 doi:10.1186/cc2353
ФІЗІОЛОГІЧНА РОЛЬ NO NO є могутнім бактерицидним чинником і викликає загибель патогенних мікроорганізмів, або зупиняє їх реплікацію, що зумовлено властивістю його проміжних метаболітів.
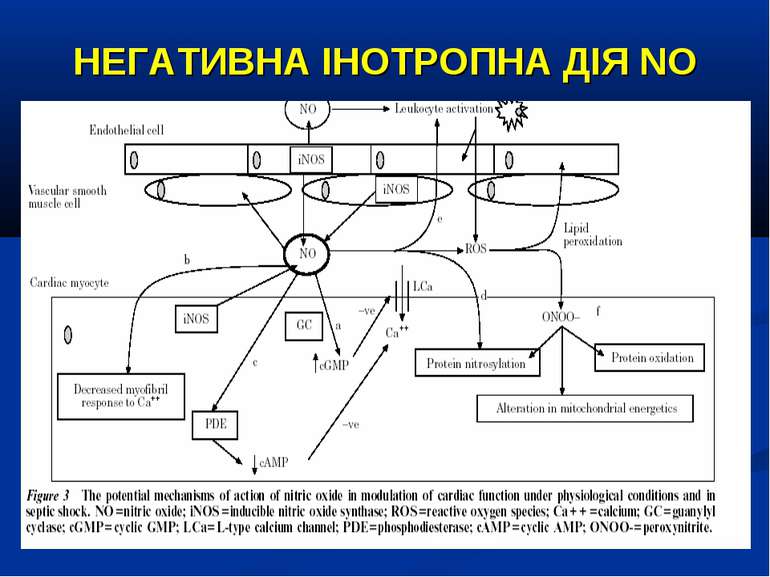
NO ПРИ СЕПСИСІ Утворення NO при сепсисі стимулюється ліпополісахаридом, вірусами та прозапальними цитокінами і простагландінами. У протилежність – зменшення продукції NO відбувається під впливом протизапальних цитокінів та кортикостероїдів. NO змінює транспорт іонів через клітинну стінку, викликає зниження вмісту внутріклітинного кальцію і, як наслідок – призводить до розвитку вазодилятації. Таким чином, при сепсисі надлишок NO може зменшувати системний та легеневий судинний опор, що, у свою чергу, знижує системний і легеневий кров’яний тиск. Його надлишок також пов’язують з розвитком міокардіальної дисфункції, і збільшенням споживання кисню. (Hotchkiss R.S. The pathophysiology and treatment of sepsis / Richard Hotchkiss, Irene Karl //The New England J. of Med. – 2003. - №2. – P.138-150; Symeonides S. Nitric oxide in the pathogenesis of sepsis / R.A. Balk, S.Symeonides // Infect. Dis. Clin. North. Am. – 1999. - №13. - P.449-460) Проте, вазодилятація та її наслідки при сепсисі імовірно відбуваються не лише завдяки NO, а і завдяки гіпоксії та активації калієвих каналів, лактат-ацидозу, дефіциту вазопресину. Отже, гіперпродукція NO не єдиним винуватцем у розвитку рефрактерної септичної гіпотонії. (Landry D.W. The pathogenesis of vasodilatatory shock / Donald W. Landry, Juan A. Oliver // The New Engl. J. Med. – 2001. – Vol. 354. – P. 588-595)
NO ПРИ СЕПСИСІ Гіперпродукція NO при сепсисі може супроводжуватись низкою патологічних реакцій: Вазодилятацією та гіпотонію через вплив на цГМФ гладеньких м’язів судин, Збільшенням капілярного витоку та відносною гіповолемією; Пригніченням систолічної функції міокарда, а отже зниженням серцевого викиду; Активацією оксидативного ушкодження через утворення S-нітрозотиолів та апоптозу (Symeonides S. Nitric oxide in the pathogenesis of sepsis / R.A. Balk, S.Symeonides // Infect. Dis. Clin. North. Am. – 1999. - №13. - P.449-460)
NO ПРИ СЕПСИСІ Отже протягом 90-х років ХХ сторіччя та на початку ХХІ сторіччя було здійснено безліч спроб застосувати інгібітори NOS (L-NMMA, NNLA, метиленовий синій) з метою запобігання несприятливих впливів NO. Попри здатність інгібіторів NOS збільшувати артеріальний тиск та зменшувати дози симпатоміметиків, що можна розцінити як позитивний ефект, всі вони сприяли поглибленню мікроциркуляторних розладів, серцево-судинної дисфункції та погіршенню виходів як у експериментальному сепсисі, так і у передчасно припиненому клінічному випробуванні (Grover R., Lopez A., Lorente J. et al. Multicenter, randomized, placebo-controlled, double blind study of nitric oxide synthase inhibitor 546C88: effect on survival in patients with septic shock / Crit. Care. Med. – 1999. – Vol. 32. – P21-30; Batteman R.M., Sharpe M.D., Ellis C.G. Bench-to-bedside review: microvascular dysfunction in sepsis – hemodynamics, oxygen transport, and nitric oxide / Crit. Care, 2006)
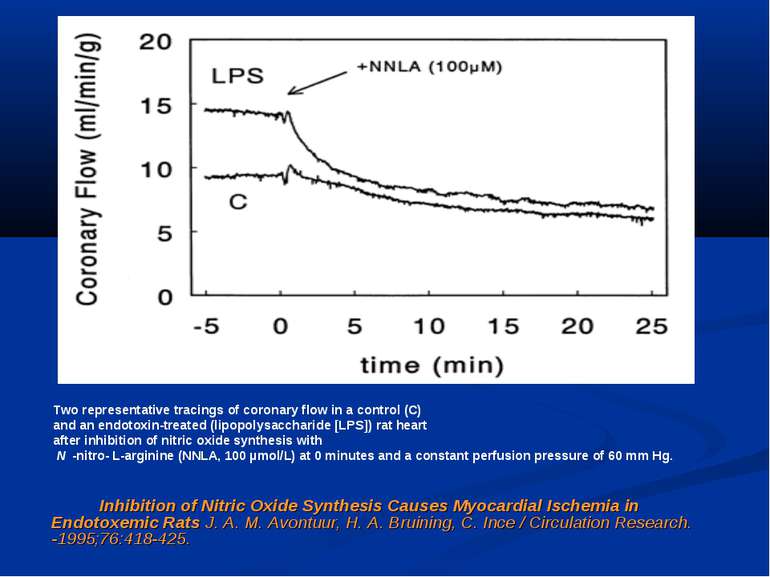
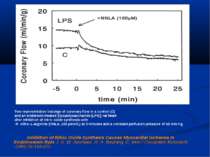
Inhibition of Nitric Oxide Synthesis Causes Myocardial Ischemia in Endotoxemic Rats J. A. M. Avontuur, H. A. Bruining, C. Ince / Circulation Research. -1995;76:418-425. Two representative tracings of coronary flow in a control (C) and an endotoxin-treated (lipopolysaccharide [LPS]) rat heart after inhibition of nitric oxide synthesis with N -nitro- L-arginine (NNLA, 100 µmol/L) at 0 minutes and a constant perfusion pressure of 60 mm Hg.
NO ПРИ СЕПСИСІ У останній час експериментальними дослідженнями продемонстрований дефіцит передувача NO - L-аргініну та відносно нижчий темп ниркової екскреції нітрітів/нітратів який запропоновано вважати головним чинником збільшення рівню NO при СШ у дорослих (In vivo arginin production and intravascular nitric oxide synthesis in hypotensive sepsis / Salvador Villaplando, Jayashree Gopal, Ashok Balasubramanyan [et al.] // The Am. J. of Clin. Nutr. – 2006. – Vol. 84. – P. 197-203) Зроблено припущення, що стрімке збільшення продукції NO при сепсисі відбувається за допомогою індуцибельної NO-синтази через брак NO, утворюваного конститутивними NO-синтазами. Нестача NO на рівні мікросудин за умов переважання вазоконстрикторних стимулів (ендотелін) викликає ішемію та спонукає до активації індуцибельного шляху утворення великої кількості NO, яке сприяє відновленню циркуляції (Sepsis: An arginin deficiency state? / Yvette C. Luiking, Martijn Poeze, Cornelis H. Dejong [et al.] // Crit. Care Med. – 2004. – Vol. 166. - P. 98-104; Resuscitating the microcirculation in sepsis: The central role of nitric oxide, emerging concepts for novel terapies, and challenges for clinical trials / S. Trzeciak, I. Cinel, R.P. Dellinger [et al.] // Ac. Emerg. Med. – 2008. - Vol 15. - P. 399-413)
Таким чином, у останні роки сформульовано альтернативну концепцію щодо ролі L-аргініну та нітрітів/нітратів при СШ. Вона полягає у тому, що гіперпродукція NO при активації ІІ шляху за допомогою iNOS має компенсаторний характер і має бути підтримана!
NO ПРИ СЕПСИСІ Отже відбуваються активні дослідження, щодо здатності L-аргініну та інших донаторів оксиду азоту позитивно вплинути на стан мікроциркуляції. Останнім часом опубліковано кілька робіт з цього напрямку: Kalil, Andre C; Danner, Robert L. L-Arginine supplementation in sepsis: beneficial or harmful? Current Opinion in Critical Care: August 2006 - Volume 12 - Issue 4 – p. 303-308. Nakajima Y, Baudry N, Duranteau J, Vicaut E. Effects of vasopressin, norepinephrine, and L-arginine on intestinal microcirculation in endotoxemia. Crit Care Med. 2006 Jun;34(6):1847-9. Lamontagne F, Meade M, Ondiveeran HK, Lesur O, Robichaud AE. Nitric oxide donors in sepsis: a systematic review of clinical and in vivo preclinical data. Shock. 2008 Dec;30(6):653-9. Trzeciak S, Cinel I, Phillip Dellinger R, Shapiro NI, Arnold RC, Parrillo JE, Hollenberg SM. Resuscitating the microcirculation in sepsis: the central role of nitric oxide, emerging concepts for novel therapies, and challenges for clinical trials. Microcirculatory Alterations in Resuscitation and Shock (MARS) Investigators. Acad Emerg Med. 2008 May;15(5):399-413.
Continuous L-arginine infusion does not deteriorate the haemodynamic condition in patients with severe sepsis Y Luiking1, M Poeze1, M Hendrikx et al. Critical Care 2006 10(Suppl 1):P208 ПЕРШІ ДОКАЗИ ВІДСУТНОСТІ НЕГАТИВНОГО ВПЛИВУ ІНФУЗІЇ L-АРГІНІНУ НА ГЕМОДИНАМІКУ ПРИ СЕПСИСІ Baseline 0.6 1.2 1.8 P Plasma arginine (μM) 49 ± 2 86 ± 5 136 ± 7 192 ± 9
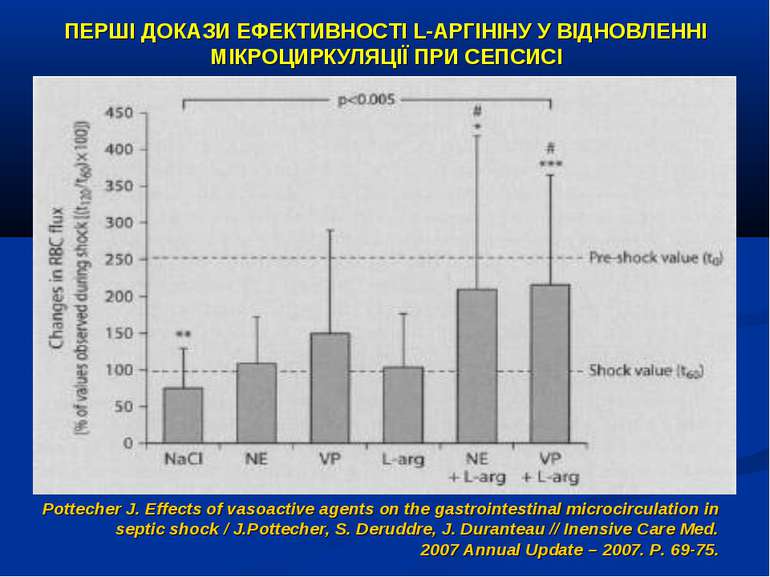
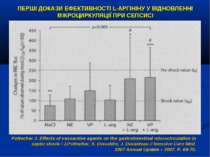
ПЕРШІ ДОКАЗИ ЕФЕКТИВНОСТІ L-АРГІНІНУ У ВІДНОВЛЕННІ МІКРОЦИРКУЛЯЦІЇ ПРИ СЕПСИСІ Pottecher J. Effects of vasoactive agents on the gastrointestinal microcirculation in septic shock / J.Pottecher, S. Deruddre, J. Duranteau // Inensive Care Med. 2007 Annual Update – 2007. P. 69-75.
ЛЕГЕНЕВА ГІПЕРТЕНЗІЯ ПРИ СЕПТИЧНИХ СТАНАХ У ДІТЕЙ ТА МОЖЛИВОСТІ АРГІНІНУ ГІДРОХЛОРИДУ (ТІВОРТІНУ) В ЇЇ ЛІКУВАННІ
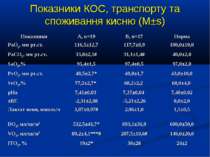
ДОСЛІДЖЕННЯ №1 ВЗАЄМОЗВ’ЯЗОК МІЖ ЛЕГЕНВОЮ ЦИРКУЛЯЦІЄЮ, СПОЖИВАННЯМ КИСНЮ ТА ОКСИДОМ АЗОТУ ПРИ СЕПТИЧНИХ СТАНАХ У ДIТЕЙ
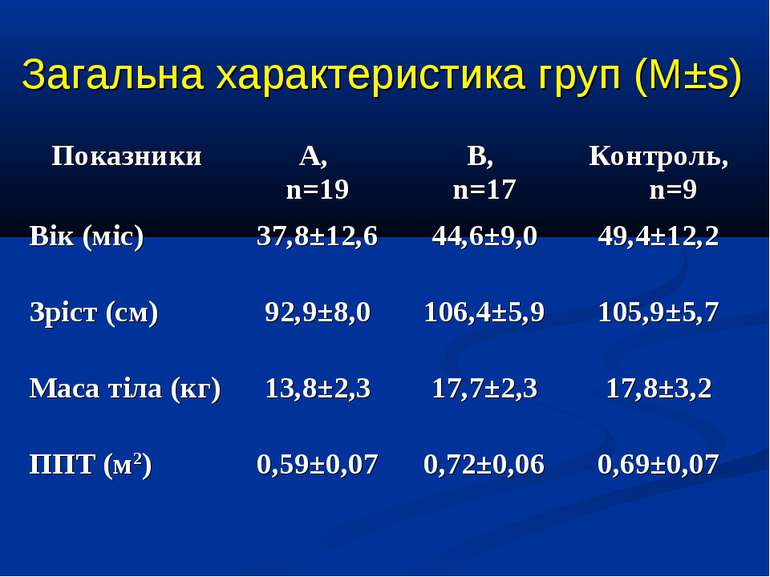
ДИЗАЙН Відкрите одноцентрове порівняльне дослідження Протягом 2006-2009 рр. до дослідження увійшло 36 дітей, що знаходились на лікуванні у відділенні інтенсивної терапії Обласної дитячої інфекційної клінічної лікарні м. Харкова з С, ТС та СШ, діагноз яких встановлювався у відповідності до критеріїв консенсусу SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference (2001). Вік пацієнтів становив від 1 міс. до 17 років, у середньому 41,3±7,5 міс. Причиною розвитку критичного стану у 8 пацієнтів був менінгококовий сепсис, у 11 – інші нейроінфекції, у 9 – інфекції респіраторного тракту, у 3 - бактеріальні гастроентероколіти, інші причини - у 5 дітей. Групою контролю було 9 дітей із відсутністю гострих або хронічних захворювань, які можуть впливати на стан гемодинаміки та легенів.
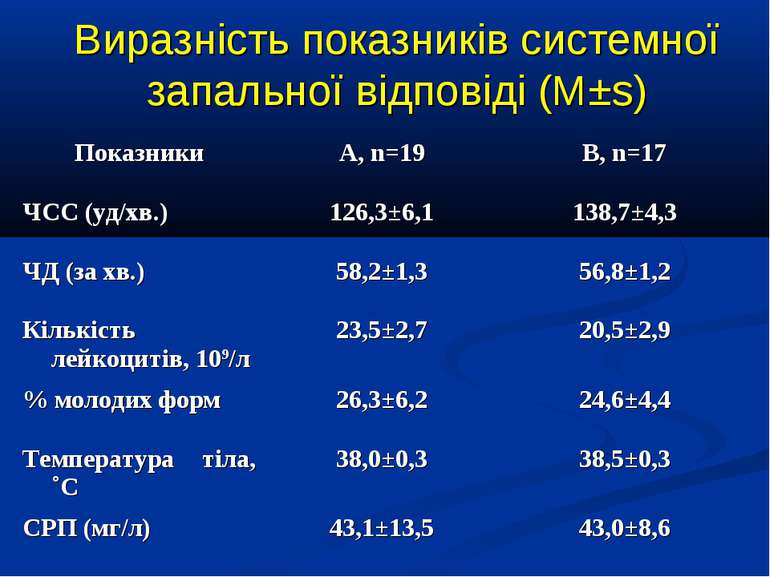
ДИЗАЙН група А, 19 хворих із споживанням кисню менше 120 мл/хв/м2 група В, 17 хворих із споживанням кисню понад 120 мл/хв/м2
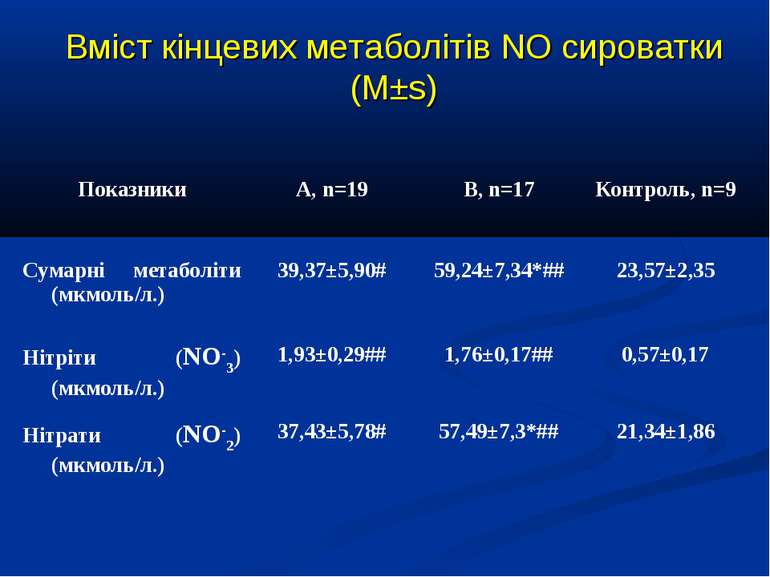
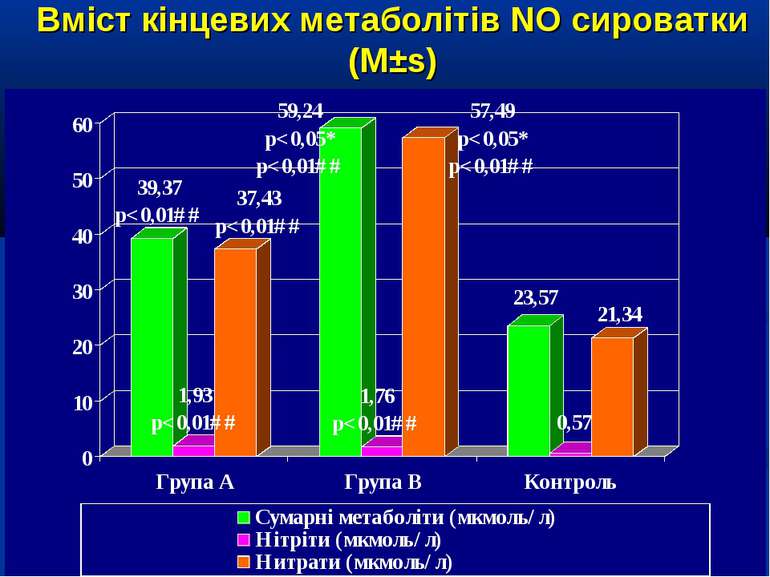
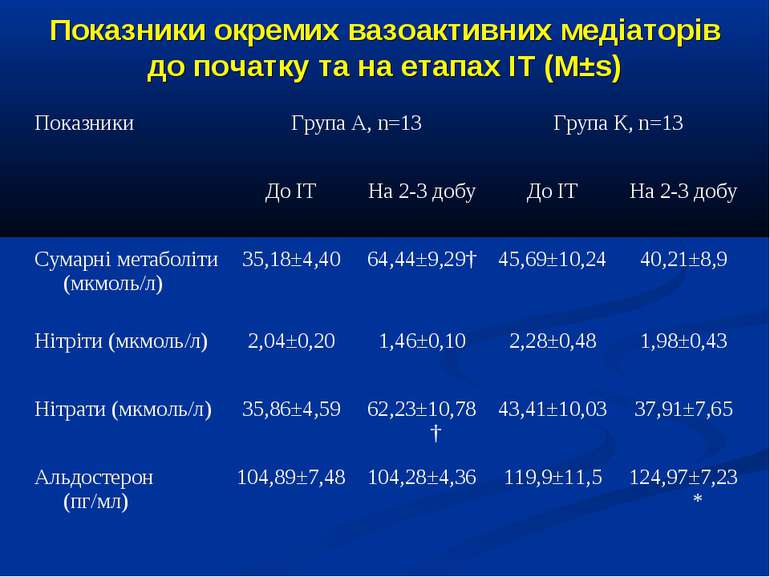
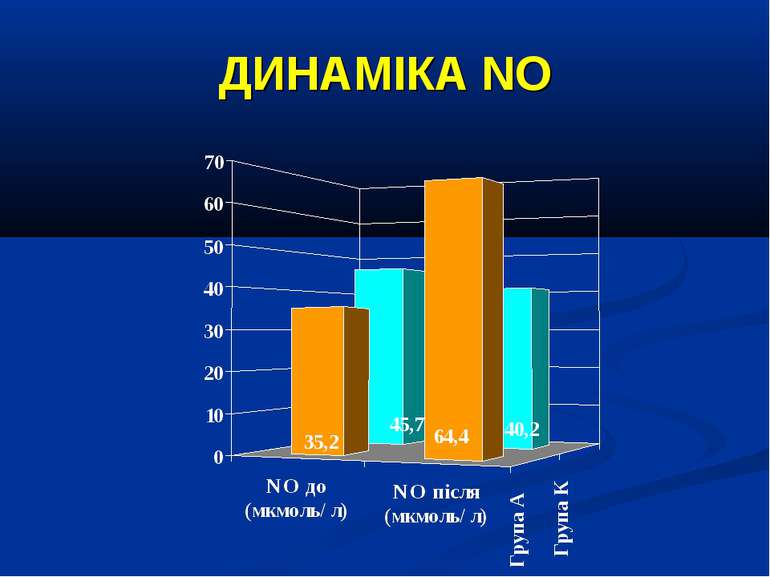
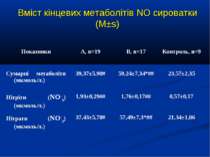
Кореляційний аналіз продемонстрував наявність позитивних зв’язків між сумарними метаболітами та DO2 - R=0,36, p=0,002, нітратами та DO2 - R=0,36, p=0,002, сумарними метаболітами та VO2 - R=0,39, p=0,014, нітратами та VO2 - R=0,41, p=0,011, та відсутність вірогідних зв’язків між рівнем сумарних метаболітів і лактатом - R=0,17, p=0,22. Оцінка за шкалою PRISM у хворих групи А дорівнювала 14,7±2,1 бали, а у групі В становила 8,7±2,1 бали і вірогідно відрізнялась (р
Висновки: У дітей із септичними станами спостерігається вірогідне збільшення продукції NO, яке корелює із показниками серцевого викиду, легеневого кровообігу, доставки і споживання кисню. Гіперпродукція NO має негативний вплив на систолічну функцію серця, проте не впливає негативно на інтегральні показники центральної та периферичної гемодинаміки. Розвиток легеневої гіпертензії при сепсисі у дітей імовірно можна пов’язувати з відносно недостатньою продукцією NO, що також асоціюється із меншим серцевим викидом. Збільшення продукції NO при сепсисі у дітей сприяє формуванню гіпердинамічного типу кровообігу із збільшенням доставки, споживання та екстракції кисню, отже може попереджати тканинну гіпоксію і органну дисфункцію.
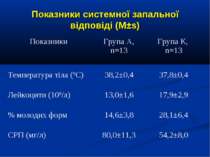
ДОСЛІДЖЕННЯ №2 РОЗЛАДИ ЛЕГЕНЕВОЇ ГЕМОДИНАМІКИ ПРИ СЕПТИЧНИХ СТАНАХ У ДІТЕЙ ТА МОЖЛИВОСТІ ЇХ КОРЕКЦІЇЇ ЗА ДОПОМОГОЮ ІНФУЗІЇ АРГІНІНУ-ГІДРОХЛОРИДУ
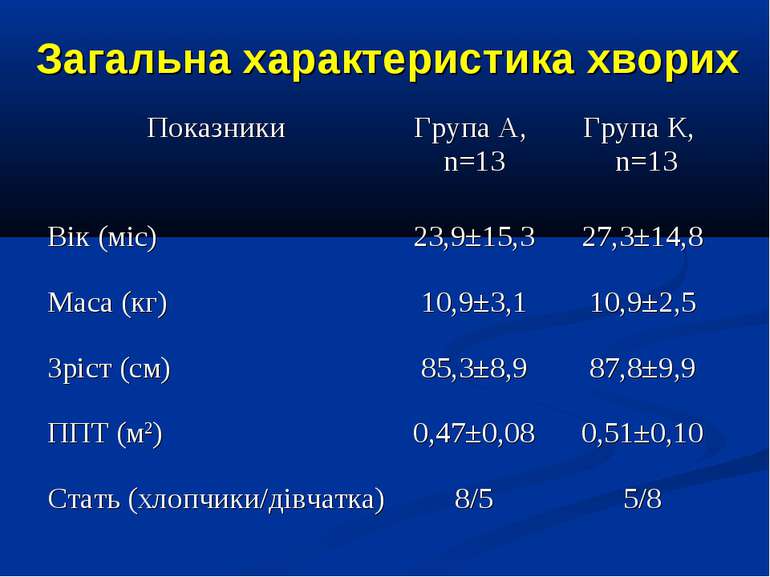
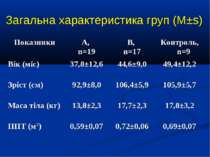
ДИЗАЙН Одноцентрове проспективне рандомізоване контрольоване порівняльне дослідження. Критерії включення: наявність сепсису, тяжкого сепсису (ТС), септичного шоку (СШ), перебіг яких ускладнився розвитком легеневої гіпертензії (середній артеріальний тиск у легеневій артерії – САТ ЛА понад 25 мм рт.ст.). Критерії виключення: наявність вроджених захворювань та вад серця, легень та ідіопатичної легеневої гіпертензії. Дослідження проведено протягом 2006-2009 рр. у 26 дітей, що находились на лікуванні у відділенні анестезіології та інтенсивної терапії Обласної дитячої інфекційної клінічної лікарні м. Харкова з септичними станами (13 пацієнтів сепсисом, 7 пацієнтів з тяжким сепсисом та 6 – з септичним шоком).
ДИЗАЙН Діагноз септичних станів встановлювався у відповідності до критеріїв консенсусу SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference (2001). Вік пацієнтів становив від 1 міс. до 16 років. Септичні стани у 11 хворих були зумовлені інфекціями респіраторного тракту, у 6 хворих - нейроінфекціями, у 5 бактеріальними гастроентероколітами, та іншими причинами – у 2 хворих.
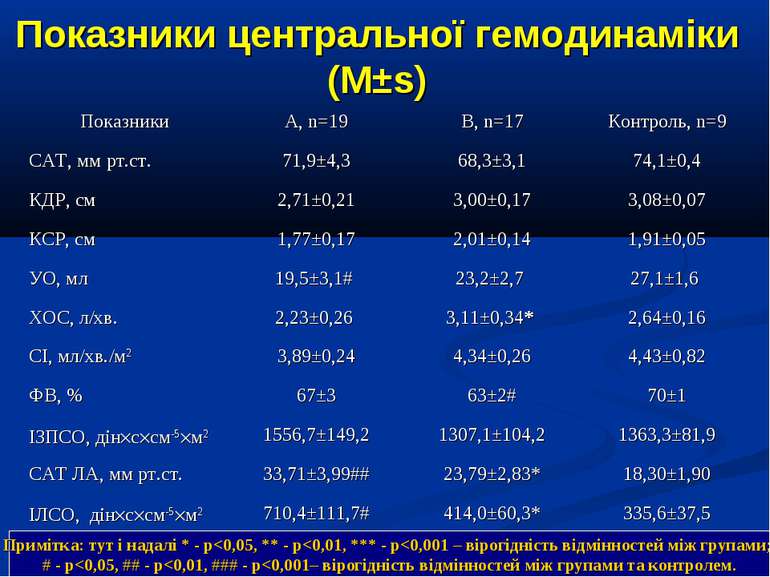
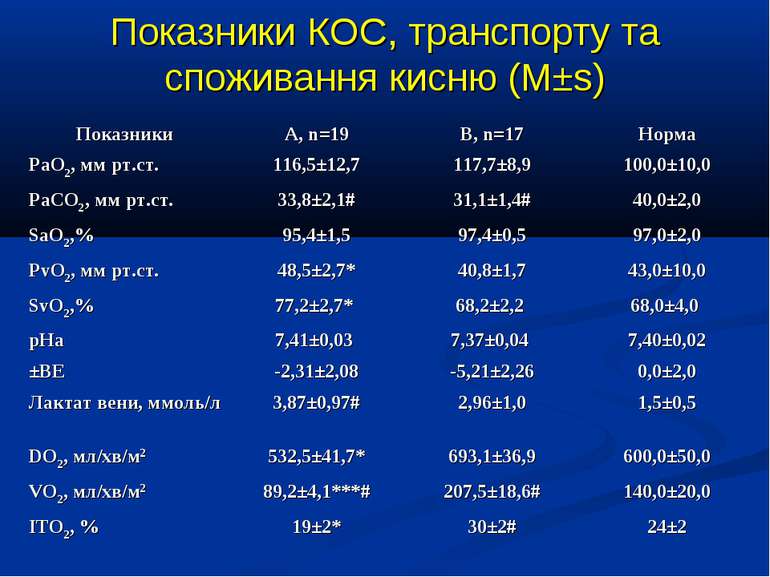
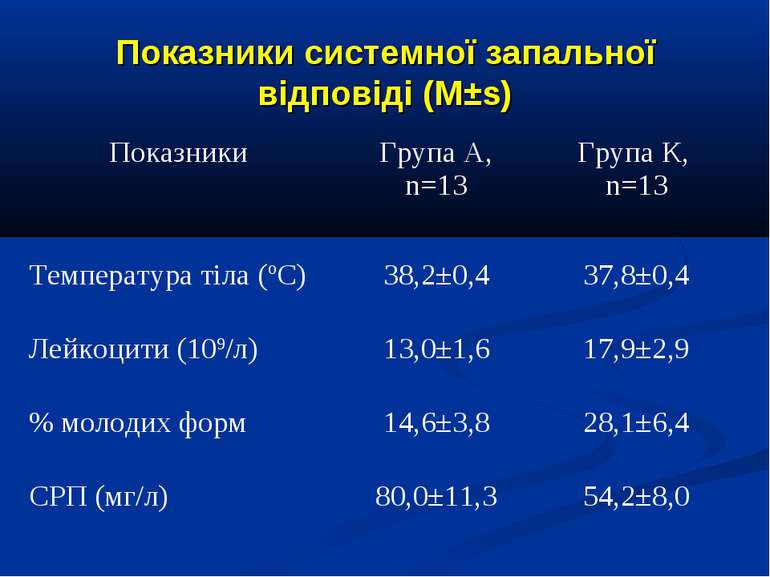
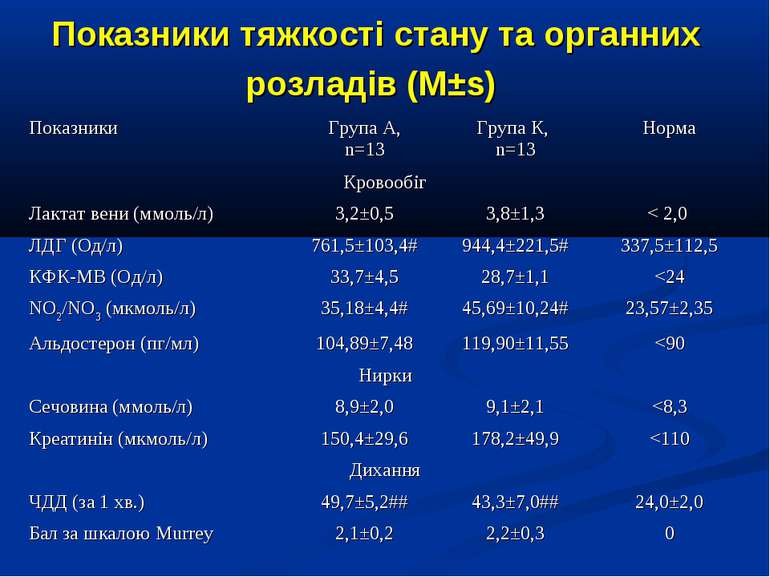
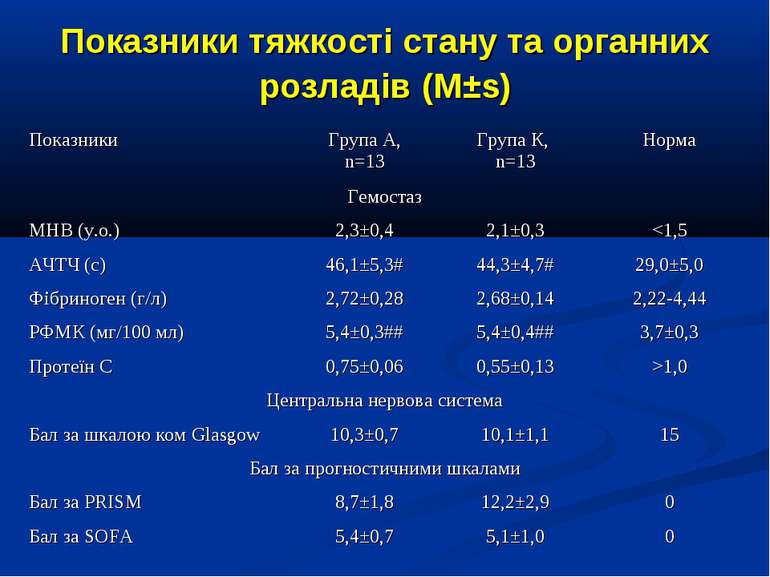
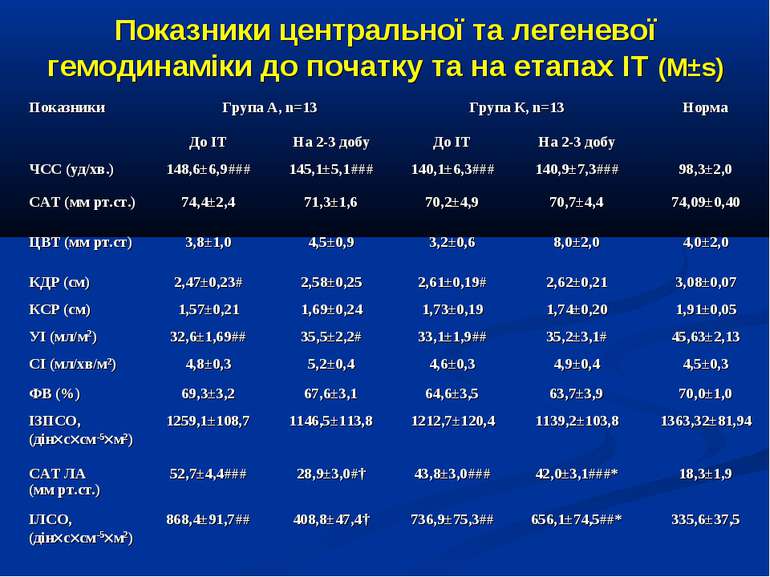
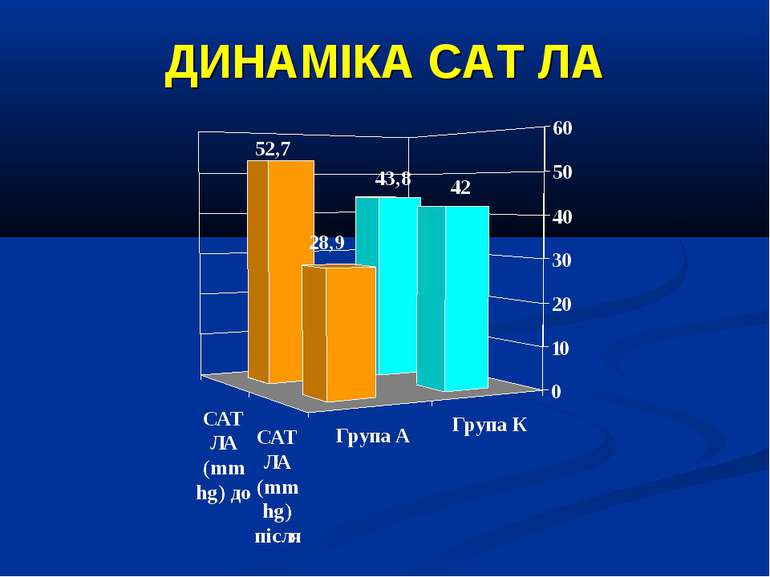
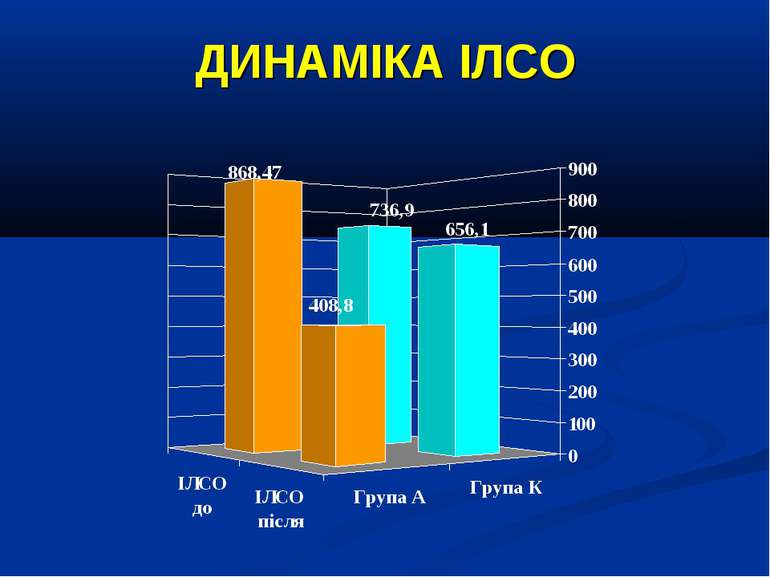
ДИЗАЙН Досліджувана група хворих (група А) додатково до етіотропної і патогенетичної терапії (інотропи, бронхолітики, дезагреганти, гепарин, респіраторна терапія) отримували інфузію 4,2% розчину аргініну гідрохлориду дозою 5 мл/кг/добу за допомогою інфузомату внутрішньовенно протягом 1-2 діб. Контрольна група хворих (група К) отримувала аналогічну етіотропну та патогенетичну терапію за виключенням аргініну гідрохлориду.
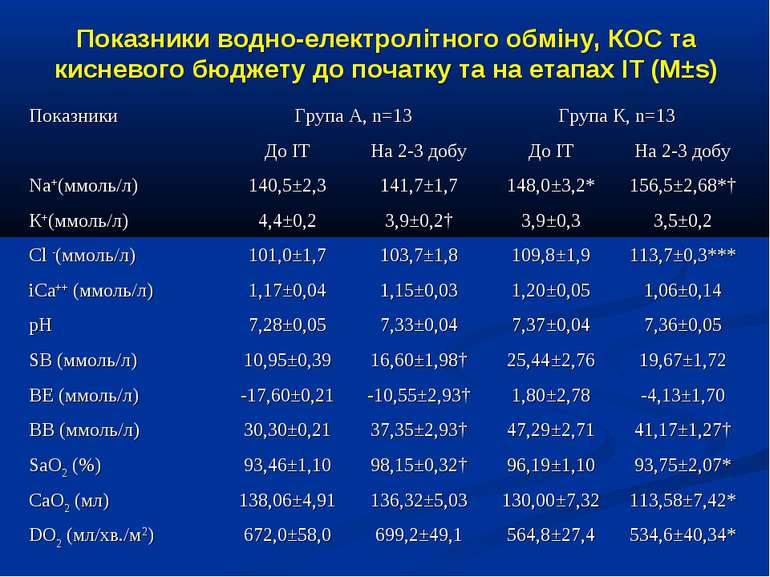
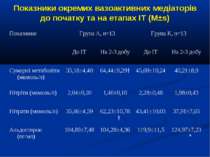
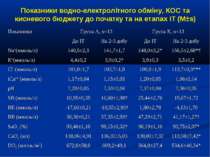
Показники водно-електролітного обміну, КОС та кисневого бюджету до початку та на етапах ІТ (M±s)
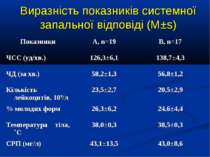
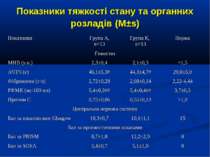
Протягом лікування ми не спостерігали негативного впливу аргініну на показники функції нирок. Також ми спостерігали певну здатність інфузії аргініну знижувати рівень глікемії у наших хворих. У групі А рівень глюкози знизився з 5,36±0,36 до 4,61±0,30 ммоль/л, що є позитивним зрушенням для хворих у септичному стані. Епізодів гіпоглікемії ми не спостерігали. У групі А респіраторна підтримка була необхідною у 5 хворих (38,3%), а у групі К – у 8 (61,5%). Тривалість респіраторної підтримки у групі А становила 7,8±3,0 доби, у групі К – 12,7±3,4 і вірогідно не відрізнялась між групами (p>0,05). У групі А летальних випадків не було, у групі К – померло 3 хворих (23,1%).
Висновки: Інфузія аргініну гідрохлориду дозою 5 мл/кг/добу у дітей із сепсисом здатна ефективно усувати легеневу гіпертензію. У зазначених дозах аргініну гідрохлорид сприяє нормалізації показників кисневого транспорту та КОС, нормалізує гіперглікемію. У дітей із сепсисом інфузія аргініну гідрохлориду дозою 5 мл/кг/добу попри збільшення рівню сумарних метаболітів NO не викликає несприятливого (у вигляді поглиблення гіповолемії чи вазодилятації) впливу на системну гемодинаміку. Для підтвердження отриманих попередніх даних щодо ефективності аргініну гідрохлориду при легеневій гіпертензії необхідно проведення подальших, бажано багатоцентрових досліджень, які мають також з’ясувати можливість впливу аргініну на скорочення тривалості респіраторної підтримки та зменшення летальності при сепсисі у дітей.
Схожі презентації
Категорії