Презентація на тему:
Визначення групи речовин, що ізолюється з біологічного матеріалу настоюванням з водою. Визначення чадного газу при гострих отруєннях
Завантажити презентацію
Визначення групи речовин, що ізолюється з біологічного матеріалу настоюванням з водою. Визначення чадного газу при гострих отруєннях
Завантажити презентаціюПрезентація по слайдам:
Група речовин, що ізолюється з біологічного матеріалу настоюванням з водою. Визначення чадного газу при гострих отруєннях Доц. Михалків М.М. Лекція № 15
ПЛАН. 1. Група речовин, які потребують особливих методів ізолювання. 2. Група речовин, що ізолюється з біологічного матеріалу настоюванням з водою. 3. Загальна характеристика фізичних і токсичних властивостей чадного газу. Хімічні і оптичні методи визначення чадного газу в крові.
1. ГРУПА РЕЧОВИН, ЯКІ ПОТРЕБУЮТЬ ОСОБЛИВИХ МЕТОДІВ ІЗОЛЮВАННЯ. 1.1 Сполуки фтору. Токсична дія: порушення обміну кальцію, пригнічують різні ферменти – холінестеразу, аденозинтрифосфатазу. Ідентифікація. Реакція травлення скла.
Утворення кремнійфторидної кислоти. СаF2 + H2SO4 = СаSO4 + 2HF 4HF + SiO2 = SiF4 + 2H2O 3SiF4 + 3H2O = 2H2SiF6 + 2H2SiO3 Реакція з цирконалізарином. Кількісний аналіз. Спектрофотометричний метод, що ґрунтується на вимірі оптичної густини потрійного комплексу (алізарин, солі церію (III), фторид-іони), що має синє забарвлення. Кількість визначають за градуювальним графіком.
1.2 Сполуки Хлору. Застосування. Вода діє на хлор дуже повільно, але в присутності речовин, які легко окисляються, відбувається швидкий гідроліз хлору, що обумовлює процес окиснення. Сl2 + НОН = НСl +НОСl; 2НОСl= Сl2 + Н2О2 Н2О2 = Н2О + O Кількісний аналіз може бути зроблений титруванням розчином нітрату срібла.
Санкт-Петербург аквапарк отруєння хлором (червень 2008) Липень 2007. 12 дітей під час купання в басейні ужгородського спорткомплексу "Спартак" отруїлися парами хлору. Відбувся витік хімічної речовини з системи дезінфекції води
1.3 Сполуки Брому Ізолювання брому. Пари брому витісняють повітрям Виявлення. Пари брому поглинають: 1) розчином йодиду калію, що містить крохмальний клейстер, - при наявності брому відбувається витиснення йоду, що викликає посиніння крохмалю. Br2 + 2KI = I 2 + 2KBr Заважають: хлор, йод, оксиди Нітрогену 2) розчином фенолу - бром викликає утворення білого осаду чи каламуть трибромфенолу.
Ізолювання бромідів додають натрій гідроксид, випарюють, висушують і спалюють при можливо низькій температурі. Ідентифікація: 1. З хлорною водою і хлороформом. 2Br- + СI2 = 2СI- + Br2 2. Дихромат калію в присутності концентрованої сульфатної кислоти. Пробірку закривають смужкою фільтрувального паперу, змоченого розбавленим лужним розчином флюоресцеїну - виходить рожеве чи червоне забарвлення (утворення еозину). К2Сr2O7 + 6 Br- + 7H2SO4 → Cr2(SO4)3 + K2SO4 + 7H2O + 3 Br2↑ + 3SO42-
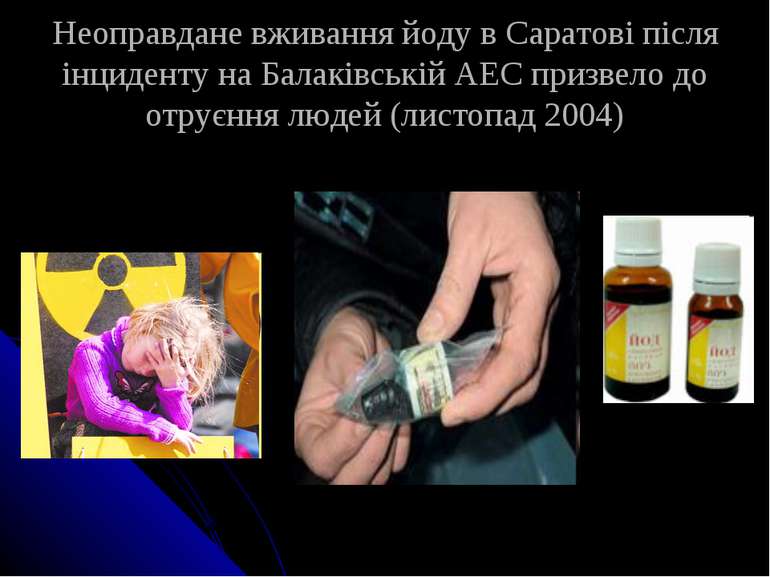
1.4 Сполуки Йоду Ізолювання йоду. Пари вільного йоду витісняють з об'єкта струмом повітря Виявлення. розбавлений крохмальний клейстером. Ізолювання йодидів. Біологічний матеріал підлужнюють натрій гідроксидом і спалюють. Виявлення. Нітрит натрію в присутності сульфатної кислоти. 2NO2– + 2I– + 4H+ = I2 + 2NO + 2H2O.
Неоправдане вживання йоду в Саратові після інциденту на Балаківській АЕС призвело до отруєння людей (листопад 2004)
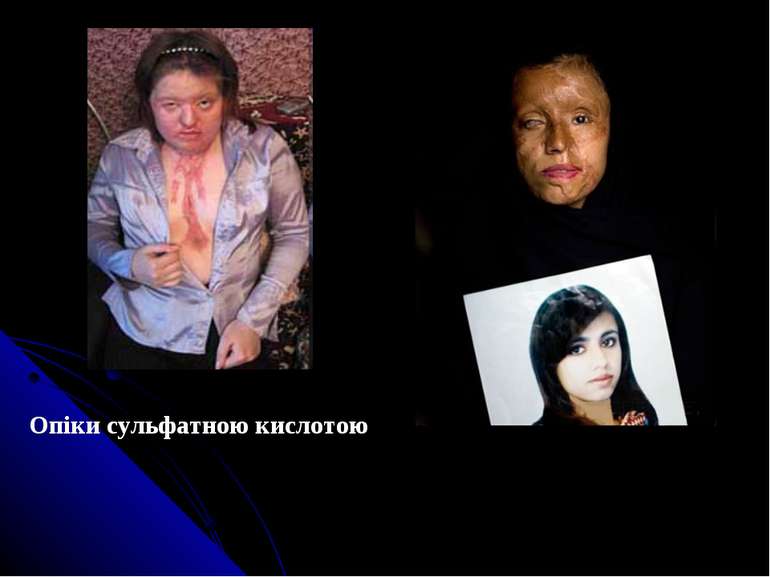
2. ГРУПА РЕЧОВИН, ЩО ІЗОЛЮЄТЬСЯ З БІОЛОГІЧНОГО МАТЕРІАЛУ НАСТОЮВАННЯМ З ВОДОЮ Гострі отруєння речовинами пекучої дії є одним з найбільш розповсюджених видів гострих побутових отруєнь. Ця патологія обумовлена в основному дією таких речовин: • неорганічних кислот (хлоридна, сульфатна, нітратна) - приблизно 7 %; • лугів (нашатирний спирт, їдкий натр, їдкий калій) - 15-20 %; • окислювачів (пероксид водню, калію перманганат) - 8 %; • нітратами; • нітритами. Причини отруєння: • Недотримання техніки безпеки при роботі з їдкими речовинами; • Побутові отруєння; • Медикаментозні отруєння; • Випадкові отруєння (при помилковому вживанні внутрішньо).
2.1. Кислоти. Хлоридна (соляна) кислота (НСl) - застосовується в побуті для видалення накипу з посуду, в медицині - 6 % розчин для лікування сверблячки, розчин хлориду цинку в хлоридній кислоті використовується для пайки. ГДК - 10 мг/м3. Смертельна доза - 15,0 мл. Сульфатна кислота (H2SO4) - Широко використовується в синтетичній промисловості, лабораторіях, аптечній справі та ін. ГДК - 1,5 мг/м3, середня - 0,5 мг/м3. Смертельна доза - 5,0 мл. Нітратна кислота (HNO3) ГДК - 10 мг/м3, середня - 4,0 мг/м3. Смертельна доза - 10,0 мл.
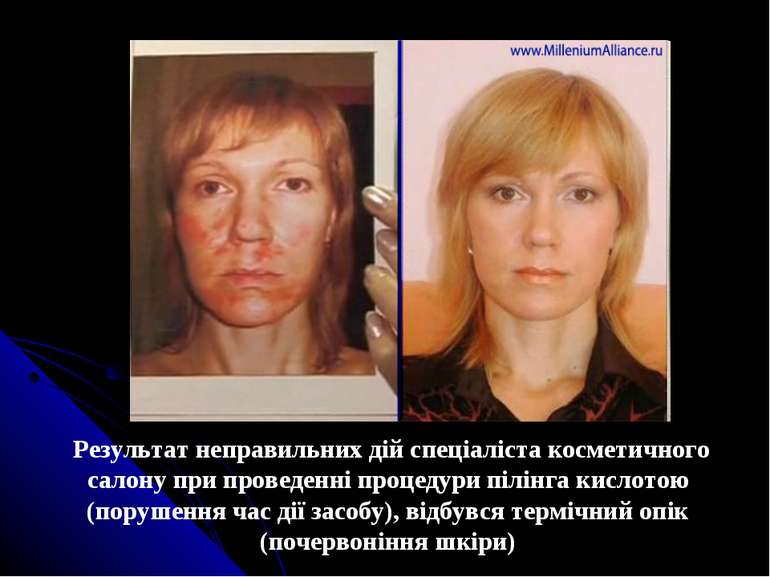
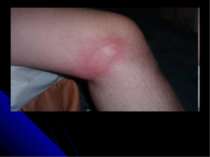
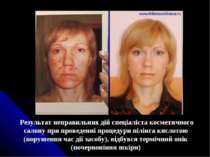
Результат неправильних дій спеціаліста косметичного салону при проведенні процедури пілінга кислотою (порушення час дії засобу), відбувся термічний опік (почервоніння шкіри)
Реакції ідентифікації: 1. для хлоридної кислоти: а) на хлорид-іони з розчином Аргентум нітрату Ag+ + Cl– = AgCl ; AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–. б) з калій хлоратом – посиніння йод крохмального паперу ClO3- + 5Cl- + 6H+ = 3Cl2 + 3H2O; Cl2 + 2І- = 2Cl– + І2 в) на присутність іонів гідрогену, зв’язаних з хлорид-іонами - відганяють хлороводень методом дистиляції і виявляють розчином Аргентум хлориду.
2. для сульфатної кислоти: Ізолювання: а) на присутність іонів гідрогену, зв’язаних з сульфат-іонами – з мідною стружкою, диоксид сульфуру відганяють у колбу з йодом, відбувається його знебарвлення Сu + H2SO4(конц) СuSO4 + SO2 + H2O. SO2 + I2 + 2H2O = 4H+ + SO42– + 2I– б) розчин барій хлориду Ba2+ + SO42– BaSO4 .
3. для нітратної кислоти: а) з шерстяною ниткою – пожовтіння. б) на присутність іонів гідрогену, зв’язаних з нітрат-іонами – з мідною стружкою, оксиди нітрогену поглинають водою, до якої потім додають дифеніламін (з’являється синє забарвлення). Сu + 4HNO3 Сu(NO3)2 + 2NO (NO2) + 2H2O. 2NO + O2 = 2NO2 2NO2 + H2O = HNO2 + HNO3
2.2. Луги. Нашатирний спирт (NH4OH) Застосовується при переробці вовни для знежирення, в лабораторіях та побу ті для чищення та відбілювання. Кров під дією аміаку набуває яскраво-червоного кольору, блювота при отруєнні супроводжується нападами задухи, може розвинутись крупозне запалення легенів. ГДК - 30 мг/м3. Їдкий натр (каустична сода NaOH), їдкий калій (КОН) ГДК - 3 мг/м3.
Реакції ідентифікації: 1. Для калій гідроксиду: лужне середовище індикаторним папером, іон Калію – з натрій гідротартратом, натрій гексанітрокобальтатом. K+ + HC4H4O6- KHC4H4O6 . 2K+ + Na+ + [Co(NO2)6]3- = K2Na[Co(NO2)6] . 2. Для натрій гідроксиду: лужне середовище індикаторним папером, іон Натрію – з калій гексагідроксостибіатом (V), цинк-уранілацетатом. Na+ + [Sb(OH)6]- Na[Sb(OH)6] . Na+ + Zn(UO2)3 (CH3COO)8 + CH3COO– + 9H2O NaZn(UO2)3 (CH3COO)9 9H2O . 3. Для аміаку: з купрум сульфатом і лакмусом, реактивом Несслера Cu2+ +4NH3 = [Cu(NH3)4]2+. NH4+ + 2[HgI4]2– + 4OH– = [NH2Hg2O]I + 7I– + 3H2O.
2.3. Нітрати і нітрити. Застосування: • У народному господарстві, промисловості (для добування барвників, входять до складу вибухових матеріалів); • У лабораторіях як реактиви; • Як лікарські препарати (нітрит натрію, амілнітрат, нітрогліцерин); • Як мінеральні добрива (KNO3, NaNO3, NH4NO3, Ca(NO3)2) - селітри; • Для консервування м'ясних продуктів як речовини, які діють на бактерії, що викликають ботулізм.
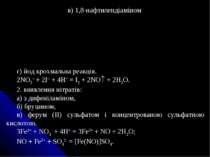
в) 1,8-нафтилендіаміном г) йод крохмальна реакція. 2NO2– + 2I– + 4H+ = I2 + 2NO + 2H2O. 2. виявлення нітратів: а) з дифеніламіном, б) бруцином, в) ферум (ІІ) сульфатом і концентрованою сульфатною кислотою. 3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO + 2H2O; NO + Fe2+ + SO42- = [Fe(NO)]SO4.
Засоби профілактики та лікування отруєнь 1. Промивання пошкоджених ділянок шкіри та очей великою кількістю води. 2. Промивання шлунка за допомогою зонда, змащеного вазеліновим мас лом, 8-10 л холодної води. 3. Лікування опіків травного тракту (пеніцилін, левоміцетин), кортико стероїди (преднізолон), спазмолітики (атропін, папаверин, платифілін). 4. Лікування порушень дихання (промивання дихальних шляхів 1 % роз чином гідрокарбонату натрію з антибіотиками). 5. Дієтотерапія (молоко, кисіль, яйця), вітамін А. 6. При отруєнні натрію нітритом - метиленовий синій (1 % розчин), аско рбінова кислота (5 % розчин), натрію тіосульфат (30 % розчин).
3. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ФІЗИЧНИХ І ТОКСИЧНИХ ВЛАСТИВОСТЕЙ ЧАДНОГО ГАЗУ. ХІМІЧНІ Й ОПТИЧНІ МЕТОДИ ВИЗНАЧЕННЯ ЧАДНОГО ГАЗУ В КРОВІ. Вміст СО у крові і ступені важкості отруєнь Вміст СОНb, % Стан людини Ступінь отруєння 0,3 - 0,7 Природна кількість СОНb, що утвориться з ендогенного СО2 - 1-5 6-9 16-20 Збільшення кровотоку в окремих органах. Підвищується поріг сприйняття світла. Головний біль, порушення зору. Легка 20-30 30 - 40 Пульсуюча головний біль, нудота. Важкий головний біль, втрата свідомості. Середня 50-60 67-70 Грудки, судоми. Без лікування - смертельний результат Важка
Хімічні методи визначення чадного газу в крові Найбільше часто для визначення чадного газу в крові хімічним методом використовують наступні реакції: 1. Проба Залесского (реакція з 10 % сульфатом міді (II)); 2. Проба Кункеля-Ветцеля (реакція з 3 % розчином таніну); 3. Проба Бюркера (реакція з 1 % розчином гексаціаноферату (III) калію); 4. Проба Гоппе-Зейлера (реакція з 30 % розчином гидроксиду натрію); 5. Проба Сальковского-Катаяма (реакція із сульфідом амонію); 6. Проба Хорошкевича-Маркса (реакція з хініном і сульфідом амонію); 7. Проба Сидорова (реакція з гексаціанофератом (III) калію і дихроматом калію); 8. Проба Рубнера (реакція з 5 % розчином основного ацетату свинцю); 9. Проба Лібмана (реакція з формаліном).
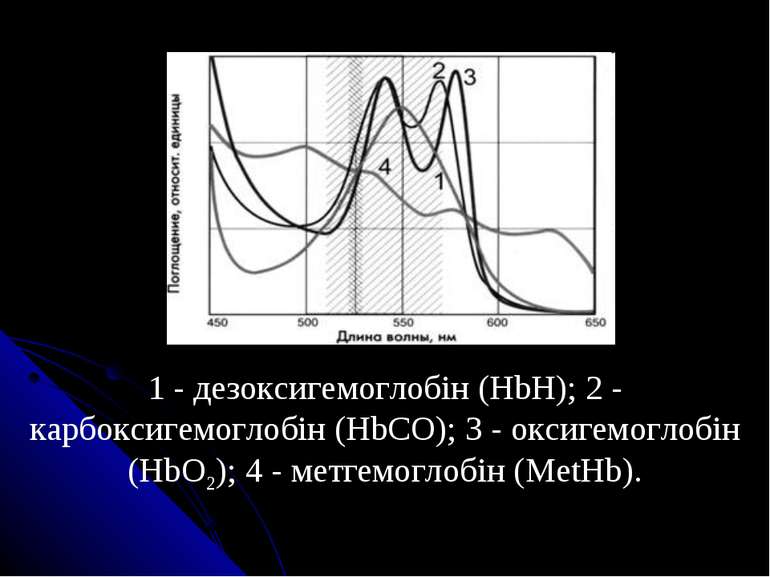
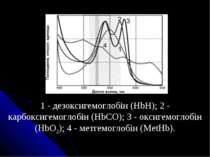
Спектри поглинання гемоглобіну та його сполук: 1 — гемоглобін; 2 — оксигемоглобін; 3 — карбоксигемоглобін; 4 — метгемоглобін
1 - дезоксигемоглобін (HbH); 2 - карбоксигемоглобін (HbCO); 3 - оксигемоглобін (HbO2); 4 - метгемоглобін (MetHb).
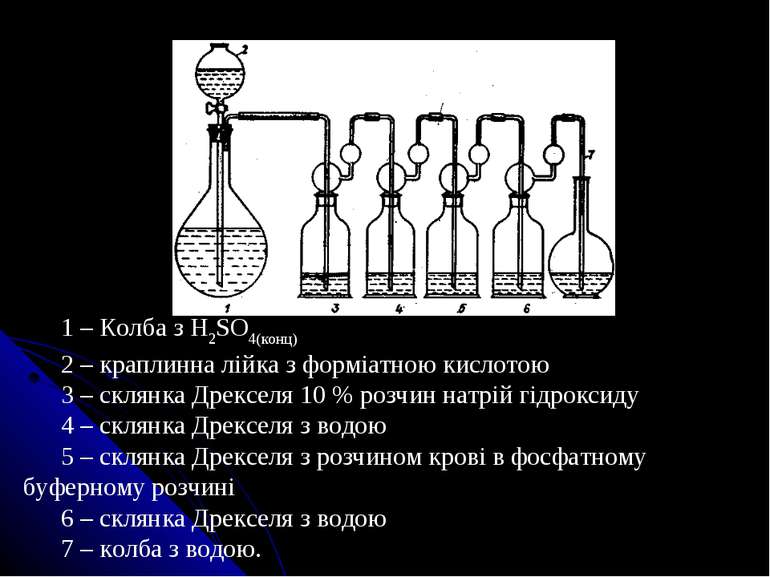
1 – Колба з H2SO4(конц) 2 – краплинна лійка з форміатною кислотою 3 – склянка Дрекселя 10 % розчин натрій гідроксиду 4 – склянка Дрекселя з водою 5 – склянка Дрекселя з розчином крові в фосфатному буферному розчині 6 – склянка Дрекселя з водою 7 – колба з водою.
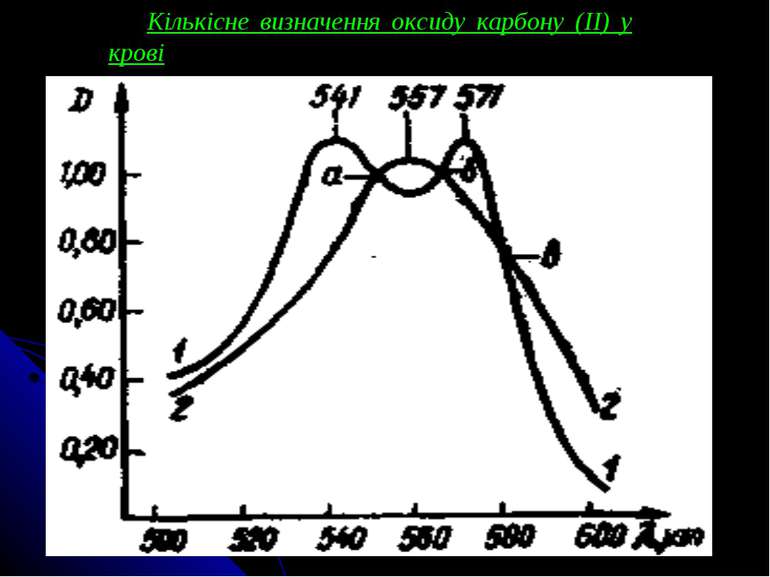
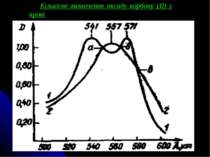
Розрахунок вмісту карбоксигемоглобіну в досліджуваній крові у відсотках (Р) роблять по формулі: де АСОНb - оптична густина розчину В, додатково насиченого оксидом карбону (II) (виміряна при 538 нм); АHbСОНb - оптична густина розчину Б, обробленого дитіонітом натрію, що містить суміш дезокси- і карбоксигемоглобіну (виміряна при 538 нм); АНbI - оптична густина розчину Б в ізобестичній точці (при 550 нм); К - коефіцієнт 0,372. Величина помилки визначення карбоксигемоглобіну в межах концентрацій від 3 до 20 % складає ± 3 %, при концентраціях понад 20 % похибка приблизно дорівнює ± 5 %.
Схожі презентації
Категорії